| 不同pH下好氧颗粒污泥的稳定性 |
好氧颗粒污泥[1-3](AGS)是微生物细胞在特殊的流体环境下自凝聚形成的颗粒状聚集物,其沉降速度远大于普通的活性污泥,并凭借丰富的生物种群具有耐高有机负荷、高耐毒性、单级同步脱氮除磷等优点已成为高效废水生物处理的热点研究方向[4, 5].现阶段,AGS已在实验室内取得大量研究成果,并已有中试及实际工程报道[6-8].但AGS技术仍存在颗粒化机理不明、稳定性维持困难等相关问题[9].其中长期运行条件下AGS稳定性变差、容易出现失稳,甚至解体现象是限制AGS工程化应用遇到的最大瓶颈[10].因此,如何实现AGS系统的高效稳定运行是该领域研究的重点之一.
pH是活性污泥法正常运行的重要调控因子[11],由于pH直接影响污泥中的微生物的种类与繁殖代谢,进而对污染物的去除能力与污泥的沉降性能有很大影响[12].大量研究表明活性污泥法对有机物去除的最适pH值为6.5~8.5[13-15].同样,研究表明pH值对AGS中微生物生长亦有重要影响,且AGS中不同种类的微生物最适生长的pH值也不尽相同. pH值在AGS形成过程中可对微生物种群进行生物选择,偏酸性环境(pH < 7)有利于丝状菌生长[16],形成的AGS结构松散、稳定性差且容易膨胀,但颗粒成型周期短;中性和碱性环境(pH≥7)下形成的AGS结构密实、稳定性好,并有利于硝化细菌生长[17],但颗粒成型时间长[18].偏酸与偏碱环境下AGS均具有良好的污染物降解能力.有研究得出pH值为6~9环境下,AGS对COD的去除率没有显著性差异[19].造纸废水[20]、制革废水[21]与矿山废水[22, 23]等工业废水经常呈现强酸、强碱特性,生物法处理这些废水前一般需要进行预处理,即对废水进行酸碱中和,但存在控制复杂、运行成本高等问题,且活性污泥对酸碱废水的耐受能力差.所以研究不同pH条件下AGS的稳定性及对酸碱废水的有效处理具有重要实际性意义.
基于以上事实,大量AGS的研究均将pH值控制在6~9范围内,但为使氨氮的去除效果达到较优,更多控制在中性偏碱性范围内,这一状况无疑会限制AGS的应用范围.除此之外,AGS对不同的酸碱性废水中的污染物去除效果及其稳定性维持研究报道很少.因此,为考察AGS对酸碱环境变化的敏感程度及其耐受力,研究不同pH值(3~5及10~12)下AGS的理化特性及对污染物去除效果变化,为AGS工业化应用提供技术支持.
1 材料与方法 1.1 反应装置反应在6个500 mL量筒(内径5 cm、有效高度26 cm、高径比为5.2)中分批进行.反应时间为2 h,期间采用电磁式空气泵供氧,曝气流量控制在84.8 L/h,即表面上升流速为1.2 cm/s.反应前加入成熟AGS及模拟污水至500 mL、利用碳酸氢钠和盐酸调控pH值. 6个量筒的pH值分别为3、4、5、10、11、12.反应温度为室温,平均约为21 ℃.反应结束后取泥样测定胞外聚合物(EPS)及比耗氧速率(SOUR)、取上清液测定水质指标.
1.2 接种污泥及模拟污水取实验室正常运行的反应柱中500 mL AGS泥水混合物,静置3~5 min,去除上清液,加入清水重复上述步骤2~3次后用于本实验.以乙酸钠、氯化铵、磷酸二氢钾等配置模拟污水,其对应的COD、氨氮、总磷(TP)浓度分别为600 mg/L、30 mg/L及6 mg/L.
1.3 分析项目及测试方法COD、氨氮、亚硝态氮、TP、pH等均采用国家标准分析方法测定[24],硝态氮采用麝香草酚分光光度法,总无机氮(TIN)为氨氮、硝态氮及亚硝态氮三者之和;污泥沉降比(SV)、污泥容积指数(SVI)、混合液悬浮固体浓度(MLSS)、混合液挥发性悬浮液固体浓度(MLVSS)采用标准方法;利用数码相机记录污泥形态变化.污泥的EPS采用热提取法,具体操作可见课题组已发表成果[25].提取的EPS中的蛋白质(PN)测定采用考马斯亮蓝试剂法,多糖(PS)测定采用硫酸-苯酚法. SOUR的测定采用OCHOA等[26]推荐的方法,其中,SOURH表示异养菌的代谢活性,SOURNH4表示亚硝酸细菌的代谢活性,而SOURNO2则表示硝酸细菌的代谢活性,SOURNH4及SOURNO2之和为硝化细菌的代谢活性(SOURN).
2 结果与讨论 2.1 酸碱环境中AGS的理化特性 2.1.1 AGS形态变化不同的酸碱环境下污泥形态变化如图 1所示.观察发现,反应结束后除了pH值为5的污泥变化不明显,在pH值为3、4、10、11、12的反应器均出现污泥上浮现象,且上清液变浑浊,污泥的沉降性能下降,其中pH值为12的反应器污泥上浮十分明显,且在反应器出口产生大量生物泡沫.说明强酸碱环境下大部分微生物不适生存,且微生物死亡后失去自凝聚能力,导致污泥结构、形态遭到一定破坏,从而影响污泥的沉降性能,使污泥上浮;另外可能是由于浮游细菌和丝状菌的过度增长导致污泥膨胀上浮.在pH值为3、11和12时发现部分颗粒已经解体,证明在这3种pH环境对微生物有较大影响,微生物无法正常生长.
 |
| 图 1 AGS处理不同pH废水(每组试验从左至右:0 min-60 min-120 min-125 min) Fig. 1 AGS treatment of different pH wastewater (from left to right in each group: 0 min-60 min-120 min-125 min) |
2.1.2 胞外聚合物(EPS)
EPS是在特殊环境下微生物分泌的复杂高分子不溶性有机物,主要由多糖、蛋白质等组成,在AGS形成与维持结构稳定过程中具有关键作用[27].酸碱环境中AGS的EPS变化如图 2(a)所示.从图 2(a)中可知,随着pH的升高,EPS整体呈上升趋势(76.43~178.45 mg/g MLSS).酸性环境(pH≤5)下,EPS的上升随pH递增而先急后缓(76.43~102.50 mg/g MLSS),低pH(pH值为3)环境使大量蛋白质失活从而导致EPS的含量减少,当pH值由3升到5时,EPS含量增加,并观察到颗粒污泥越来越稳定,这与大量研究得出的EPS有利于细胞之间的自凝聚及AGS的稳定性维持[28-30]是一致的;在碱性环境(pH≥10)下EPS递增速率(93.72~178.45 mg/g MLSS)明显大于酸性环境,AGS为了抵御外界环境pH逐渐升高的变化,颗粒分泌更多的EPS覆盖于细胞表面,减缓碱性环境对AGS内部细胞的抑制作用,但由于碱度增加影响了微生物的代谢作用,所以在碱性环境中EPS增加的主要原因是生物细胞容易遭到破坏,细胞内含物的流出增加了EPS中蛋白质的含量[31],在pH≥10时,PN/PS呈现显著上升趋势(0.17~0.24)也验证了这一结论. PN/PS在pH≤5时,呈现先下降(0.06~0.04 mg/g)后上升趋势,表明EPS的少量增加主要是多糖含量增加导致,这主要是在较低的pH环境下,大量游离的H+使蛋白质变性失活,从而使检测到的蛋白质含量较少. PS及PN在EPS中的贡献及其对AGS稳定性的作用十分复杂且尚无统一论断. SEVIOUR等[32]发现,细胞EPS及其多糖取决于环境中pH变化引起的溶胶—凝胶程度,而EPS凝胶强度与PN无直接关系.这一论断与实验结果一致,pH变化引起EPS急剧升高但PN/PS变化微弱(0.06~0.24),说明PS含量的增加对EPS升高有重要贡献.
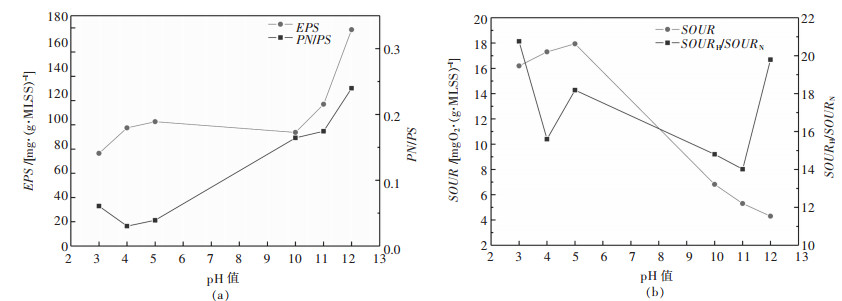 |
| 图 2 AGS处理不同pH废水的EPS & PN/PS、SOUR & SOURH /SOURN变化 Fig. 2 Changes of EPS & PN/PS, SOUR & SOURH /SOURN in different pH wastewater treated by AGS |
2.1.3 比好氧速率(SOUR)
酸碱废水对SOUR的影响变化如图 2(b)所示.在酸性环境(pH≤5)中,随着pH值接近7,SOUR保持增大趋势(16.19~17.94 mg O2/(g MLSS·h)),细胞的活性逐渐增强;碱性环境(pH≥10)中,随pH递增,SOUR呈现明显减小趋势(6.81~4.30 mg O2/(g MLSS·h)),表明大部分微生物已经失活,这也印证了EPS的增加是碱度造成细胞结构破坏所致.同样由SOUR的数据可知AGS对酸性环境具有更高的耐冲击负荷能力,这与EPS及PN/PS的变化趋势一致. SOURH/SOURN在酸性环境或在碱性环境中的波动都较大,说明异养菌和自养菌对pH变化都很敏感.在pH<4和pH>11时,自养菌同样迅速失去活性,这表明pH值为4和11时几乎已是自养菌的耐受力极限.
2.2 酸碱环境中AGS处理污染物出水水质变化 2.2.1 TIN去除效果pH对生物脱氮有重要影响,AGS对不同pH废水的TIN去除效果如图 3(a)所示,在酸性环境(pH≤5)下,出水氨氮、TIN呈小幅下降趋势(27.40~23.40 mg/L、27.61~23.56 mg/L),亚硝态氮、硝态氮维持稳定(0.06~0.01 mg/L、0.15~0.14 mg/L);在碱性环境(pH≥10)下,出水氨氮、TIN进一步降低(23.16~21.32 mg/L、23.35~22.20 mg/L),亚硝态氮几乎全程无波动(0.04~0.74 mg/L)、硝态氮也稳定维持在0.14 mg/L左右.出水亚硝态氮和硝态氮在不同的酸碱环境下变化平缓,且没能实现积累,表明硝化细菌受到了严重的抑制,几乎没有发生硝化反应;氨氮与TIN保持了较好地同步变化趋势、且氨氮是出水TIN的主要贡献者,这表明同化作用是TIN去除的主要方式.而碱性环境下氨氮和TIN的去除率均优于酸性环境,是由于强碱性环境中高曝气条件下起到的吹脱作用.
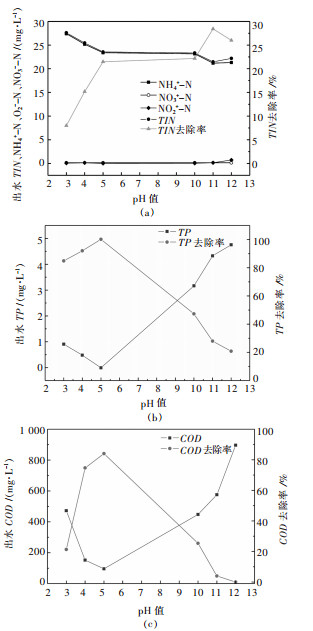 |
| 图 3 AGS处理不同pH废水TIN、TP、COD出水浓度及去除率 Fig. 3 The effluent TIN, TP, COD concentration and removal rate under different pH wastewater treated by AGS |
2.2.2 TP去除效果
TP去除效果如图 3(b)所示.在酸性环境(pH≤5)下,随着pH的升高出水TP浓度呈下降趋势(1.0~0 mg/L),在pH较低的条件下TP去除率仍能保持80 %以上,说明酸性环境对AGS除磷能力影响较小;在碱性环境(pH≥10)下,出水TP浓度(3.16~4.75 mg/L)明显高于酸性组,TP的去除率也呈直线下降,由pH=10时的47 %下降到pH=12时的20.8 %,说明生物除磷受碱性环境的影响更大.虽然有研究表明在一定范围内较高的pH有利于聚磷菌的好氧吸磷与厌氧释磷[12],但在碱度过高的环境下,聚磷菌已经失去了好氧吸磷的功能[33],而被去除的少部分磷仅用于微生物的生长代谢.
2.2.3 COD去除效果AGS对COD的去除效果如图 3(c)所示.酸性环境下(pH值为3~5),出水COD随着pH的增大而下降(500~100 mg/L),尤其在pH值由3升到4时,COD的去除率大大提高,在pH=5时,去除率达到了84 %,说明在酸性条件pH为4到5时对异养菌的影响不大,而pH为3的环境下对对异养菌有抑制作用;而在碱性(pH在10~12)环境下,出水COD则逐渐增大(400~900 mg/L),AGS逐渐失去对COD的去除作用,且COD浓度在pH达到12时大于其进水浓度,去除率由25.3 %下降到零.这表明微生物细胞结构遭到破坏,细胞基质溶出,导致反应器内的COD不降反升,且大量异养微生物失活导致其失去COD的降解能力.
3 结论1)在酸性条件下,AGS的EPS含量(76.43~102.50 mg/g MLSS)与SOUR(16.19~17.94 mg O2/(gMLSS·h))均随pH升高而增大;出水TP(1.0~0 mg/L)、COD(500~100 mg/L)的浓度均随pH升高而降低,其中TP去除率保持在80 %以上.然而,由于pH对硝化细菌的影响较大,所以反应对氨氮的去除效果并不佳,且亚硝态氮和硝态氮没有出现大量积累,表明同化作用是TIN去除的主要方式.
2)在碱性环境中,pH值为11和12时,AGS结构形态破化严重,并发现部分污泥解体、微生物失活,导致细胞基质溶出使得COD不降反升,AGS几乎失去了去除污染物的能力,而氨氮的少量去除是由于吹脱作用和部分同化作用.与强酸性环境相比,AGS对碱性环境的耐受力更差.
| [1] |
CAMPOS J L, FIGUEROA M, MOSQUERA-CORRAL A, et al. Aerobic sludge granulation: state-of-the-art[J].
Water Science and Technology, 2009, 1(2): 136–151. |
| [2] |
LIU Y, TAY J H. State of the art of biogranulation technology for wastewater treatment[J].
Biotechnology Advance, 2004, 22(7): 533–563. DOI: 10.1016/j.biotechadv.2004.05.001. |
| [3] |
KHAN M Z, MONDAL P K, SABIR S. Aerobic granulation for wastewater bioremediation: a review[J].
Canadian Journal of Chemical Engineering, 2013, 91(6): 1045–1058. DOI: 10.1002/cjce.v91.6. |
| [4] |
NANCHARAIAH Y V, SARVAJITH M, LENS P. Selenite reduction and ammoniacal nitrogen removal in an aerobic granular sludge sequencing batch reactor[J].
Water Research, 2018, 131: 131–141. DOI: 10.1016/j.watres.2017.12.028. |
| [5] |
宣鑫鹏, 赵珏, 刘祖文, 等. 好氧颗粒污泥处理垃圾渗滤液研究进展[J].
江西理工大学学报, 2017, 33(5): 63–69.
|
| [6] |
NI B J, XIE W M, LIU S G, et al. Granulation of activated sludge in a pilot-scale sequencing batch reactor for the treatment of low-strength municipal wastewater[J].
Water Research, 2009, 43(3): 751–761. DOI: 10.1016/j.watres.2008.11.009. |
| [7] |
LONG B, YANG C Z, PU W H, et al. Rapid cultivation of aerobic granular sludge in a pilot scale sequencing batch reactor[J].
Boresource Technology, 2014, 166(8): 57–63. |
| [8] |
PRONK M, DE K M K, DE B B, et al. Full scale performance of the aerobic granular sludge process for sewage treatment[J].
Water Research, 2015, 84: 207–217. DOI: 10.1016/j.watres.2015.07.011. |
| [9] |
彭永臻, 吴蕾, 马勇, 等. 好氧颗粒污泥的形成机制、特性及应用研究进展[J].
环境科学, 2010, 31(2): 273–281.
|
| [10] |
LEE D J, CHEN Y Y, SHOW K Y, et al. Advances in aerobic granule formation and granule stability in the course of storage and reactor operation[J].
Biotechnol Adv, 2010, 28(6): 919–934. DOI: 10.1016/j.biotechadv.2010.08.007. |
| [11] |
STORM P F, JENKINS D. Identification and significance of filamentous microorganisms in activated sludge[J].
Journal of the Water Pollution Control Federation, 1984, 56: 449–459. |
| [12] |
王伸, 邓良伟, 徐则, 等. pH值对好氧处理及污泥性能的影响[J].
中国沼气, 2016, 34(5): 22–26.
DOI: 10.3969/j.issn.1000-1166.2016.05.005.
|
| [13] |
ZHOU Y, XIA S, NGUYEN B T, et al. Interactions between metal ions and the biopolymer in activated sludge: quantification and effects of system pH value[J].
Frontiers of Environmental Science & Engineering, 2017, 11(1): 1–9. |
| [14] |
YAN L, LIU Y, REN Y, et al. The effect of pH on the eficiency of an SBR processing piggery wastewater[J].
Biotechnology and bioprocess engineering, 2013, 18(6): 1230–1237. DOI: 10.1007/s12257-013-0292-6. |
| [15] |
欧阳云. 降低活性污泥膨胀的污水处理工艺[J].
化工设计通讯, 2016, 42(8): 101–102.
DOI: 10.3969/j.issn.1003-6490.2016.08.079.
|
| [16] |
张崇淼, 牛全睿, 徐丽梅, 等. 膨胀污泥中丝状菌的分离鉴定与特性分析[J].
环境科学, 2017, 38(6): 2477–2485.
|
| [17] |
王新为, 孔庆鑫, 金敏, 等. pH值与曝气对硝化细菌硝化作用的影响[J].
解放军预防医学杂志, 2003, 21(5): 319–322.
DOI: 10.3969/j.issn.1001-5248.2003.05.003.
|
| [18] |
傅金祥, 唐玉兰, 王海彪, 等. 不同pH值下好氧颗粒污泥形成过程与特性[J].
沈阳建筑大学学报(自然科学版), 2010, 26(4): 734–738.
|
| [19] |
黄国玲, 解庆林, 艾石基, 等. pH和DO对好氧颗粒污泥去除高氨氮废水的影响研究[J].
环境科学与管理, 2012, 37(4): 27–29.
DOI: 10.3969/j.issn.1673-1212.2012.04.009.
|
| [20] |
张晓龙. 废纸造纸废水处理技术分析[J].
环境与发展, 2017, 29(3): 171–172.
|
| [21] |
吴娜娜, 郑璐, 李亚峰, 等. 皮革废水处理技术研究进展[J].
水处理技术, 2017(1): 1–5.
|
| [22] |
郭旭颖, 董艳荣, 里莹, 等. 自燃煤矸石吸附煤矿酸性废水矿物学特性研究[J].
非金属矿, 2017, 40(3): 97–100.
DOI: 10.3969/j.issn.1000-8098.2017.03.027.
|
| [23] |
郑先坤, 冯秀娟, 王佳琪, 等. 酸性矿山废水的成因及源头控制技术[J].
有色金属科学与工程, 2017, 8(4): 105–110.
|
| [24] |
国家环境保护总局.
水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2006.
|
| [25] |
龙焙, 程媛媛, 赵珏, 等. 好氧颗粒污泥处理化工废水的应用研究[J].
中国给水排水, 2017, 33(5): 26–32.
|
| [26] |
OCHOA J C, COLPRIM J, PALACIOS B, et al. Active heterotrophic and autotrophic biomass distribution between fixed and suspended systems in a hybrid biological reactor[J].
Water Science and Technology, 2002, 46(1/2): 397–404. |
| [27] |
付尧, 暴瑞玲, 顾文卓, 等. 低水力负荷下好氧颗粒污泥的特性及胞外聚合物关键组分对该污泥稳定性的影响[J].
净水技术, 2017(2): 11–18.
|
| [28] |
闫立龙, 刘玉, 任源. 胞外聚合物对好氧颗粒污泥影响的研究进展[J].
化工进展, 2013, 32(11): 2744–2748.
|
| [29] |
KINYUA M N, ELLIOTT M, WETT B, et al. The Role of Extracellular Polymeric Substances on Carbon Capture in a High Rate Activated Sludge A- Stage System[J].
The Chemical Engineering Journal, 2017, 322: 428–434. DOI: 10.1016/j.cej.2017.04.043. |
| [30] |
李定昌, 王琦, 高景峰, 等. 不同粒径成熟好氧颗粒污泥EPS的三维荧光光谱特性[J].
中国给水排水, 2018, 34(7): 26–31.
|
| [31] |
高永青, 彭永臻, 王建龙, 等. 剩余污泥水解酸化过程中胞外聚合物的影响因素研究[J].
中国环境科学, 2010, 30(1): 58–63.
|
| [32] |
SEVIOUR T W, LAMBERT L K, PIJUAN M, et al. Selectively inducing the synthesis of a key structural exopolysaccharide in aerobic granules by enriching for Candidatus, " Competibacter phosphatis "[J].
Applied Microbiology & Biotechnology, 2011, 92(6): 1297–1305. |
| [33] |
OEHMEN A, VIVES M T, LU H, et al. The effect of pH on the competition between polyphosphate--accumulating organisms and glycogen--accumulating organisms[J].
Water Research, 2005, 39(15): 3727–3737. DOI: 10.1016/j.watres.2005.06.031. |
 2019, Vol. 10
2019, Vol. 10


