| 萃取法从废旧锂离子电池正极材料浸出液中提取锂 |
b. 中南大学 材料科学与工程学院,长沙 410083
b. School of Materials Science and Engineering, Central South University, Changsha 410083, China
由于锂离子电池具有电压高、比能量大、循环寿命长、自放电小等一系列的优良性能,已被广泛地应用于新能源汽车、移动电话、数码相机、笔记本电脑等诸多领域[1, 2].随着锂离子电池的广泛应用,废旧电池的量也不断增加[1, 3, 4].废旧锂离子电池的回收利用不仅可以减少环境污染,还能从废旧电池中回收有价金属,从而有效地缓解资源短缺.然而,电池三元材料中镍、钴、锰的整体回收率在50 %以上,而锂的回收率还不足1 % [5, 6].
当前,人们对于锂离子电池材料的回收利用进行了大量的研究工作.废旧锂离子电池一般经过拆解、NMP浸泡正极材料、酸浸等步骤后,得到正极材料浸出液[7, 8],浸出液中的锂含量为2~5 g/L[9, 10],远高于盐湖中锂的含量0.016~2 g/L[11].但是,一直以来没有一个很好的方法来从电池浸出液中回收锂.
随着锂电池行业的快速发展,锂离子电池价格的不断上升,废旧锂电池中锂的回收越来越受到人们的重视.
浸出液的主要成分为Li+、Ni2+、Co2+、Mn2+[7, 12],而盐湖卤水的主要成分为Li+、Mg2+、K+、Na+[13-15].这二者实质上都是锂盐溶液,不同的只是浸出液中锂的浓度更高且不含氯离子或者氯离子浓度较低.而盐湖卤水除了含有一定量的氯化锂,还含有大量的氯化钠、氯化镁存在,氯离子浓度相对也比较高.特别是氯化镁,由于镁/锂性质相似,导致盐湖卤水中锂的利用困难.为此人们进行了大量的研究工作,开发了多种选择性提锂的方法[15].其中TBP萃取法是一个非常有效的提锂方法,该方法使用TBP作为萃取剂,FeCl3作为共萃剂,磺化煤油作为稀释剂[13, 16, 17].在萃取过程中,大量的Cl-与Fe3+络合成FeCl4-,进而与Li+结合形成LiFeCl4,而TBP上的P=O与LiFeCl4金属络合物的配位水分子通过氢键作用实现萃取,有效地与镁分离[11].
其实,含锂浸出液也可以看做一种特殊的“盐湖卤水”.但由于一般不含镁,并无镁锂分离之虞.此外,由于浸出液中含有相对较少甚至不含氯离子,Fe3+与Cl-的络合效应相当微弱,无法形成充分的LiFeCl4来保证萃取过程的进行.因此,在这种浸出液中,TBP提取方法看似是无效的.而氯化钠是一种非常廉价的工业材料,如果将氯化钠加入浸出液中, 可以很容易地将氯调节到足够高的浓度,使其与真实的卤水更加相似.那么有可能借鉴盐湖提锂的TBP萃取法进行处理.
针对这一思路,开展了TBP萃取法从废旧锂离子电池正极材料浸出液中选择性回收锂的可能性与工艺条件研究.
1 实验 1.1 实验原料及分析方法实验用的水相为人工合成的模拟锂离子电池正极三元材料Li(Ni1/3CO1/3Mn1/3)O2浸出液,模拟液各离子浓度如表 1所列.萃取实验所用磷酸三丁酯、磺化煤油为化学纯,其余试剂均为分析纯.
| 表 1 模拟液各离子浓度 Table 1 The concentration of ions in simulated solution |
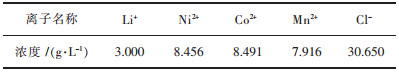 |
| 点击放大 |
实验采用电感耦合等离子光谱发生仪检测水相Li+、Na+、Fe3+、Ni2+、Co2+、Mn2+的含量,并分析水相中水相各种离子含量的变化,通过差减法来计算有机相中各种离子含量的变化.
1.2 实验原理及方法当溶液中有FeCl3存在时,以下阳离子被TBP共萃取的顺序为:H+>Li+>>Mg2+>Na+[18]. Li+被共萃的能力远远强于Na+.
为了防止在电池浸出液中引入Fe3+杂质,避免对后续Ni2+,Co2+,Mn2+的提取增加难度,本实验分为2个步骤进行:有机相负载Fe3+和萃取Li+.
有机相负载Fe3+:
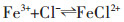
|
(1) |
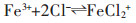
|
(2) |
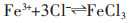
|
(3) |
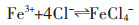
|
(4) |
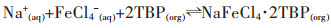
|
(5) |
萃取Li+:
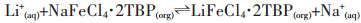
|
(6) |
在有机相负载Fe3+的过程中,以氯化钠的形式向FeCl3溶液中补充Cl-,以确保Fe3+与Cl-充分络合,使之完全转化为FeCl4-;为了防止Fe3+在高pH条件下发生水解,实验过程中在溶液里加入适量的盐酸.
在从模拟料液里萃取Li+的过程中,为了防止低氯浓度条件下有机相的Fe3+损失,在模拟浸出液中加入一定量的氯化钠来补充Cl-,起到了很好的效果.
以上2个实验过程均在分液漏斗中进行,由恒温水浴振荡器来振荡漏斗,使反应充分进行.
2 结果和讨论在从模拟料液中萃取锂之前,通过TBP负载Fe3+来制备了锂的专属萃取NaFeCl4·2TBP,通过实验,获得了有机相负载Fe3+的较优实验条件:水相成分为FeCl3 0.4 mol/L,NaCl 4.5 mol/L,HCl 0.1 mol/L;有机相为100 % TBP;相比(VO/VA)为1.2;温度为30 ℃;振荡频率为220 r/min;振荡时间为5 min.在此条件下,铁的单级萃取率高达99 %以上.
通过使用以上实验所制备的专属萃取剂,并依此进行了萃取锂的研究工作.
2.1 水相中氯化钠浓度的影响图 1显示了NaCl浓度对Li+萃取率和对有机相中Fe3+损失率的影响.当上述所制得锂的专属萃取剂直接萃取模拟浸出液时,Li+的萃取率相对较低,并会有大量Fe3+从有机相脱落到水相中.根据化学方程式(1)~式(6),当氯离子浓度升高时,化学反应向右进行.因此,适当的Cl-浓度是防止有机相中Fe3+损失和提高Li+萃取率的关键.通过实验发现,所添加的NaCl越多,有机相中Fe3+损失率就越少,同时Li+的萃取率就越高.由图 1可知,当NaCl浓度达到200 g/L时,随着NaCl浓度的进一步升高,两条曲线均没有明显的变化,这看似已经达到了较优条件,但该情况下仍有少量的Fe3+会从有机相脱落到溶液中,而这会对后续Ni2+、Co2+、Mn2+的提取造成影响,因此需要继续调整实验条件来进一步防止有机相中Fe3+的脱落.当继续把溶液中NaCl浓度调整到250 g/L时,可以发现有机相中的铁不再损失.
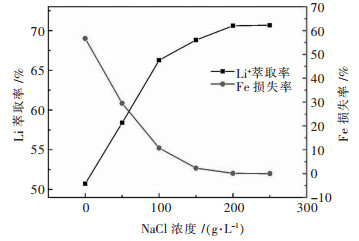 |
| 注:有机相为100 %负载铁后的TBP;相比(VO/VA)为3;温度为30 ℃;振荡频率为220 r/min;振荡时间为10 min. 图 1 NaCl浓度对铁损失率及锂萃取率的影响 Fig. 1 Effect of NaCl concentration on the loss rate of Fe3+ and the extraction rate of Li+ |
2.2 有机相中TBP浓度的影响
为了解有机相中TBP浓度对于锂萃取率的影响,本研究将磺化煤油与负载铁后的TBP按照不同的体积比充分混合后来进行萃取实验,结果如图 2所示,随着TBP浓度的不断增加,锂的萃取率是不断上升的,当TBP浓度达到100 %时,锂的萃取率达到最高值.值得注意的是,在整个TBP浓度范围内进行实验,萃取完后分相过程均在30 s内完成.由于纯TBP和250 g/L NaCl溶液的密度分别为0.98 g/cm3和1.16 g/cm3,可见密度相差较大对于分相来说是十分有利的.
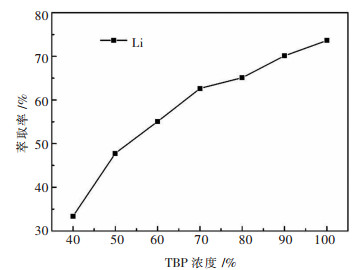 |
| 注:水相为加入250 g/L的NaCl的模拟液;相比(VO/VA)为3;温度为30 ℃;振荡频率为220 r/min;振荡时间为10 min. 图 2 TBP浓度对锂的萃取率的影响 Fig. 2 Effect of TBP concentration on the extraction rate of Li+ |
2.3 相比(VO/VA)的影响
如图 3所示,Li+的萃取率随着相比的不断增加而增加.当相比(VO/VA)大于3时,这种上升的趋势逐渐变缓,这就意味着萃取效率下降.在实际应用中,可以采用相比(VO/VA)为3来保证萃取剂的萃取效率,并通过多级萃取来进一步提高萃取率.
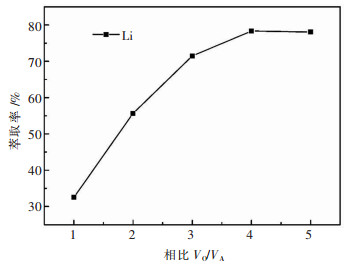 |
| 注:水相为加入250 g/L的NaCl的模拟液;有机相为萃铁后的100 % TBP;温度为30 ℃;振荡频率为220 r/min;振荡时间为10 min. 图 3 相比(VO/VA)对锂的萃取率的影响 Fig. 3 Effect of organic/aqueous volume ratio (VO/VA) on the extraction rate of Li+ |
2.4 温度的影响
图 4所示的实验结果表明,温度越高Li+的萃取率越低.由参考文献[21, 22]可知, 该萃取过程是放热反应,低温条件下有利于Li+的萃取.为了保证萃取率的同时更加节能环保,室温为合理的萃取条件.
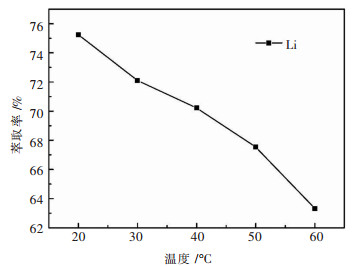 |
| 注:水相为加入250 g/L的NaCl的模拟液;有机相为萃铁后的100 % TBP;相比(VO/VA)为3;振荡频率为220 r/min;振荡时间为10 min 图 4 温度对锂萃取率的影响 Fig. 4 Effect of temperature on the extraction rate of Li+ |
2.5 萃取体系对于锂的选择性
在较优实验条件下,Li+的萃取率为75.24 %,而Ni2+、Co2+、Mn2+的萃取率分别为0.10 %、2.00 %、3.84 %.
由式(7)可计算出Li+、Ni2+、Co2+、Mn2+的分配比分别为:λLi=3.038、λNi=0.001、λCo=0.020、λMn=0.040.
由式(8)~式(10)可得,Li+/Ni2+、Li+/Co2+、Li+/Mn2+的分离系数分别为:SFLi/Ni=3038、SFLi/Co=151.9、SFLi/Mn=75.95.
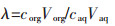
|
(7) |
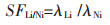
|
(8) |
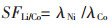
|
(9) |
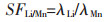
|
(10) |
其中λ代表分配比,SF代表分离系数,corg代表有机相中的浓度,Vorg代表有机相体积、caq代表水相中的浓度,Vaq代表水相体积.
综上所述,该体系对于Li+有很好的选择性.
2.6 萃取平衡等温线和理论萃取级数根据不同相比(VO/VA)条件下得出的两相平衡数据,得出相比为3时的等温平衡线,如图 5所示.由图 5可见,在相比(VO/VA)为3时采用4级逆流萃取,萃取率可达到99 %.
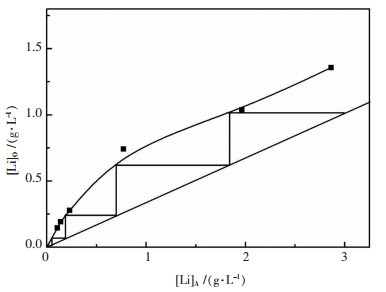 |
| 图 5 萃取平衡等温线 Fig. 5 Extraction equilibrium isotherm |
3 结论
1)由于锂离子电池正极材料浸出液和盐湖卤水实质上都为锂盐溶液,因此可将废旧锂离子电池正极材料浸出液看做一种特殊的“盐湖卤水”,并进一步调整溶液中氯离子浓度,借鉴并应用盐湖提锂中常用的萃取法.以磷酸三丁酯(TBP)为萃取剂,三氯化铁(FeCl3)为共萃剂,选择性提取锂.
2)TBP首先与FeCl3-NaCl的酸性溶液接触,形成锂的专属萃取剂.将浸出液中氯化钠的浓度进一步调整到250 g/L,在相比(VO/VA)为3,温度为室温条件下进行萃取,锂的单级萃取率可达到75 %左右而Ni2+、Co2+、Mn2+几乎没有被萃取.
3)根据平衡等温线,经过4级逆流萃取,锂的萃取率可达到99 %.
| [1] |
王光旭, 李佳, 许振明. 废旧锂离子电池中有价金属回收工艺的研究进展[J].
材料导报, 2015, 29(7): 113–123.
|
| [2] |
李金辉, 郑顺, 熊道陵, 等. 废旧锂离子电池正极材料有价资源回收方法[J].
有色金属科学与工程, 2013, 4(4): 29–35.
|
| [3] |
宗毅, 熊道陵, 王露琦, 等. 废旧锂电池废料除铝及回收铝工艺研究[J].
有色金属科学与工程, 2018, 9(5): 26–32.
|
| [4] |
SONG Y, ZHAO Z. Recovery of lithium from spent lithium-ion batteries using precipitation and electrodialysis techniques[J].
Separation and Purification Technology, 2018, 206: 335–342. DOI: 10.1016/j.seppur.2018.06.022. |
| [5] |
施平川.废旧三元锂离子电池正极材料的回收技术研究[D].北京: 北京理工大学, 2015.
http://cdmd.cnki.com.cn/Article/CDMD-10007-1015809802.htm |
| [6] |
KIM S, KIM J, KIM S, et al. Electrochemical lithium recovery and organic removal from industrial wastewater of a battery recycling plant[J].
Environmental Science Water Research & Technology, 2017, 4(2): 175–182. |
| [7] |
徐源来, 徐盛明, 池汝安, 等. 废旧锂离子电池正极材料回收工艺研究[J].
武汉工程大学学报, 2008, 30(4): 46–50.
DOI: 10.3969/j.issn.1674-2869.2008.04.014.
|
| [8] |
吴越, 裴锋, 贾路路, 等. 废旧锂离子电池中有价金属的回收技术进展[J].
稀有金属, 2013, 37(2): 320–329.
|
| [9] |
朱显峰, 赵瑞瑞, 常毅, 等. 废旧锂离子电池三元正极材料酸浸研究[J].
电池, 2017, 47(2): 105–108.
|
| [10] |
张阳, 满瑞林, 王辉, 等. 综合回收废旧锂电池中有价金属的研究[J].
稀有金属, 2009, 33(6): 931–935.
DOI: 10.3969/j.issn.0258-7076.2009.06.032.
|
| [11] |
叶帆.盐湖卤水萃取提锂及其机理研究[D].上海: 华东理工大学, 2011.
http://www.cnki.com.cn/Article/CJFDTotal-WJHX201103008.htm |
| [12] |
VIROLAINEN S, FINI M F, LAITINEN A, et al. Solvent extraction fractionation of Li-ion battery leachate containing Li, Ni, and Co[J].
Separation & Purification Technology, 2017, 179: 274–282. |
| [13] |
黄师强, 崔荣旦, 张淑珍, 等. 磷酸三丁酯从大柴旦盐湖卤水萃取锂的研究[J].
盐湖研究, 1980(增刊1): 14–24.
|
| [14] |
贾旭宏, 李丽娟, 曾忠民, 等. 磷酸三丁酯萃取体系从盐湖卤水中提取锂[J].
无机盐工业, 2011, 43(8): 29–32.
DOI: 10.3969/j.issn.1006-4990.2011.08.009.
|
| [15] |
祝茂忠. 溶剂萃取法提取盐湖卤水中锂的研究[J].
化工矿物与加工, 2016(8): 27–30.
|
| [16] |
孙锡良, 陈白珍, 徐徽, 等. 从盐湖卤水中萃取锂[J].
中南大学学报(自然科学版), 2007, 38(2): 262–266.
DOI: 10.3969/j.issn.1672-7207.2007.02.015.
|
| [17] |
JI L, HU Y, LI L, et al. Lithium extraction with a synergistic system of dioctyl phthalate and tributyl phosphate in kerosene and FeCl3[J].
Hydrometallurgy, 2016, 162: 71–78. DOI: 10.1016/j.hydromet.2016.02.018. |
| [18] |
XIANG W, LIANG S, ZHOU Z, et al. Extraction of lithium from salt lake brine containing borate anion and high concentration of magnesium[J].
Hydrometallurgy, 2016, 166: 9–15. DOI: 10.1016/j.hydromet.2016.08.005. |
| [19] |
LEE M S. Use of the bromley equation for the analysis of ionic equilibria in mixed ferric and ferrous chloride solutions at 25 ℃[J].
Metallurgical & Materials Transactions B, 2006, 37(2): 173–179. |
| [20] |
XIANG W, LIANG S, ZHOU Z, et al. Lithium recovery from salt lake brine by counter-current extraction using tributyl phosphate/FeCl3 in methyl isobutyl ketone[J].
Hydrometallurgy, 2017, 171: 27–32. DOI: 10.1016/j.hydromet.2017.04.007. |
| [21] |
柳培. 磷酸三丁酯萃取锂的研究[J].
浙江化工, 2013, 44(1): 22–25.
DOI: 10.3969/j.issn.1006-4184.2013.01.007.
|
| [22] |
SONG J, HUANG T, QIU H, et al. Recovery of lithium from salt lake brine of high Mg/Li ratio using Na[FeCl4*2TBP] as extractant:Thermodynamics, kinetics and processes[J].
Hydrometallurgy, 2017, 173: 63–70. DOI: 10.1016/j.hydromet.2017.08.003. |
 2019, Vol. 10
2019, Vol. 10


