| 硫酸盐还原菌在处理酸性矿山废水中的应用 |
2. 江西省矿冶环境污染控制重点实验室,江西 赣州 341000
2. Jiangxi Key Laboratory of Mining & Metallurgy Environmental Pollution Control, Ganzhou 341000, China
酸性矿山废水(acid mine drainage,AMD)排放量巨大,当前由其所造成环境问题越来越得到人们的重视.据统计,我国矿山每年因采矿、选矿而排放的废水量达12~15亿t,占有色金属工业废水总量的30 %左右[1].酸性矿山废水富含硫酸盐和金属离子,如果未经处理随意排放,危害巨大.土壤和水体中一旦受到污染,特别是重金属的污染,治理和修复是非常困难和复杂的.而且重金属离子易在食物链中富集,会对环境和人体健康造成严重危害,因而一旦进入生态系统后就会不断地在生态环境中积累而难以去除,造成环境的长期污染[2].国内外学者积极探索治理AMD的方法,传统方法虽然效果显著,但常常受到运行成本、环境污染等条件的限制.目前国内外比较关注的是硫酸盐还原菌(sulfate reduction bacteria,SRB)在治理AMD中的应用.利用SRB处理废水不仅成本低、无二次污染,还能回收金属,防止资源浪费,因此,研究SRB处理含硫酸盐金属离子废水的机理,对于SRB在实际治理AMD具有很大的指导作用.
1 酸性矿山废水来源、特点及其危害 1.1 酸性矿山废水的来源酸性矿山废水主要包括酸性矿井水、酸性露天采矿废水、尾矿堆淋滤水等.它的主要形成途径可以归结为3种[3]:①金属硫化矿床分为露天开采和地下开采2种,在开采过程中会发生淋溶,雨水或地下水会下渗到工作面,然后再排出坑外,形成酸性废水. ②矿物在开采过程中,大量硫化物废石被遗弃,硫及硫化物与空气接触很容易被氧化,形成大量酸性废水.以江西德兴铜矿废石中的黄铁矿氧化过程为例[4],主要反应为:
| $ {\rm{2Fe}}{{\rm{S}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O + 7}}{{\rm{O}}_{\rm{2}}} \to {\rm{2F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 4S}}{{\rm{O}}_{\rm{4}}}^{{\rm{2-}}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}} $ | (1) |
| $ {\rm{4F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 4}}{{\rm{H}}^{\rm{ + }}}{\rm{ + }}{{\rm{O}}_{\rm{2}}} \to {\rm{4F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}} $ | (2) |
| $ {\rm{F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + 3}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{Fe}}{\left( {{\rm{OH}}} \right)_{\rm{3}}}{\rm{ + 3}}{{\rm{H}}^{\rm{ + }}} $ | (3) |
| $ {\rm{Fe}}{{\rm{S}}_{\rm{2}}}{\rm{ + 14F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{ + 8}}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{15F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{ + 2S}}{{\rm{O}}_{\rm{4}}}^{{\rm{2-}}}{\rm{ + 16}}{{\rm{H}}^{\rm{ + }}} $ | (4) |
③ 矿物加工过程中有时需要在酸性条件下进行,所排放的废水是酸性废水的重要来源.
1.2 酸性矿山废水的特点酸性矿山废水的pH普遍较低,一般在2~4之间,通常以硫酸的形式存在,上述途径产生的酸性矿山废水中硫酸根离子的浓度很高,一般大于1 000 mg/L[5].而且酸性矿山废水中重金属的浓度也普遍较高,其中主要为铅、锰、铁、铜、镍等,它们主要来源于矿山排水、废石场淋浸水、选矿厂尾矿排水等.废水中重金属离子的种类、含量及其存在形态随生产种类不同而有所差异.
1.3 酸性矿山废水的危害酸性矿山废水排放量高,危害性大.由于酸性矿山废水的pH较低,大量排放就会污染地表水源,导致河流、湖泊中的鱼虾绝迹、水生植物藻类等大量死亡,严重影响周围生态环境.废水的pH较低,还会导致排水管道腐蚀酸,危及下游桥梁安全.此外,酸性矿山废水还可能会发生脱硫酸作用,生成的硫化氢毒性强,这会给人们生产生活带来严重破坏.酸性矿山水中还含有大量重金属,在生物细胞中,微量重金属元素是各种酶的活性基组分,也是生物生长的重要条件之一,然而当重金属的浓度超过一定阈值后,就会对生物酶活性及其代谢活动产生一定影响,甚至导致生物大量死亡.而且重金属不能被降解,只能改变其状态[6].
微生物法处理AMD潜力巨大,它利用自然界中广泛存在的微生物吸纳结合废水中金属离子形成沉淀,从而达到净化水体的目的.这种方法运行成本低,无二次污染,可回收其中有用物质,因此是目前国内外学者研究的热点.硫酸盐还原菌(sulfate reduction bacteria,SRB)是处理酸性矿山废水极具前景的微生物之一,AMD中的硫酸盐可以被还原为S2-,后者易与溶液中的金属离子生成难溶的金属硫化物沉淀,从而可以回收有用金属,使得AMD资源化[7].
2 SRB处理酸性矿山废水的机理 2.1 SRB的介绍硫酸盐还原菌在自然界中分布广泛,是具有较强生命力的一种厌氧异养细菌,其形态各异,革兰氏染色成阴性.它广泛分布在自然环境中,目前已知硫酸盐还原菌种类达到40多种[8-9].硫酸盐可以促进SRB生长,它以有机物作为生化代谢的能量来源和电子供体,通过异化SO42-为电子受体将其还原,SRB不易受外界环境影响,而且营养多样,所以它的生存能力很强,利用这些特性, 它能把硫酸盐、亚硫酸盐、硫代硫酸盐、单硫还原为硫化物,它在处理富含硫酸盐和金属离子的废水具有较强的能力,利用SRB可以同时去除废水中硫酸根和金属离子,从而达到以废治废的目的.
2.2 SRB对硫酸盐的代谢还原机理国内外学者对硫酸盐还原菌的代谢机理已经有了相当深入的研究.在厌氧环境,SRB以硫酸盐作为电子受体,分解废水中的有机污染物,从而获得自身所需要的能量. SRB还原硫酸盐的过程主要包括分解阶段、电子转移传递阶段和氧化3个阶段[10-11].首先在分解阶段,有机物在厌氧环境下被降解成CO2、H2O和乙酸,并通过基质水平磷酸化产生少量的Adenosine triphosphate(ATP),同时释放高能电子.电子转移阶段主要是分解阶段产生的高能电子沿着SRB特有的电子传递链进行逐级的传递,与此同时产生大量ATP.在氧化阶段中,电子被传递给氧化态的硫元素,并将其还原为S2-,此时需要消耗大量ATP,并产生H2S.这一代谢过程中,可以去除废水中的硫酸根和含碳有机物,产生的H2S也能够抑制甲烷的生成,并且能够使污水中的重金属离子不断从体系中沉淀下来.代谢过程如图 1所示.
 |
| 图 1 SRB分解代谢示意 Fig. 1 schematic diagram of SRB metabolism |
硫酸盐作为电子受体被还原成硫化物的过程中,硫酸根会在细胞内和细胞外发生一系列变化,如图 2所示[12].
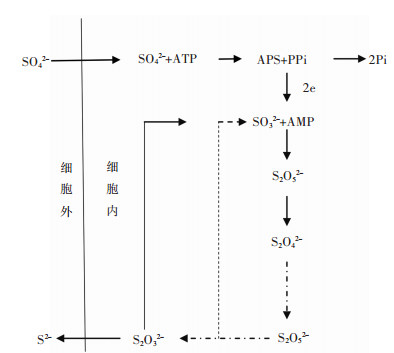 |
| 图 2 SRB的分解过程 Fig. 2 Decomposition process of SRB |
2.3 SRB对金属离子的去除机理
SRB把硫酸根还原成硫化氢,硫化氢能够与废水中的金属离子反应,形成难溶性的金属硫化物,从而达到除去金属离子的目的.苏冰琴等[13]在研究SRB处理含硫酸根和Mn、Ni、Zn、Cu等重金属离子的废水时发现,当进水中,Mn2+、Ni2+、Zn2+、Cu2+的质量浓度分别为8 mg/L、10 mg/L、4 mg/L、4 mg/L时,硫化氢能够有效地去除重金属离子,最大去除率基本可以达到为90 %以上.
SRB在还原硫酸根的过程中会产生一定的碱度,使废水的pH有所升高.研究发现,虽然硫离子可以和许多重金属离子结合形成溶度积很小的金属硫化物,但是,三价的金属离子如Al3+、Fe3+不是以金属硫化物的形式而被去除,而是生成氢氧化物被去除.
SRB在降解有机物时会产生CO2,CO2溶于水会生成CO32-,有些金属离子以碳酸盐的形式沉淀下来.例如,废水中的Mn2+是以MnCO3形式去除.
SRB表面的胞外聚合物(extracelluler polymer substances, ESP)能够吸附废水中的重金属离子. ESP是微生物在代谢过程中分泌的一种黏性物质,大部分由多糖和蛋白质组成,在它的表面存在着许多具有特殊性能的阴离子基团,如氨基、羧基、羟基等,它们能够和金属离子发生强烈的吸附和螯合作用,从而从废水中去除重金属离子[14].
3 SRB在处理酸性矿山废水中的研究现状 3.1 SRB处理含Cu2+酸性矿山废水酸性矿山含铜废水中的铜离子不易被微生物分解,过量摄入会对人体产生危害,而且铜离子含量过高时,会导致农作物死亡,所以酸性矿山含铜废水要在排放前进行处理. JalaliK等[15]研究了硫酸铜溶液中硫酸盐还原细菌的生长及其从这些溶液中去除铜的功效,研究表明,Cu与细菌细胞的结合可以促进沉淀速率,当溶液中的Cu2+浓度小于150 mg/L时,Cu的去除率可达99 %以上;刘新星等[16]采用碳纳米颗粒协同硫酸盐还原菌菌群构建了一个高效的体系处理含Cu2+废水,在Cu2+初始浓度为100 mg/L,处理48 h时,反应体系Cu2+的去除效率达到90.67 %,Cu2+去除效果显著.
3.2 SRB处理含Cr(Ⅵ)酸性矿山废水含铬废水具有“三致”作用,对人体和环境危害极大,有色金属行业是铬废水排放的主要源头之一,必须经过严格处理才能排放. Rajesh等[17]在小规模生物反应器中利用SRB去除水溶液中的Cr(Ⅵ),发现最大Cr(Ⅵ)和硫酸盐去除率分别为96.0 %和82.0 %. Pagnanelli等[18]利用固定床反应器中接种SRB进行Cr(Ⅵ)污染废水的生物处理,结果可以去除65 %±5 %的硫酸盐和95 %±5 %的铬,生物活性去除机制优于生物吸附.国内也有许多学者利用SRB处理含铬废水,贺气志等[19]利用驯化得到耐Cr(Ⅵ)硫酸盐还原菌厌氧混合菌群和化学沉淀法制备Cu /Fe双金属颗粒,协同处理含Cr(Ⅵ)废水,结果表明,在Cr(Ⅵ)浓度为300 mg/L、Cu /Fe双金属颗粒比值为7.5 %、pH值为5.0~8.0条件下,常温处理48 h后,出水的Cr(Ⅵ)浓度低于0.071 mg/L,处理效果非常显著.
3.3 SRB处理含Zn2+酸性矿山废水含Zn2+酸性矿山废水的危害具有持久性,传统处理法效果好,但价格昂贵,难以推广,利用SRB处理含Zn2+废水是目前应用比较广泛的一种工艺. Samia等[20]利用SRB处理含Zn2+废水,结果表明,细菌生长和硫酸盐还原最适初始锌浓度在10 mg/L和150 mg/L之间. Zn2+浓度超过150 mg/L会造成SRB死亡. Zn2+含量在150 mg/L以下时,被SRB有效去除Zn2+含量低于5 %;李二平等[21]利用聚乙烯醇-硫酸铵包埋法对硫酸盐还原菌污泥进行固定,采用上流式厌氧反应器进行含锌废水的处理,Zn2+去除率达98 %以上.
3.4 SRB处理含铀酸性矿山废水随着铀资源的开发利用,铀矿冶所排放的含铀废水也越来越多,含铀废水在自然状态下只能靠其慢慢衰变来降低放射性[22].因此,含铀废水对环境危害极大.研究发现:SRB具有除铀能力而受到国内外学者广泛关注. Barlett等[23]研究发现通过添加Fe3+有利于增强SRB还原U(Ⅵ)的能力,这将有助于改进铀生物修复策略;汪爱河等[24]在缺氧的环境下,利用零价铁和SRB协同处理含铀废水,发现在最佳还原条件下,铀的去除率达到93.49 %;谢水波等[25]探讨了SO42-、FeO等对硫酸盐还原菌颗粒污泥去除U(Ⅵ)的影响.结果表明,SO42-浓度低于1 500 mg/L对U(Ⅵ)的去除有促进作用,同时发现,投加铁粉大大提高了U(Ⅵ)的去除速率,在20 h内,U(Ⅵ)的去除率达到100 %.
3.5 SRB处理含其他金属酸性矿山废水有色金属矿山往往伴生其他金属硫化物,在开采过程中,这些矿物在微生物、空气、水等因素的作用下,形成硫酸、金属硫酸盐等,从而形成含有铜、镉、镍、铊、锰等酸性废水.利用SRB处理这些废水,效果显著. Monica等[26]利用SRB处理含有高浓度硫酸盐和重金属的酸性矿山废水,目的是寻求对金属具有高度耐受的SRB菌株,以此来提高硫酸盐还原和金属去除方面的效果;Kieu等[27]利用SRB处理酸性矿山废水,使Cu2+,Zn2+,Ni2+和Cr6+的重金属去除效率达到94 %~100 %;李娟等[28]利用稻壳固定硫酸盐还原菌处理含镍废水,结果表明,用稻壳作为载体的反应器启动时间短,对废水中的镍离子去除效果好,体系启动3 d后除镍率稳定在95 %以上;张鸿郭等[29]采用固定化SRB处理含铊废水,通过还原硫酸根离子形成硫化铊沉淀去除废水中铊污染,含铊废水中硫酸根离子浓度达到200 mg/L时,25 %和35 %菌液包埋量的最大处理量分别为214.32 μg/g和253.94 μg/g;牛晓丽等[30]利用硫酸盐还原菌处理含铁锰的废水,结果表明,SRB具有较好的铁锰去除能力,在最佳条件下对SO42-、Fe2+、Mn2+的去除率分别为88.16 %、99.37 %、59.18 %,去除效果显著.
4 目前存在的一些问题SRB作为一项极具潜力的生物处理废水技术,应用技术前景广阔,但是,由于其生化过程易受到外界因素影响,所以在工程应用领域还存在技术难点,在接下来的研究中应该着重克服的问题是:
4.1 硫酸盐的毒害作用SRB在厌氧消化过程中会产生S2-,S2-会对大多数厌氧菌产生毒害作用,特别是对产甲烷菌的毒害作用最为显著,当H2S穿过微生物的细胞膜,就会破坏细胞内的蛋白质.这会对整个厌氧消化过程产生不利影响,甚至导致整个反应器无法正常运行[31].另外,产生的H2S会使水体有恶臭的气味,严重影响周围的生态环境.彻底解决硫酸盐还原过程对微生物的影响,可以使硫酸盐重金属的去除效率大大提高.
4.2 重金属对SRB抑制作用重金属离子浓度达到一定值时,硫酸盐还原菌的代谢活动就会受到影响,浓度过高时,SRB会出现大量死亡现象.不同的SRB菌种对同一种重金属离子的耐受程度不同,而相同的菌种受不同重金属离子的影响也不相同.此外,当金属硫化物沉淀到SRB细胞表面时,会阻止SRB与外界接触.因此研究重金属对SRB的抑制作用也尤为重要.
4.2.1 重金属对SRB胞外聚合物(EPS)的影响EPS是由细胞新陈代谢分泌的高分子聚合物,据研究表明[32],EPS大部分是由蛋白质和多糖组成,蛋白质和多糖约占总质量的80 %左右.根据SRB的代谢机理可以看出,EPS在除去重金属的过程中起到很大作用,然而重金属可以与胞外聚合物相互作用,导致胞外聚合物结构变化[33-34].因此,深入研究重金属对EPS的影响能够为生物法处理含硫酸盐重金属废水提供理论依据.
4.2.2 重金属对反应体系中生物群落的影响在整个厌氧反应中,SRB是核心微生物,但是厌氧系统中除SRB外,常常还有其他微生物共存,如产甲烷菌等,对微生物菌群组成及结构的研究可以为反应器的运行调试提供理论指导,因此,对菌群结构的研究也受到了广泛关注[35].重金属离子不仅会抑制某个菌种的代谢活性,也会对环境中微生物群落的代谢功能和物种多样性造成影响[36].而目前对重金属与微生物菌群之间关系的研究并不是十分明了,而微生物菌群结构的变化是废水处理系统功能的有效生物指标,因此,研究重金属对废水处理体系中微生物菌群结构的影响,对于指导废水处理系统的运行和管理具有重要的研究和应用价值.
4.3 污泥中有用物质的回收厌氧过程中金属沉淀容易夹带污泥,不易分离,微生物极易流失,这会对SBR的富集产生影响.传统单相工艺很难将沉淀物从生物反应器移除,Kaksonen等[37-38]利用流化床和上升流厌氧污泥床直接处理含金属酸性水,结果表明,反应器可沉淀300 mg/(L·d)的Zn以及80 mg/(L·d)的Fe,进水pH值为2.5,出水pH值上升至7.5~8.5,但最终由于金属沉淀大量积累导致反应器运行终止.因此,迫切需要开发一种多级多相反应系统来回收污泥中有用物质,从而减轻反应器的运行压力.
5 结束语酸性矿山废水含有大量硫酸盐及重金属离子,危害性大,传统处理方法往往受到运行成本高、含重金属的污泥产量大等因素,而难以大规模应用. SRB法适用性强、价格低廉、无二次污染,是一种具有潜力的处理酸性矿山废水的技术,随着研究的不断深入,SRB法具有很好的发展前景.但就目前的研究来看,该方法还未十分成熟,仍有一些问题值得研究.与此同时,从源头控制酸性矿山废水的产生才是最行之有效的方法.
| [1] |
严群, 黄俊文, 唐美香, 等. 矿山废水的危害及其治理技术的研究进展[J].
金属矿山, 2010, 39(8): 183–186.
|
| [2] |
JOSHI N, NGWENYA B T, FRENCH C E. Enhanced resistance to nanopartical toxicity is conferred by overproduction of extracellular polymeric substances[J].
Journal of Hazardous Materials, 2012, 241/242(30): 364–367. |
| [3] |
OUYANG Y, LIU Y, ZHU R, et al. Pyrite oxidation inhibition by organosilane coatings for acid mine drainage control[J].
Minerals Engineering, 2015, 72: 57–64. DOI: 10.1016/j.mineng.2014.12.020. |
| [4] |
EVANGELOU V P, ZHANG Y L. A review: pyrite oxidation mechanisms and acid mine drainage prevention[J].
Critical Reviews in Environmental Science & Technology, 1995, 25(2): 141–199. |
| [5] |
MACIAS F, CARABALLO M A, NIETO J M, et al. Natural pretreatment and passive remediation of highly polluted acid mine drainage[J].
Journal of Environmental Management, 2012, 104(16): 93–100. |
| [6] |
余飞, 万俊锋, 赵雅光, 等. 硫酸盐还原菌SRB除砷的影响因素[J].
环境工程学报, 2016, 10(7): 3898–3904.
DOI: 10.12030/j.cjee.201502116. |
| [7] |
黄志, 徐建平, 马春艳, 等. 硫酸盐还原菌处理重金属离子[J].
重庆理工大学学报(自然科学版), 2013, 27(3): 43–46.
|
| [8] |
陈小攀, 冯秀娟. 微生物对重金属元素作用机理综述[J].
有色金属科学与工程, 2012, 3(3): 56–59.
|
| [9] |
BENDER J, SIMONSSON C, SMEDH M, et al. Lipid cubic phases in topical drug delivery: visualization of skin distribution using two-photon microscopy[J].
Journal of Controlled Release Official Journal of the Controlled Release Society, 2008, 129(3): 163. DOI: 10.1016/j.jconrel.2008.04.020. |
| [10] |
BAUMGARTNER L K, REID R P, DUPRAZ C, et al. Sulfate reducing bacteria in microbial mats: Changing paradigms, new discoveries[J].
Sedimentary Geology, 2006, 185(3/4): 131–145. |
| [11] |
ANANDKUMAR B, GEORGE R P, MARUTHAMUTHU S, et al. Corrosion behavior of SRB desulfobulbus propionicus isolated from an Indian petroleum refinery on mild steel[J].
Materials & Corrosion, 2015, 63(4): 355–362. |
| [12] |
UTGIKAR V P, HARMON S M, CHAUDHARY N, et al. Inhibition of sulfate-reducing bacteria by metal sulfide formation in bioremediation of acid mine drainage[J].
Environmental Toxicology, 2002, 17(1): 40. DOI: 10.1002/(ISSN)1522-7278. |
| [13] |
苏冰琴, 李亚新. 硫酸盐生物还原和含重金属离子的去除[J].
工业水处理, 2005, 25(9): 1–4.
DOI: 10.11894/1005-829x.2005.25(9).1. |
| [14] |
方迪, 王方, 单红仙, 等. 硫酸盐还原菌对酸性废水中重金属的生物沉淀作用研究[J].
生态环境学报, 2010, 19(3): 561–565.
|
| [15] |
JALALI K, BALDWIN S A. The role of sulphate reducing bacteria in copper removal from aqueous sulphate solutions[J].
Water Research, 2000, 34(3): 797–806. DOI: 10.1016/S0043-1354(99)00194-3. |
| [16] |
刘新星, 朱文慧, 吴民熙, 等. 碳纳米颗粒协同硫酸盐还原菌处理含铜废水[J].
环境科学与技术, 2015, 38(10): 94–99.
|
| [17] |
SINGH R, KUMAR A, KIRROLIA A, et al. Removal of sulphate, COD and Cr(Ⅵ) in simulated and real wastewater by sulphate reducing bacteria enrichment in small bioreactor and FTIR study[J].
Bioresource Technology, 2011, 102(2): 677–82. DOI: 10.1016/j.biortech.2010.08.041. |
| [18] |
PAGNANELLI F, VIGGI C C, CIBATI A, et al. Biotreatment of Cr(Ⅵ) contaminated waters by sulphate reducing bacteria fed with ethanol[J].
Journal of Hazardous Materials, 2012, 199/200(2): 186–192. |
| [19] |
贺气志, 陈辉, 王丹, 等. 混合硫酸盐还原菌与Cu/Fe颗粒协同处理含铬废水的研究[J].
环境科学, 2011, 32(7): 2000–2005.
|
| [20] |
AZABOU S, MECHICHI T, SAYADI S. Zinc precipitation by heavy-metal tolerant sulfate-reducing bacteria enriched on phosphogypsum as a sulfate source[J].
Minerals Engineering, 2007, 20(2): 173–178. DOI: 10.1016/j.mineng.2006.08.008. |
| [21] |
李二平, 闵小波, 舒余德, 等. 内聚营养源SRB污泥固定化处理含锌及硫酸根废水[J].
中南大学学报(自然科学版), 2011, 42(6): 1522–1527.
|
| [22] |
闫强, 王安建, 王高尚, 等. 铀矿资源概况与2030年需求预测[J].
中国矿业, 2011, 20(2): 1–5.
|
| [23] |
BARLETT M, ZHUANG K, MAHADEVAN R, et al. Integrative analysis of Geobacter spp. and sulfate-reducing bacteria during uranium bioremediation[J].
Biogeosciences, 2012, 8(6): 11337–11357. |
| [24] |
汪爱河, 张伟, 胡凯光, 等. ZVI—SRB协同处理铀废水的正交实验研究[J].
矿业工程研究, 2011, 26(3): 60–63.
|
| [25] |
谢水波, 陈胜, 马华龙, 等. 硫酸盐还原菌颗粒污泥去除U(Ⅵ)的影响因素及稳定性[J].
中国有色金属学报, 2015(6): 1713–1720.
|
| [26] |
MARTINS M, FALEIRO M L, BARROS R J, et al. Characterization and activity studies of highly heavy metal resistant sulphate-reducing bacteria to be used in acid mine drainage decontamination[J].
Journal of Hazardous Materials, 2009, 166(2-3): 706. DOI: 10.1016/j.jhazmat.2008.11.088. |
| [27] |
KIEU H T, MULLER E, HORN H. Heavy metal removal in anaerobic semi-continuous stirred tank reactors by a consortium of sulfate-reducing bacteria[J].
Water Research, 2011, 45(13): 3863. DOI: 10.1016/j.watres.2011.04.043. |
| [28] |
李娟, 李浩然, 孙春宝. 农业稻壳固定硫酸盐还原菌处理含镍废水[J].
过程工程学报, 2010, 10(1): 103–108.
|
| [29] |
张鸿郭, 熊静芳, 李猛, 等. 固定化硫酸盐还原菌处理含铊废水效果及其解毒机制[J].
环境化学, 2017, 36(3): 591–597.
DOI: 10.7524/j.issn.0254-6108.2017.03.2016070301. |
| [30] |
牛晓丽, 郑健, 李强, 等. 一株硫酸盐还原菌的分离及处理含铁锰废水的实验[J].
水资源与水工程学报, 2012, 23(2): 90–92.
|
| [31] |
ZHANG M, WANG H. Preparation of immobilized sulfate reducing bacteria (SRB) granules for effective bioremediation of acid mine drainage and bacterial community analysis[J].
Minerals Engineering, 2016, 92: 63–71. DOI: 10.1016/j.mineng.2016.02.008. |
| [32] |
LIU H, FANG H H P. Extraction of extra cellular polymeric substances (EPS) of sludge[J].
Journal of Biotechnology, 2002, 95: 250–254. |
| [33] |
方迪, 张瑞昌, 赵阳国. 硫酸盐还原菌分泌胞外多聚物吸附Cu的特性[J].
光谱学与光谱分析, 2011, 31(10): 2820–2822.
|
| [34] |
彭书传, 虞艳云, 万正强, 等. 硫酸盐还原菌胞外聚合物(EPS)去除重金属离子Cd2+过程中的交互作用研究[J].
南京大学学报(自然科学版), 2013, 49(6): 1976–1980.
|
| [35] |
何桂春, 陈健, 丁军, 等. 活性炭负载纳米零价铁去除矿山废水中的Cu2+[J].
有色金属科学与工程, 2016, 7(5): 119–124.
|
| [36] |
程健明, 汤浩, 魏刚, 等. 利用硫酸盐还原菌处理含重金属离子酸性废水研究进展[J].
广东化工, 2014, 41(9): 91–92.
|
| [37] |
KAKSONEN A H, RIEKKOLA M L. Optimization of metal sulphide precipitation in fluidized-bed treatment of acidic wastewater[J].
Water Research, 2003, 37(2): 255–266. DOI: 10.1016/S0043-1354(02)00267-1. |
| [38] |
KAKSONEN A H, FRANZMANN P D, PUHAKKA J A. Effects of hydraulic retention time and sulfide toxicity on ethanol and acetate oxidation in sulfate-reducing metal-precipitating fluidized-bed reactor[J].
Biotechnology & Bioengineering, 2004, 86(3): 332–343. |
 2018, Vol. 9
2018, Vol. 9


