| Co和P对Ni-金刚石复合电沉积机理的影响 |
2. 中南大学材料科学与工程学院,长沙 410083
2. School of Materials Science and Engineering, Central South University, Changsha 410083, China
复合电镀是用电镀的方法使金属和固体微粒共沉积来获得所需镀层的一种工艺过程.复合电镀是制造复合材料的一种新方法,在过去几十年里得到极大的发展.通过复合电镀技术可以制备特殊功能的新型材料,如减磨耐磨、抗高温和耐蚀等镀层.其中添加硬度较高的SiC,Al2O3和金刚石等颗粒可以明显提高基质金属的硬度和耐磨性[1-4].而石墨、MoS2和PTFE等硬度较低又具有良好的固体润滑特性的颗粒则主要用于减磨复合镀层[5-7].因此,采用复合电沉积法制备复合材料在高技术产业中起到重要作用.由金刚石微粉与Ni共同沉积所形成的复合镀层具有较高的耐磨性[8],可以制备多种钻磨工具,如线锯、砂轮、金刚石钻头、油石及金刚石滚轮等.
在复合电镀过程中,镀层的制备过程即为金属阳离子在阴极表面发生还原反应的过程,该过程主要包括有:镀液中金属阳离子、氢离子等物质在电场或者外力作用下运动至阴极表面的过程;镀液中金属阳离子在阴极表面与表面双电层中电子反应,还原为金属原子的电化学反应过程;已还原的金属原子在阴极表面上排列生长成某类特定的金属晶体的新相生成过程[9].而Ni-金刚石复合镀层电结晶过程主要包括2个步骤,一个是电镀液中Ni2+在阴极表面得电子还原成Ni单质的过程,另一个是金刚石在阴极表面与在金刚石表面吸附的阳离子发生还原一起被包覆于金属镀层内的过程[10].电结晶是电沉积的主要步骤,对电沉积后期的沉积行为以及沉积产物性质具有重要的影响[11].因此人们对复合电沉积过程的深入研究,大致形成3类复合电沉积模型:第1类是吸附模型,即Guglielmi模型[12],也称2步吸附理论.该理论表面固体微粒在阴极表面的沉积主要是由于其存在弱吸附和强吸附过程.第2类是力学理论模型,该理论主要是认为固体微粒在阴极表面的吸附同时受到多种作用力的影响,其作用力分为斥力和引力,这两者的大小决定固体微粒是否发生沉积.第3类为电化学机理,该机理认为阴极-镀液界面间场强大小和固体颗粒表面的电荷吸附量是复合电沉积过程中的关键因素.由此可知在Ni-金刚石复合沉积机理的研究上已经获得许多的成果,但是随着共沉积元素的增加,复合电沉积变得更加复杂,其沉积机理仍有待完善.
因此,为了考察Co、P添加对Ni-金刚石复合镀层电沉积机理的影响,采用线性电位扫描法、循环伏安法和电化学阻抗谱等电化学手段研究电解液中添加Co、P对Ni-金刚石电结晶初期行为的影响,为以后的研究工作提供一定参考.
1 实验实验所使用的镀液为基础瓦特镀液,由于镀液对杂质的影响比较敏感,且在空气中搅拌,因此,所用化学试剂均为分析纯,用二次蒸馏水配制.复合镀液的成分如表 1所列.其中,金刚石粉体(粒径40 μm)置于浓度为10 %的NaOH溶液中,煮沸10 min以达到除油的目的,并用蒸馏水漂洗至中性;其次放在10 %的HNO3溶液中煮沸10 min,以达到活化金刚石粉体表面的目的.
| 表 1 镀液成分 Table 1 Composition of plating electrolyte |
 |
| 点击放大 |
电化学测试都采用型号为CHI660C的电化学工作站完成.实验采用三电极体系,工作电极为直径10 mm的不锈钢,型号为232的饱和甘汞电极作为参比电极,辅助电极为2 cm×2 cm的光亮铂片.工作电极除工作面以外,其余部分用环氧树脂固封.实验之前,用400号、600号和800号砂纸依次对工作电极工作面打磨至光亮.测试前试样在开路电位下静置30 min,并且每次测试至少重复3次,以确保实验结果准确和可重现.
为研究Co、P添加对Ni电结晶初期行为的影响,将Ni-金刚石复合镀液、Ni-Co-金刚石复合镀液和Ni-Co-P金刚石复合镀液(其中镀液中Co以CoSO4·7H2O添加,Co含量为1 %,P以Ni3(PO4)2·8H2O添加,P含量为0.5 %)分别进行循环伏安测试(扫描速度为-0.06 V/s,扫描电位范围为-0.7~0.8 V)和动电位极化曲线测试(扫描速度为0.01 V/s,扫描电位范围为0.1~0.6 V).为进一步掌握Ni电结晶过程,进行电化学阻抗谱的测试.实验中的扰动信号是幅值为5 mV的交流正弦波.各实验组的测试电位均为-0.3~-1.1 V,共9个电位.该阻抗谱测试中的扫描起始频率为105 Hz,终止频率10-3 Hz.
2 结果与分析 2.1 循环伏安分析图 1所示为Ni-金刚石镀液、Ni-Co-金刚石复合镀液和Ni-Co-P-金刚石复合镀液的循环伏安曲线,实验从0.6 V开始以0.06 V/s的速度扫描至-1.1 V,再从-1.1 V以同样速度向0.6 V扫描.通过工作站测试软件对曲线分析,不同镀液成分共沉积电位列于表 2.从图 1可以看出,Ni-金刚石复合镀层曲线表现为交叉曲线,这说明在循环伏安扫描过程中,Ni-金刚石在阴极表面发生沉积存在典型形核过程.同时,随着扫描电位的负移,曲线出现电位的突变,说明在该电位附近,阴极表面Ni2+开始形核生长.该部分曲线峰起始电位即为Ni-金刚石的共沉积电位[13]. Ni-金刚石复合电镀沉积电位为-0.72 V,该电位负于纯镍的沉积电位值.这主要是由于金刚石的添加,表面吸附金属阳离子使得阴极表面金刚石粉体会吸附双电层中电子然后与之发生反应[14],因此使得阴极表面参与Ni2+沉积的电子数目减少,并且金刚石粉体在阴极表面的吸附会阻碍Ni2+沉积初期在阴极表面的沉积,因此在曲线上表现为电流值变化不明显,使得沉积峰开始电位负移.当扫描电位进一步负移,参与Ni2+反应的电子数量增加,使得曲线上电流值发生明显变化,表现为Ni2+的沉积峰起始;当镀液中加入Co2+,从图 1(b)可以看出,Ni-Co-金刚石发生复合电沉积的电位为-0.69 V,即Ni-Co共沉积过程开始需要的过电位逐渐减小,这主要是由于Co比Ni的标准电极电位正,因此Co2+更容易发生沉积反应,由此表现为Ni-Co共沉积更易发生,并且从曲线中可以看出2个明显的峰值,这是由于在电极反应过程中出现两步反应[15];图 1(c)所示Ni-Co-P-金刚石复合镀液的循环伏安曲线,表明随着镀液中Co、P的加入,Ni-Co-P-金刚石相对于Ni-金刚石和Ni-Co-金刚石的复合电沉积电位正移,其值为-0.62 V.说明P的加入可以降低阴极表面电结晶所需的驱动力[16].
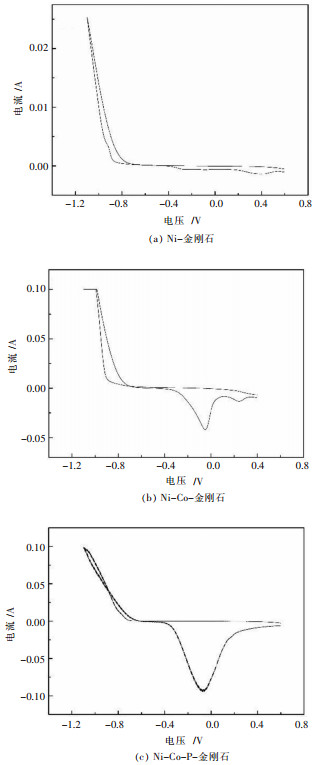 |
| 图 1 不同镀液成分电沉积循环伏安曲线 Fig. 1 Cyclic voltammetry curves of electroplatings at different electrolyte concentrations |
| 表 2 不同镀液成分共沉积电位 Table 2 Electrodepositon voltage of electroplatings at different electrolyte concentrations |
 |
| 点击放大 |
2.2 动电位极化曲线分析
图 2所示为Ni-金刚石、Ni-Co-金刚石和Ni-Co-P-金刚石3种不同复合镀液的塔菲尔极化曲线,从图 2中可以看出,3种镀液的曲线呈γ状,从阴极部分曲线可以看出,电极反应过程都表现出明显的电化学活化控制,这主要是由于在该镀覆工艺条件下,随着搅拌的进行,金属阳离子在阴极表面的扩散速率较快,没有产生浓差极化现象[17].随着Co和P的加入,极化曲线的析出电位正移,阴极极化减弱,过电位减小,这与循环伏安曲线的结果吻合.表明镀液中加入Co或者Co、P,使得阴极表面的沉积速度加快[18].
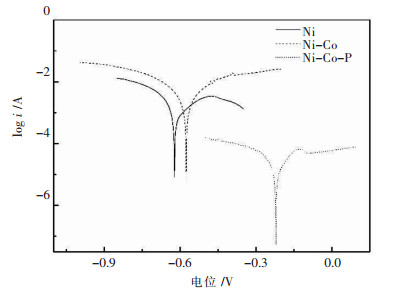 |
| 图 2 不同镀液成分复合电沉积塔菲尔极化曲线 Fig. 2 Tafel polarization curves of electrodeposition at different electrolyte composition |
2.3 电化学阻抗谱分析 2.3.1 Ni-金刚石电结晶
为研究Ni-金刚石电结晶发生前后,镀液中Ni-金刚石共沉积变化,分别测试-0.3~-1.1V电位下,Ni-金刚石复合镀液的阴极表面电化学阻抗谱,如图 3所示.其中图 3(a)为-0.3 V、-0.4 V、-0.5 V、-0.6 V电位下的Nyquist谱(电化学阻抗谱),从图 3中可以看出,在这些电位下,Ni-金刚石复合电结晶过程表现为单容抗弧,并且随着电位的负移,容抗弧的半径减小,即电极反应的转移电阻减小.与所有的电极过程一样,阴极过电位是电沉积过程进行的动力,当阴极过电位未达到金属阳离子的沉积电位时,阴极表面过程表现为离子的吸附与脱吸附过程[14].当电极电位越负,阴极表面双电层电位差越大,金属阳离子和电子的传质越容易,因此表现为转移电阻越小.
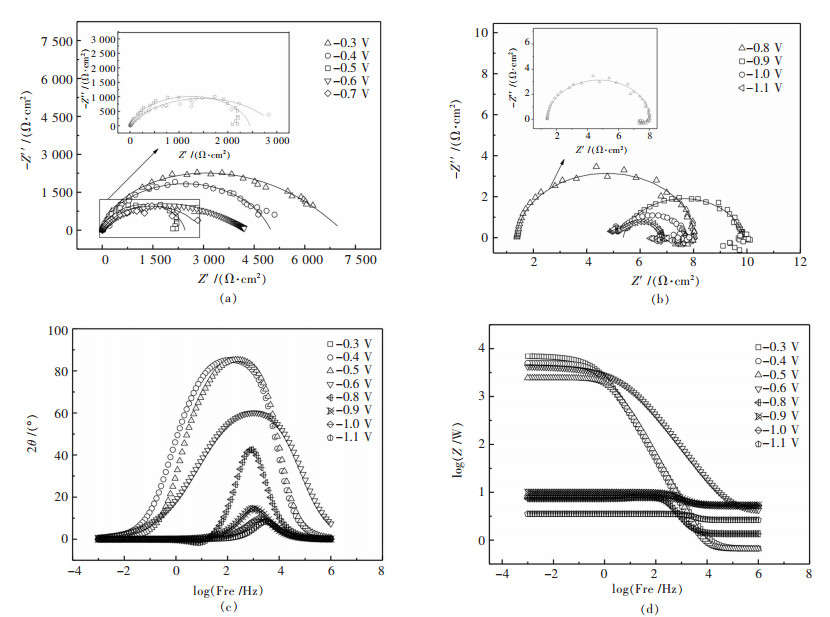 |
| 图 3 不同电位下Ni-金刚石复合镀液的电化学阻抗谱 Fig. 3 Nyquist diagrams of Ni-diamond electro-deposition |
图 3(b)所示为-0.8 V、-0.9 V、-1.0 V和-1.1V电位下Ni-金刚石阴极表面电结晶过程中的电化学阻抗Nyquist谱.在这些电位下的电化学阻抗谱均表现为高频区的容抗弧和低频区的感抗弧组合.随着电位的负移,电化学阻抗谱高频区的容抗弧直径依次减小,表明Ni-金刚石电沉积过程中,电荷转移过程阻力减小.在阴极电沉积过程中,不仅金属的析出需要一定的阴极过电位,即只有阴极极化达到金属析出电位时,才能发生金属阳离子得电子的还原反应;而在电结晶过程中,在一定的阴极极化下,只有达到一定的临界尺寸晶核,才能稳定存在.凡是达不到临界尺寸的晶核就会重新溶解.而阴极过电位越大,晶核生成功愈小,形成晶核的临界尺寸才能减小,这样生成的晶核既小又多,结晶才能细致.低频区的感抗弧与阴极表面氢气的析出有关[19],阴极表面存在多种可以在阴极表面还原的离子,这些离子尤其是氢离子将与金属阳离子竞争还原.当阴极过电位较小时,金属阳离子还原驱动力较小,氢离子还原占优势,因此表现出较大的感抗弧.当阴极过电位增大,金属阳离子还原驱动力较大,氢离子还原较少,因此表现出较小的感抗弧[20].
图 3(c)和图 3(d)为电化学阻抗谱的Bode图,从图 3中可以看出曲线存在1个峰值,表明反应只有1个时间常数,主要是由于在快速沉积工艺中,Ni2+的还原反应较快.
根据交流阻抗谱测试结果,采用ZView软件对阻抗谱图进行拟合.图 4表示各组电化学阻抗的等效电路.其中,图 4(a)所示为测试电位为-0.3 V、-0.8 V、-0.9 V、-1.0 V和-1.1 V时,Ni-金刚石复合镀液的电化学阻抗谱拟合电路;图 4(b)所示为测试电位为-0.4 V、-0.5 V、-0.6 V和-0.7 V时,Ni-金刚石复合镀液的电化学阻抗谱拟合电路;其中,Rs表示溶液电阻,Rt表示为与氢气析出及吸附相关的双电层电容和电荷转移电阻,L为电感,RL为Ni在电结晶过程中的电荷转移电阻,CPEdl表示金属表面与溶液间双电层电容,RNi为Ni镀层电阻,CPENi表示阴极表面金属双电层电容模拟过程,CPE为恒相位角原件,用其代替理想电容C和Warburg阻抗.
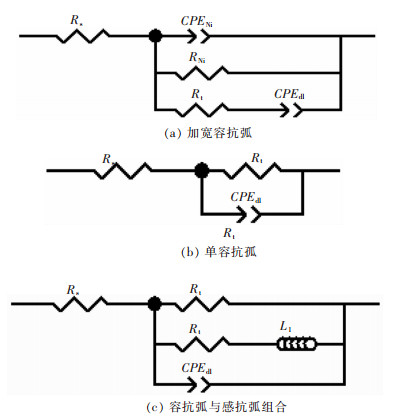 |
| 图 4 Ni-金刚石镀液的各实验组等效电路 Fig. 4 Equivalent circuit of Ni-diamond electro-deposition |
2.3.2 Ni-Co-金刚石电结晶
图 5所示为Ni-Co-金刚石电结晶过程中在-0.3~-1.1 V电位下,Ni-金刚石复合镀液的阴极表面电化学阻抗谱.金属电结晶过程是在电场作用下完成的,因此电结晶过程受到阴极表面状态、电极附近溶液的化学和电化学过程,特别是阴极极化作用(过电位)等因素的影响[21].金属电结晶可能经历晶核生成和晶粒长大2个过程,但是它是一个电化学过程,形核和晶粒长大所需要的能量来自于界面电场,阴极过电位是电结晶反应的主要推动力,而不是溶液的过饱和度[22].当Ni-金刚石复合电镀液中添加进入Co2+,由于Co相比于Ni更容易析出,相当于减小了金属电结晶过程所需的推动力,从图 5(a)可以看出,随着电位的负移,即电位从-0.3 V时电化学阻抗谱为单容抗弧,到-0.4 V至-0.6 V转变为加宽的容抗弧,然后在-0.8 V至-1.1 V转变为单容抗弧.这主要是由于随着电位的负移,阴极过电位增加,当阴极极化达到一定值,即达到Ni-Co共沉积电位阴极表面开始发生金属阳离子的还原反应,Ni晶核的形成,并且阴极过电位越高,则晶核形成越容易,晶核的数量也越多,阴极表面电荷的转移也越快.
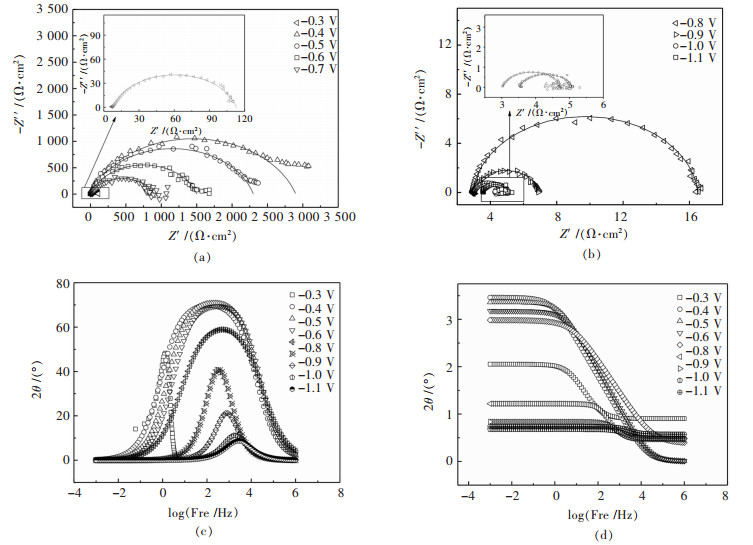 |
| 图 5 不同电位下Ni-Co-金刚石复合镀液的电化学阻抗谱 Fig. 5 Nyquist diagrams of Ni-Co-diamond electro-deposition |
图 5(c)和图 5(d)为电化学阻抗谱的Bode图,从图 5中可以看出当电位为-1.1V时曲线存在2个峰值,表明反应有2个时间常数,主要是由于在快速沉积工艺中,Ni2+的还原反应较快,并且Co的标准电极电位比Ni的标准电极电位较正,因此Co2+会优先在阴极表面沉积,因此阴极表面反应分为两步进行[23].
图 6所示为各组电化学阻抗谱拟合的等效电路.图 6(a)为单容抗弧的等效电路,图 6(b)为1个加宽的容抗弧等效电路.其中,Rs表示溶液电阻,CPEdl、CPEdl1、CPEdl2分别表示不同状态下的双电层电容,RNi为Ni-Co共结晶过程的电荷转移电阻.
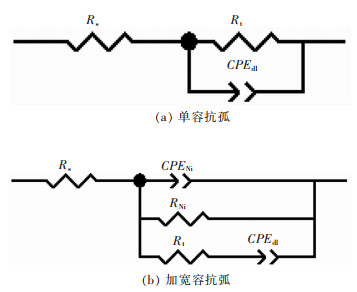 |
| 图 6 Ni-Co-金刚石镀液的各实验组等效电路 Fig. 6 Equivalent circuit of Ni-Co-diamond electro-deposition |
2.3.3 Ni-Co-P-金刚石电结晶
图 7所示为不同电位下Ni-Co-P-金刚石复合镀液的电化学阻抗谱,从图 7(a)和图 7(b)可以看出,随着电位的负移,阻抗谱从-0.3~-0.6 V的单容抗转变为在-0.7~-0.9 V电位下的双容抗弧,然后在-1.0 V和-1.1 V转变为单容抗弧.这主要是由于随着电位的负移,阴极过电位增加,当阴极极化达到一定值,即达到Ni-Co共沉积电位阴极表面开始发生金属阳离子的还原反应,此时Ni晶核形成,并且阴极过电位越高,则晶核形成越容易,晶核的数量也越多,阴极表面电荷的转移也越快.在较高电压时,阻抗谱表现为单容抗弧,这说明Ni-Co-P的共沉积过程主要受电化学反应控制.随着电位负移,容抗弧逐步缩小,说明电化学进行的阻力逐渐减小[24].在电位为-0.7 V以下时,阻抗谱表现为双容抗弧,说明该电沉积过程有2个时间常数.高频区容抗弧是由电极-溶液界面间双电层电容和Ni-Co共沉积的电荷转移电阻引起的.此时,Ni和Co的阻抗谱重合,即Ni、Co和P的共沉积过程几乎同时发生,仅表现为1个时间常数.
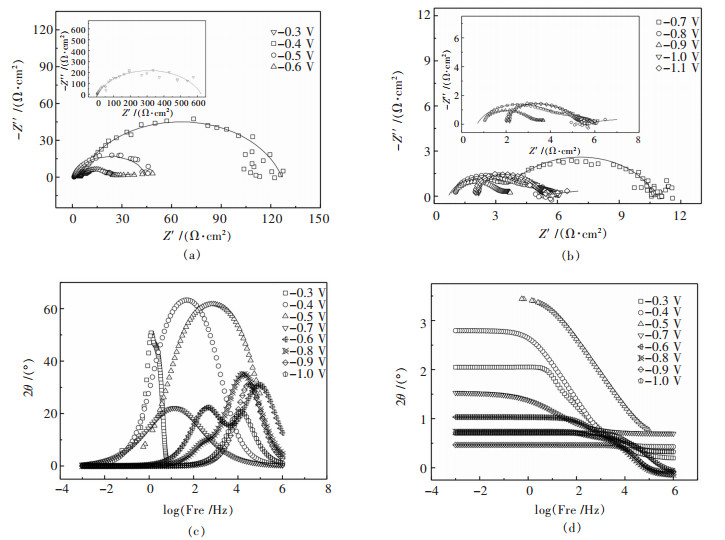 |
| 图 7 不同电位下Ni-Co-P-金刚石复合镀液的电化学阻抗谱 Fig. 7 Nyquist diagrams of Ni-Co-P-diamond electro-deposition |
图 7(c)和图 7(d)所示为Ni-Co-P-金刚石复合镀液的电化学阻抗谱的Bode图,从图 7中可以看出,在电位为-0.7 V时,曲线呈现明显的2个峰值,而Ni-Co-金刚石复合镀层在电位-1.1 V时才出现,这说明P的加入减小了溶液电结晶所需的推动力,阴极表面反应所需过电位减小,使反应电位正移.
图 8(a)所示为单容抗弧的等效电路,图 8(b)所示为双容抗弧组合的等效电路.其中,Rs表示溶液电阻,CPEdl、CPEdl1、CPEdl2分别表示不同状态下双电层电容,RNi为Ni在电结晶过程中的电荷转移电阻,CPEh和Rh分别表示与氢气析出及吸附相关的双电层电容和电荷转移电阻.
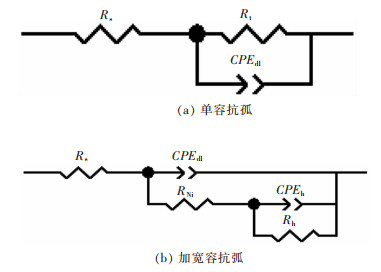 |
| 图 8 Ni-Co-P-金刚石镀液的各实验组等效电路 Fig. 8 Equivalent circuit of Ni-Co-P-diamond electro-deposition |
3 结论
采用循环伏安法、动电位极化曲线和交流阻抗谱等电化学手段对添加Co和P元素的Ni-金刚石复合镀液的电沉积机理进行了初步研究,得出以下主要结论:
1)相较于Ni-金刚石,Ni-Co-金刚石和Ni-Co-P-金刚石复合镀液的沉积电位均发生正移,分别为-0.69 V和-0.62 V,说明Co或Co、P的共同加入可降低阴极表面Ni电结晶所需的驱动力,使共沉积更容易发生.
2)复合电沉积时,由于Ni2+还原较快,电沉积反应只出现一个时间常数;随着Co和P的加入,Co2+会比Ni2+先沉积,部分电沉积反应开始出现两个时间常数,阴极反应分2步进行.
3)在相同电位下,Ni-Co-P-金刚石复合镀层的交流阻抗谱具有最小的容抗弧直径,这表明Ni-Co-P-金刚石复合镀层具有较小的电荷转移电阻.
| [1] |
SHRESTHA N K, MASUKO M, SAJI T. Composite plating of Ni/SiC using azo-cationic surfactants and wear resistance of coatings[J].
Wear, 2003, 254(5/6): 555–564. |
| [2] |
CHEN L, WANG L, ZENG Z, et al. Effect of surfactant on the electrodeposition and wear resistance of Ni-Al2O3 composite coatings[J].
Mater Sci Eng, A, 2006, 434(1/2): 319–325. |
| [3] |
刘美霞, 黄柱, 李天白, 等. Al2O3含量对Ni-W-Al2O3复合镀层性能的影响[J].
有色金属科学与工程, 2016, 7(4): 55–60.
|
| [4] |
黄柱, 刘美霞, 李天白, 等. 电沉积Ni-W-WC复合镀层摩擦磨损性能[J].
有色金属科学与工程, 2016, 7(3): 66–70.
|
| [5] |
ZHAO H, LIU L, HU W, et al. Friction and wear behavior of Ni-graphite composites prepared by electroforming[J].
Mater Des, 2007, 28(4): 1374–1378. DOI: 10.1016/j.matdes.2006.01.001. |
| [6] |
ZHAO Q, LIU Y. Electroless Ni-Cu-P-PTFE composite coatings and their anticorrosion properties[J].
Surf Coat Technol, 2005, 200(7): 2510–2514. DOI: 10.1016/j.surfcoat.2004.06.011. |
| [7] |
ZOU T Z, TU J P, ZHANG S C, et al. Friction and wear properties of electroless Ni-P-(IF-MoS2) composite coatings in humid air and vacuum[J].
Mater Sci Eng, A, 2006, 426(1/2): 162–168. |
| [8] |
王美娟, 王日初, 彭超群, 等. Ni-金刚石复合镀层的制备[J].
中南大学学报(自然科学版), 2013, 44(7): 2688–2695.
|
| [9] |
PETERSSON I, AHLBERG E. Kinetics of the electrodeposition of Pb-Sn alloys: Part Ⅰ. At glassy carbon electrodes[J].
Journal of Electroanalytical Chemistry, 2000, 485(2): 166–177. DOI: 10.1016/S0022-0728(00)00113-3. |
| [10] |
王立平, 高燕, 薛群基, 等. Ni-Co/纳米金刚石复合镀层抗磨损性能的研究[J].
中国表面工程, 2005, 70(1): 24–26.
|
| [11] |
LEE E C, CHOI J W. A study on the mechanism of formation of electrocodeposited Ni-diamond coatings[J].
Surf Coat Technol, 2001, 148(2/3): 234–240. |
| [12] |
GUGLIELMI N. Kinetics of the deposition of inert particles from electrolytic baths[J].
Journal of the Electrochemical Society, 1972, 119(8): 1009–1012. DOI: 10.1149/1.2404383. |
| [13] |
姚颖悟, 王超. 钛基锡锑中间层上二氧化铅电沉积过程的研究[J].
电镀与精饰, 2012, 34(2): 6–8.
|
| [14] |
PELLICER E, PAN S, SIVARAMAN K, et al. Effects of the anion in glycine-containing electrolytes on the mechanical properties of electrode posited Co-Ni films[J].
Materials Chemistry and Physics, 2011, 130(3): 1380–1386. DOI: 10.1016/j.matchemphys.2011.09.032. |
| [15] |
王新志, 王吉坤, 麦振海. 锌电积过程中添加剂对阴极的影响[J].
冶金丛刊, 2007(6): 38–40.
|
| [16] |
姚素薇, 刘冰, 郭鹤桐. Ni-Co-P非晶态合金的电沉积及其性能研究[J].
化工学报, 1996, 47(1): 48–52.
|
| [17] |
HERRAIZ-CARDONA I, ORTEGA E, P, REZ-HERRANZ V. Impedance study of hydrogen evolution on Ni/Zn and Ni-Co/Zn stainless steel based electrodeposits[J].
Electrochimica Acta, 2011, 56(3): 1308–1315. DOI: 10.1016/j.electacta.2010.10.093. |
| [18] |
BAKHIT B, AKBARI A, NASIRPOURI F, et al. Corrosion resistance of Ni-Co alloy and Ni-Co/SiC nanocomposite coatings electrodeposited by sediment codeposition technique[J].
Applied Surface Science, 2014, 307: 351–359. DOI: 10.1016/j.apsusc.2014.04.037. |
| [19] |
VAZQUEZ A, JORGE, PRITZKER M. Steady-state model for anomalous Co-Ni electrodeposition in sulfate solutions[J].
Electrochimica Acta, 2012: 66139–150. |
| [20] |
TIAN L, XU J, QIANG C. The electrodeposition behaviors and magnetic properties of Ni-Co films[J].
Applied Surface Science, 2011, 257(10): 4689–4694. DOI: 10.1016/j.apsusc.2010.12.123. |
| [21] |
HASSANI S, RAEISSI K, GOLOZAR M. Effects of saccharin on the electrodeposition of Ni-Co nanocrystalline coatings[J].
Journal of Applied Electrochemistry, 2008, 38(5): 689–694. DOI: 10.1007/s10800-008-9488-4. |
| [22] |
牛朝霞. 纳米结构Ni-SiC复合薄膜的电化学制备及其相关理论研究, 杭州: 浙江大学, 2006.
|
| [23] |
张晖, 李成涛, 宋利君, 等. 镍基690合金在超纯水中常温下的电化学行为及高温高压下的腐蚀行为[J].
材料保护, 2013, 46(10): 37–39.
|
| [24] |
李凌杰, 于生海, 雷惊雷, 等. AZ31和AZ61镁合金在模拟海水中的腐蚀电化学行为[J].
电化学, 2008, 14(1): 95–99.
|
 2017, Vol. 8
2017, Vol. 8


