| 氧气对嗜酸氧化亚铁硫杆菌磁性颗粒形成的影响 |
嗜酸氧化亚铁硫杆菌Acidithiobacillus ferrooxidans属于γ变形杆菌属,它是最重要的浸矿菌之一[1].鉴于国内难选铁矿的利用现状[2],A. ferrooxidans在开发难选用铁矿方面有巨大的应用潜能. A. ferrooxidans生活在二价铁浓度相对稳定、三价铁可溶的酸性好氧环境中,其中铁离子的浓度是一般细菌所需铁离子浓度的7个数量级倍[3]. 大多数微生物都有一套严谨的机制控制细胞内铁离子浓度在一定的范围,使自身免遭过量铁的毒害[3-4]. 但目前研究者对于A. ferrooxidans如何处理环境中高负载铁以及维持胞内铁离子浓度平衡的机制了解还较少.
近年来,刘新星[5]在嗜酸氧化亚铁硫杆菌中发现了磁性颗粒,这可能是A. ferrooxidans应对环境中高铁负载的机制之一. 磁小体由与细胞膜相似的磷脂双层膜包裹[6],其主要成分为四氧化三铁或四硫化三铁[7],因其具有较规律的晶体尺寸[8]和形态[9],以及良好的生物相容性等特点而在众多领域[10-15]有可观的应用潜能.但研究表明,趋磁细菌只有在环境中氧浓度很低或无氧时才会形成磁小体[16].
Raquel Quatrini[17]等通过生物信息学技术发现A. ferrooxidans中含有一系列二价铁和三价铁转运系统,一些二价铁转运基因与趋磁细菌中磁小体岛基因具有同源性. 课题组前期通过生物信息学方法已发现趋磁细菌AMB-1中二价铁转运蛋白MpsA与A. ferrooxidans ATCC23270中AFE_RS06830基因编码的蛋白有48 %的同源性[18]. MSR-1中二价铁转运蛋白FeoB[19]与A. ferrooxidans ATCC23270中AFE_ RS11545基因编码的蛋白具有45 %的同源性.
嗜酸氧化亚铁硫杆菌为好氧菌,其胞内磁性颗粒形成机制不同于趋磁细菌.为了探究氧气是否对A.ferrooxidans中Fe3O4颗粒的形成有影响,文中研究了feoB、mpsA、tonB和ABC等铁离子转运基因在不同转速下的差异表达以及不同转速下胞内磁性颗粒的形成情况,以初步揭示A. ferrooxidans中磁性颗粒形成机理.
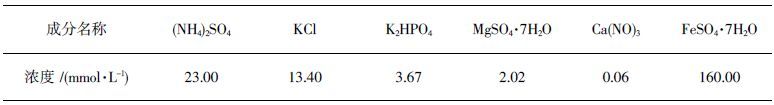
1 实验材料 1.1 菌种A. ferrooxidans 采用从广东韶关酸性浸矿废水中分离得到的GD-0菌株,现保存于教育部中南大学生物冶金重点实验室. GD-0采用9K培养基培养,以硫酸亚铁为能源物质. 9K培养基成分见表 1.
| 表1 9 K培养基成分 Table 1 Composition of 9 K medium |
 |
| 点击放大 |
1.2 试剂与仪器
RNA提取试剂:庄萌生物细菌总RNA提取试剂盒;氯仿:异戊醇(24∶1),pH 8.0;RNase喷雾清除剂, 3 % H2O2. RNA纯化试剂:Thermo Scientific DNase I, RNase-free. RNA反转录试剂:Thermo Scientific RevertAidTM第一链cDNA Synthesis试剂盒. RT-PCR试剂:THUNDERBIRD SYBR qPCR Mix(Code No.QPS-201, QPS-201T),2xTaq PCR MasterMix(KT201) 仪器:NanoDrop微量分光光度计(NanoDrop Technologies, Inc., ND-1000),MyIQTM单色实时定量PCR检测系统(Bio-Rad Laboratories, Inc.),电泳仪(北京市六一仪器厂,DYY-12型), Beckman Avanti J-E(JSE14COB),BioSense凝胶成像系统(上海山富科学仪器有限公司,SC810)
2 实验方法 2.1 培养条件液体培养条件均为:于500 mL的锥形瓶中加入270 mL 9 K培养基,9 K培养基用体积比为1∶1的浓硫酸调至pH值为2,以FeSO4·7H2O为能源物质,接种10 %对数期的菌液. 30 ℃,摇床培养. 根据Maier经验推导以及经Seletzky[20]实验验证的关于培养液中气-液传质系数kLα与摇床转速n关系式: kLα=6.67x10-6n1.16V-0.83d00.38d1.92(kLα为气-液传质系数,n为摇床转速,V为培养液体积,d0为转动外直径,d为转动内直径),可以采用转速高低来表征摇瓶培养液中氧气含量高低.由于嗜酸氧化亚铁硫杆菌是好氧菌,摇瓶培养转速低时,细菌生长缓慢,且生长量低,故在探讨氧气浓度对基因表达影响时选取的最低转速80 r/min, 5个条件依次为80、110、140、170、200 r/min.
2.2 生长曲线测定取对数期的GD-0菌接种于9K培养基中,170 r/min摇床培养. 接种后立即用血球计数板在光学显微镜下观察,计数细胞浓度. 以后每隔12 h计数1次,如未特别说明,均重复3次.
2.3 RNA提取、纯化以及cDNA合成将培养至对数期的菌用慢速滤纸过滤除去黄钾铁矾,然后使用Beckman Avanti J-E离心机在12 000 r/min,4 ℃条件下离心10 min收集菌体.尽量去除上清培养基后,用pH值为2的无菌水冲洗菌斑,并将其转移至EP管中,12 000 r/min,5 min收菌,弃掉上清液. 收集后用北京庄萌生物技术公司提供的试剂盒提取RNA,然后用1XTAE琼脂糖电泳检验RNA质量, 最后用Thermo Scentific提供的反转录试剂盒除去基因组DNA,并进行反转录,以获得cDNA.
2.4 引物设计以及qPCR检测以NCBI网站(http://www.ncbi.nlm.nih.gov/)上的A. ferrooxidans ATCC23270全基因组中的feoB、tonB和ABC基因以及AFE_RS06830基因为模板,利用Primer Primer 5.0进行引物设计,设计后的引物由南京金斯瑞生物科技有限公司合成. 引物合成后,以cDNA为模板进行扩增. 将扩增产物测序,扩增序列与目的基因一致的引物用于qPCR研究. 具体引物见表 2.
| 表2 引物序列及预计PCR产物大小 Table 2 Primer sequence and length of product |
 |
| 点击放大 |
2.5 氧气对GD-0菌株磁性颗粒形成的影响
收集不同转速下培养的GD-0菌株.将培养基上清去除后,用2.5 %的异戊醛固定,对其进行超薄切片后,将切片至于透射电子显微镜下观察不同转速细菌体内颗粒形成的情况.
3 结果与分析 3.1 以亚铁为能源GD-0菌株生长曲线的测定GD-0菌株以亚铁为能源时,生长曲线如图 1所示. 图 1表明:在以亚铁为能源时,GD-0菌株生长较快,对数期约为60 h. 取生长约48 h的菌提取RNA,进行基因差异表达研究.
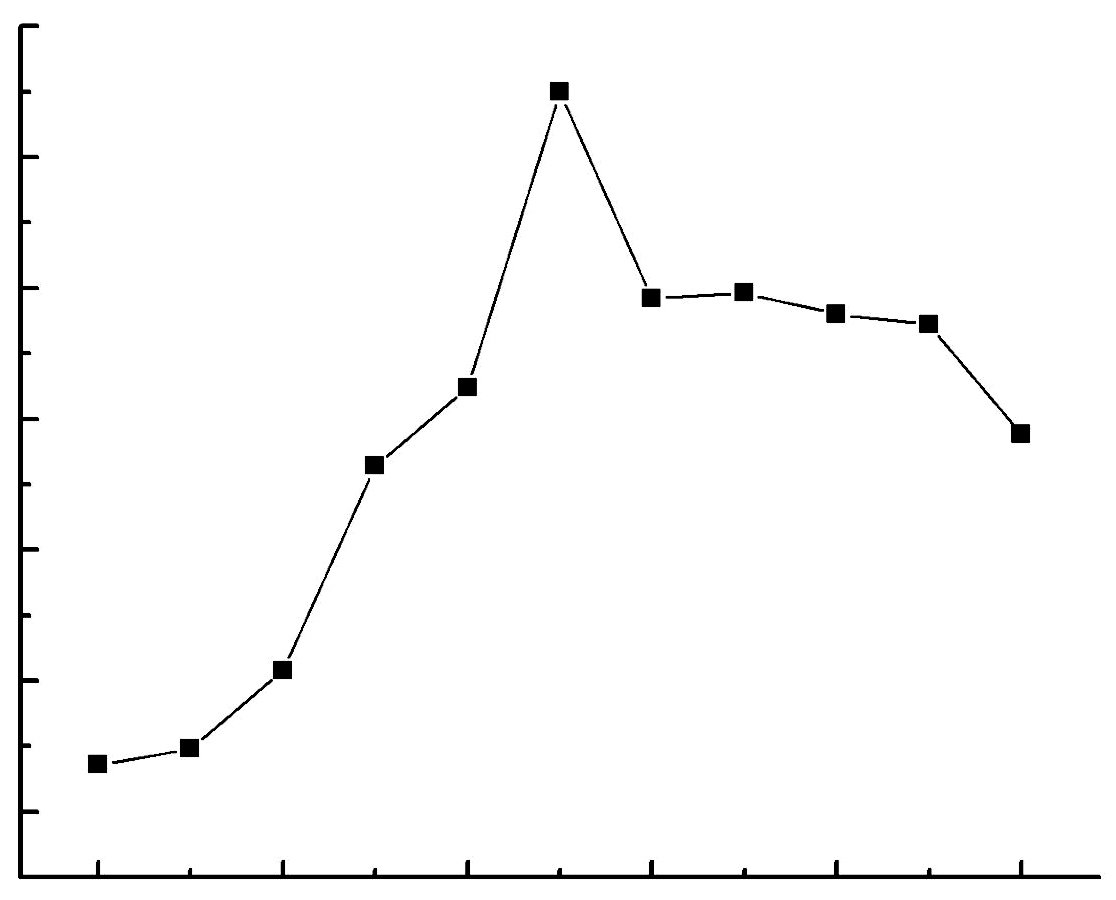 |
| 图 1 Acidithiobacillus ferrooxidans GD-0生长曲线 Fig. 1 Growth curve of Acidithiobacillus ferrooxidans GD-0 |
3.2 不同转速下铁离子转运基因表达情况
各基因在不同转速下的表达情况如图 2所示,结果表明:二价铁离子转运系统中,趋磁基因mpsA在80 r/min时,表达量最高,在200 r/min时表达量最低. 随着转速降低,mpsA基因表达量呈现上调趋势趋势. feoB基因表达情况与mpsA基因一致. 这表明趋磁基因mpsA、feoB的表达量随着氧气浓度的降低而增高. 在三价铁离子转运系统中,feoB基因在200 r/min时表达量最高,在80 r/min时,表达量最低. 随着转速增大,feoB基因表达量呈现上调趋势. 而ABC基因表达量无较大差异.可以证实这些基因的表达量与氧气浓度有关.
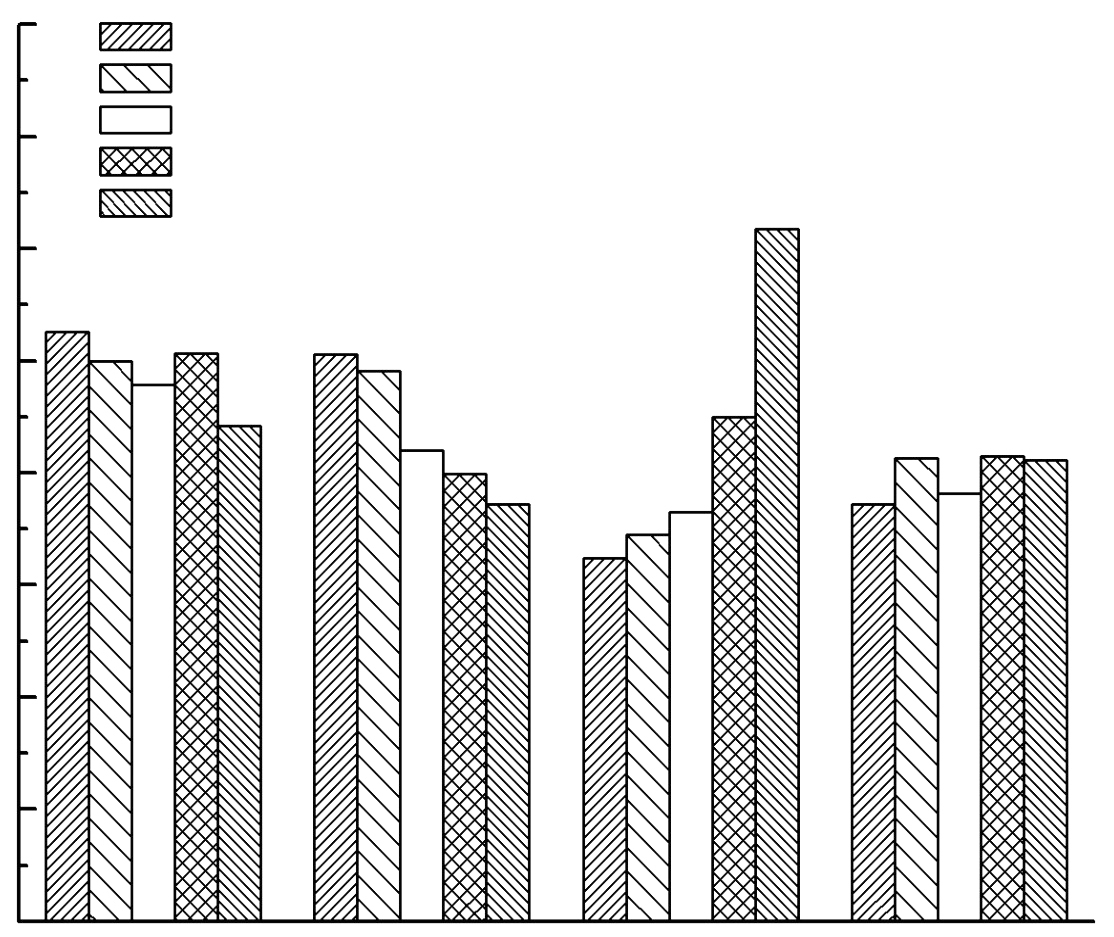 |
| 图 2 转铁基因在不同转速下的差异表达 Fig. 2 Different expression of four genes in different shaking frequency |
3.3 不同转速下GD-0菌株磁性颗粒的形成情况
实验分别对不同转速下生长的菌做透射电子显微镜观察,选取110 r/min和170 r/min 2个条件进行结果展示,如图 3所示. 图 3中结果表明,在110 r/min培养条件下,GD-0菌株胞内形成的磁性颗粒(白色箭头所指)数量要多于170 r/min 条件下生长的菌株.表明当环境中氧浓度处于能满足A.ferrooxidans的生长范围时,随着氧气浓度的降低,A.ferrooxidans胞内磁性颗粒数量增多. 研究人员早年通过对其他兼性厌氧或厌氧趋磁细菌的研究,发现氧气也影响其胞内磁性颗粒的形成.Yang Chendong[21]等在研究氧气对兼性厌氧趋磁细菌AMB-1中磁小体形成的影响时发现,当大气中的氧气浓度维持在2 %~8 %时,此时培养液中的氧气含量很低,在此条件下培养的AMB-1胞内磁性颗粒产量较多. 一旦培养液中氧含量超过0.2×10-6,AMB-1胞内磁性颗粒产量则明显降低. 陈小丽等[22]也研究了氧因素对趋磁螺菌AMB-1磁小体形成的影响及其相关基因表达的影响,他们发现,AMB-1在好氧条件下培养2.5 h后,其Cmag值下降,形成的磁小体链短而疏松. 而在微氧条件下培养10 h后,其Cmag值显著增高,磁小体呈紧密的长链分布. Liu Yang等[23]在对趋磁细菌MSR-1进行大规模培养时发现,MSR-1只有在低氧或无氧条件下才大量吸收铁合成磁小体. 实验研究发现,在氧含量较低时,好氧菌A.ferrooxidans能形成较多的磁性颗粒. 由此看来,无论是厌氧、兼性厌氧趋磁细菌,还是新发现的能产磁性颗粒的好氧菌A.ferrooxidans,培养液中氧气含量低有利于其胞内磁性颗粒的形成.
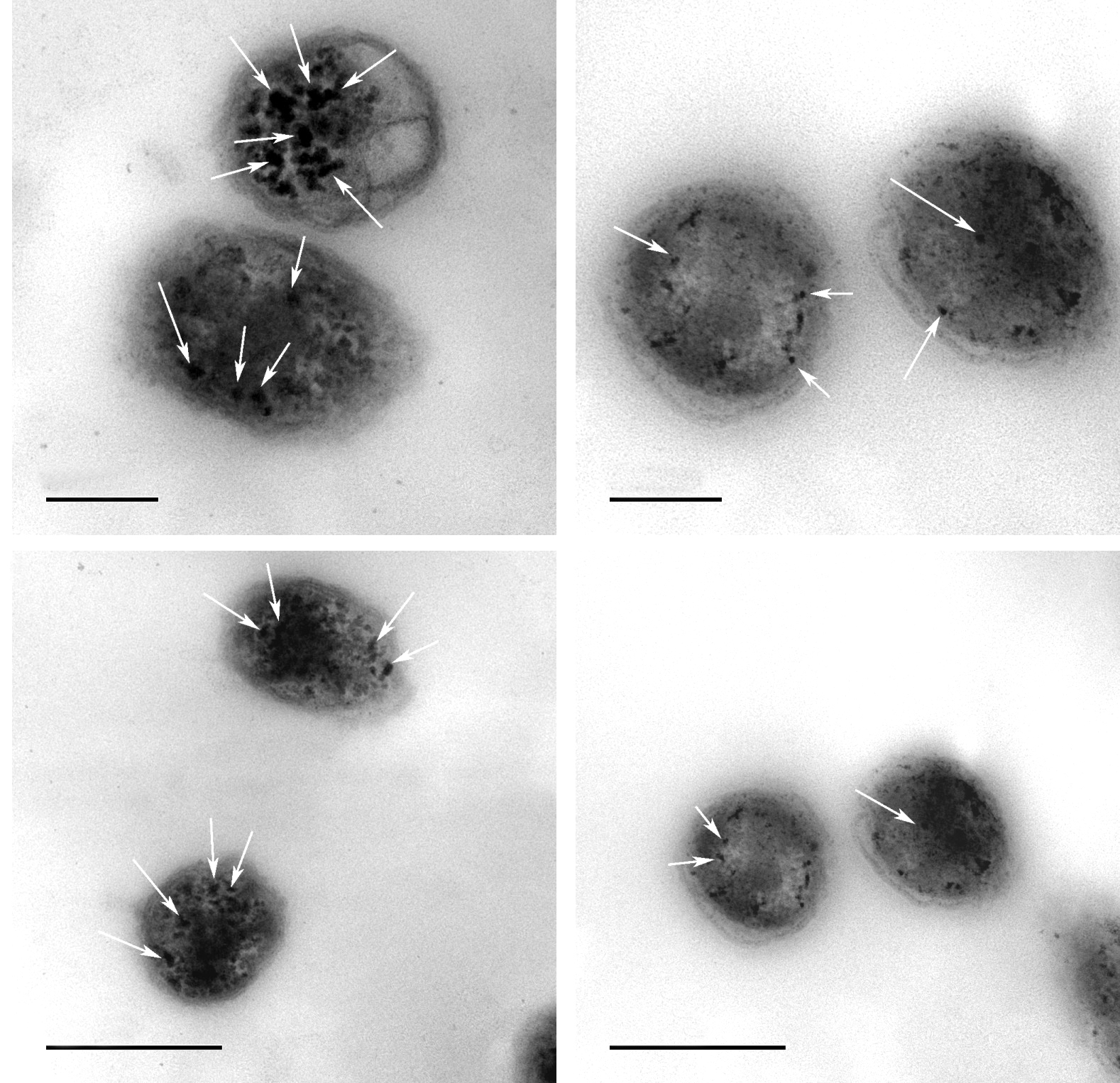 |
| 图 3 不同培养条件下磁性颗粒的透射电子显微镜像 Fig. 3 Transmission electron microscopy images of magnetosome from A. ferrooxidans in different shaking frequency |
4 结论
在满足嗜酸氧化亚铁硫杆菌生长的氧浓度范围内,为了探究氧气对A.ferrooxidans胞内磁性颗粒形成机制的影响,实验采用Real-time PCR技术研究了A.ferrooxidans中2个与磁小体形成相关的二价铁转运基因feoB、mpsA和三价铁转运基因tonB、ABC在不同转速下的差异表达,得到结论如下: 1)随着环境中含氧量降低,mpsA、feoB基因表达均上调.
2)A.ferrooxidans在110 r/min培养条件下胞内形成的磁性颗粒量比170 r/min培养条件下形成的磁性颗粒量多,表明在满足A.ferrooxidans生长的氧浓度范围内,氧气含量低时A.ferrooxidans胞内更易形成磁性颗粒.这将为深入研究A.ferrooxidans磁小体形成机理打下基础.
3)比较110 r/min和170 r/min 2种培养条件,当与磁小体形成相关的二价铁转运基因mpsA、feoB表达量高时,胞内磁性颗粒形成也略多.表明氧气既影响A.ferrooxidans中mpsA、feoB基因的表达,也影响其胞内磁性颗粒的形成.
4)三价铁吸收基因的表达趋势与二价铁吸收基因的表达趋势相反,说明二价铁基因和三价铁基因在功能上可能存在相互协调作用.
| [1] | 曾伟民, 周丹, 石丽娟, 等.功能基因芯片技术在生物冶金研究中的应用进展[J]. 有色金属科学与工程,2013,4 (6):8–12. |
| [2] | 张宗旺, 李健, 李燕, 等.国内难选铁矿的开发利用现状及发展[J]. 有色金属科学与工程,2012,3 (1):72–77. |
| [3] |
CORNELIS P, QING W, ANDREWS S M, et al. Iron homeostasis and management of oxidative stress response in bacteria[J].
Meta-llomics, 2011,3 (6):540–546. |
| [4] |
KREWULAK K D, VOGEL H J. Structural biology of bacterial iron uptake[J].
Biochimica et Biophysica Acta (BBA) - Biomembranes, 2008,1778 (9):1781–1804. DOI: 10.1016/j.bbamem.2007.07.026. |
| [5] | 刘新星, 刘文斌, 武海艳, 等.固体平板磁泳分离细菌新方法[J]. 中国生物工程杂志,2008 (3):79–83. |
| [6] |
GRUNBERG K, MULLER E C, OTTO A, et al. Biochemical and proteomic analysis of the magnetosome membrane in magnetosp-irillum gryphiswaldense[J].
Applied and Environmental Microbiology, 2004,70 (2):1040–1050. DOI: 10.1128/AEM.70.2.1040-1050.2004. |
| [7] |
BAZYLINSKI D A, GARRATT-REED A J, FRANKEL R B, et al. Electron microscopic studies of magnetosomes in magnetotactic bacteria[J].
Microscopy Research and Technique, 1994,27 (5):389–401. DOI: 10.1002/(ISSN)1097-0029. |
| [8] |
BAZYLINSKI D A, FRANKEL R B. Magnetosome formation in prokaryotes[J].
Nature Reviews Microbiology, 2004,2 (3):217–230. DOI: 10.1038/nrmicro842. |
| [9] |
STEPHEN M, GEOFFREY A O. Synthesis of inorganic materials with complex form[J].
Nature, 1996,382 (5):313–318. |
| [10] | 解宇.使用磁性细菌粒子分离浓缩和检测癌胚抗原[J]. 中华微生物学和免疫学杂志,2006,23 (2):159–160. |
| [11] |
MATSUNAGA T, MARUYAMA K, TAKEYAMA H, et al. High-throughput SNP detection using nano-scale engineered biomagnetite[J].
Biosensors and Bioelectronics, 2007,22 (9/10):2315–2321. |
| [12] | 张晓金, 原续波, 常津, 等.具有靶向抗癌功能的O-CMC磁性纳米材料载体系统的制备[J]. 高分子通报,2004,22 (3):89–92. |
| [13] | 姜伟, 付刚, 李颖, 等.细菌内磁性纳米颗粒研究[J]. 中国医学工程杂志,2003,11 (6):59–62. |
| [14] | 武振华, 孙津生, 宋慧平, 等.趋磁细菌(MTB)吸附Pd2+的实验研究[J]. 离子交换与吸附,2006,22 (5):385–391. |
| [15] |
XY H, AGUILAN Z P, YANG L, et al. Antibody conjugated magnetic iron oxide nanoparticles for cancer cell separation in fresh whole blood[J].
Biomaterials, 2011,32 (36):9758–9765. DOI: 10.1016/j.biomaterials.2011.08.076. |
| [16] | 郭芳芳, 杨薇, 姜伟.细菌纳米磁小体的合成机制及应用[J]. 生物技术进展,2012,2 (1):16–22. |
| [17] |
QUATRINI R, JEDLICKI E, HOLMES D S. Genomic insights into the iron uptake mechanisms of the biomining microorganism Acidithiobacillus ferrooxidans[J].
Journal of Industrial Microbiology & Biotechnology, 2005,32 (11/12):606–614. |
| [18] | 刘新星, 刘文斌, 闫颖, 等.氧化亚铁硫杆菌中磁小体形成相关基因mpsA在不同铁源刺激下的差异表达[J]. 中南大学学报(自然科学版),2009 (6):1471–1475. |
| [19] |
RONG C B, ZHANG C, ZHANG Y T, et al. FeoB 2 functions in magnetosome formation and oxidative stress protection in magnetospirillum gryphiswaldense strain MSR-1[J].
Journal of Bacteriology, 2012,194 (15):3972–3976. DOI: 10.1128/JB.00382-12. |
| [20] |
SELETZKY J M, NOAK U, FRICKE J, et al. Scale-up from shake flasks to fermenters in batch and continuous mode with corynebacterium glutamicum on lactic acid based on oxygen transfer and pH[J].
Biotechnology Bioengineering, 2007,98 (4):800–811. DOI: 10.1002/(ISSN)1097-0290. |
| [21] |
CHENG D Y, HARUKO T, TSUYOSHI T, et al. Effects of growth medium composition, iron sources and atmospheric oxygen concentrations on production of luciferase-bacterial magnetic particle complex by a recombinant magnetospirillum magneticum AMB-1[J].
Enzyme and Microbial Technology, 2001,29 (29):13–19. |
| [22] | 陈小丽, 纪国强, 孔登, 等.氧因素对趋磁螺菌AMB-1磁小体形成及其相关基因表达的影响[J]. 潍坊医学院学报,2012,34 (1):21–25. |
| [23] |
YANG L, GUO R L, FANG F G, et al. Large-scale production of magnetosomes by chemostat culture of magnetospirillum gryphiswaldenseat high cell density[J].
Microbial Cell Factories, 2010,9 (50):8687–8692. |
 2016, Vol. 7
2016, Vol. 7


