| 硅粉直接氮化反应热力学分析及动力学机理研究 |
1b. 高端金属材料特种熔炼与制备北京市重点实验室,北京 100083;
2. 中色(宁夏)东方集团有限公司,宁夏 石嘴山 753000
1b. Beijing Key Laboratory of Special Melting and Preparation of High-End Metal Materials, University of Science and Technology Beijing, Beijing 100083, China;
2. CNMC Ningxia Orient Group Co. Ltd., Shizuishan 753000, China
信息、能源、材料被誉为当代科技的三大支柱.随着科学技术的飞速发展和生产力水平的不断提高,各领域对耐热材料的要求也愈加严苛. 尽管高镍铬合金、钴系合金等超级合金已被广泛采用,然而金属在高温下容易氧化、熔融,且在恶劣环境中还有化学侵蚀、剥离、磨损、塑性变形和老化等许多弱点[1]. 在此形势下开发了许多新型的氮化硅陶瓷材料,它已被广泛运用于机械、化工、电子、军工等领域[2]. 氮化硅粉作为氮化硅制品的主要原料,近年来的需求量不断增大,但其昂贵的生产成本严重制约了氮化硅材料的广泛应用.
要得到性能优良的氮化硅陶瓷材料,首先应制备高质量的氮化硅粉末. 制备氮化硅粉末的方法有:自蔓延法[3]、直接氮化法[4]、气相法[5]、碳热还原法[6]、四羧酸二酰亚胺合成法[7]等. 马啸尘等[8]介绍了以木屑为碳源,以硅溶胶浸渍木屑的方法引入SiO2,利用碳热还原氮化反应合成氮化硅粉体,这样制备的氮化硅粉体具有α-Si3N4含量高、杂质少等特点;古亚军[9]以Fe纳米颗粒为催化剂,采用催化氮化的方法制备氮化硅,发现氮化硅晶须的生长机理主要为气相-液相-固相机理与固相-液相-气相-固相机理;李勇等[10-11]研究1 723 K下硅粉直接氮化的反应机理.研究表明:Si首先被氧化成气态SiO,当氧分压足够低时,Si与N2直接反应氮化硅,气态SiO亦可与N2反应生成氮化硅.不同方法制备的氮化硅粉质量不完全相同,导致其在用途上的差异性,因此寻找经济、高效的氮化硅粉末合成方法是发展氮化硅材料的重要前提.硅粉直接氮化法是传统合成氮化硅的方法,与其它方法相比,流程简单,更适合于工业生产.
反应动力学主要研究化学反应进行的机理和速率,如反应速率常数和活化能等动力学参数用于各式反应器的体积计算、反应的热量衡算、物料衡算、收率等,可见动力学研究是必不可少的[12]. 文中采用高纯硅粉作为实验原料采用直接氮化的方法合成氮化硅,尝试使用物理化学原理和方法分析氮化硅制备机理,并研究讨论氮化硅在制备过程中反应的限制性环节并总结归纳出数学模型. 此次研究将会对氮化硅材料的合成提供相关的数据和工艺制定的依据.
1 实 验 1.1 原料分析硅粉直接氮化法要求硅粉纯度至少在95 %以上,粒度最大不超过40 μm,用高纯氮气进行氮化. 采用高纯度硅粉,经检测其Si含量在99.999 %以上,使用LMS-30型激光衍射散射式粒度分布测定仪测得硅粉平均粒径为2.683 μm,实验所采用的氮化气体为纯度大于等于99.999 %的高纯氮气. 硅粉的化学成分列于表 1,图 1所示为硅粉的XRD衍射图谱,图 2所示为硅粉的粒度分布,高纯氮气的化学组成列于表 2.
| 表1 硅粉的化学组成 Table 1 Chemical composition of silicon powder |
 |
| 点击放大 |
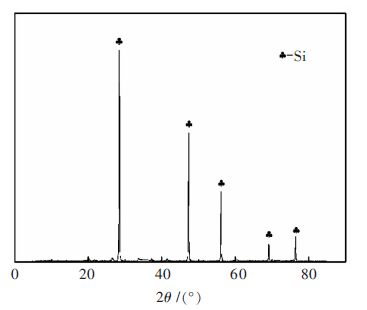 |
| 图 1 硅粉的X 射线衍射谱 Fig. 1 X-ray diffraction pattern of silicon powder |
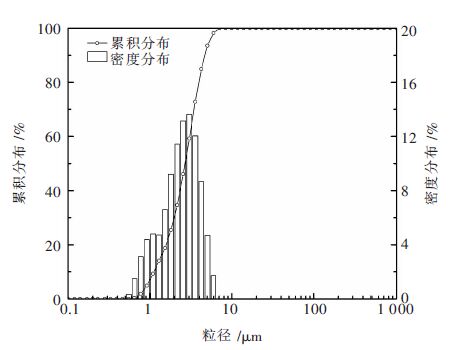 |
| 图 2 硅粉的粒度分布 Fig. 2 Particle size distribution of silicon powder |
| 表2 高纯氮气的化学组成 Table 2 Chemical constituents of high-purity nitrogen |
 |
| 点击放大 |
1.2 实验方法
对实验用的高纯度硅粉,为避免进一步氧化,将其置于低温真空干燥设备中进行干燥.待试样完全干燥后,取出置于干燥皿中,待试样温度达到室温时进行热分析.
实验用热重分析仪采用美国TA仪器公司生产的型号为SDT-Q600的TG-DSC分析仪,实验过程采用热重同步热实验分析,其技术指标为:热量精度:±2 %;测定范围:0.000 1~200 mg;温度范围:25~1 500 ℃. 每次实验前先将热重分析仪开机预热2 h,待热重分析设备运行稳定后进行实验. 充分预热后首先进行空白试验,即在实验氮气流量下对空坩埚的质量变化曲线进行测定,以达到校准硅粉氮化热分析实验的基线,保证实验数据的可靠性与准确性的目的.
实验时,每次用天平称取经低温干燥过的混匀料粉1.0~1.5 mg放入规格为Ф 6.5 mm×4 mm氧化铝坩埚,再放入TG-DSC分析仪中,以20 mL/min的气体流量通入高纯氮气作为保护气,升温速率分别设为5 K/min、10 K/min、15 K/min、20 K/min,升温到1 300 ℃.同时热重分析仪同步记录质量变化和热流功率随温度变化的数值.
1.3 实验数据分析热重分析仪记录整个氮化反应过程中氮化硅的质量变化.由于实验样品仅与氮气接触,所以样品质量变化完全来自氮化反应,所以可根据质量变化得到氮化产物中氮化硅的质量,进而得到其转化率.氮化硅的转化率XSN可用式(1)表示:
| ${{X}_{\text{SN}}}\text{=}\frac{{{W}_{\text{SN}}}}{{{W}_{\text{SN}}}+{{W}_{\text{SN}}}}$ | (1) |
式(1)中:W′SN为产物中硅原子的质量,WSN为产物中氮化硅的质量.
产物中硅元素的质量包括氮化硅中硅元素和硅原子的质量,即为原样品质量Wpo(此处忽略样品中所含杂质),可得出氮化硅的转化率如式(2)所示:
| ${{X}_{\text{SN}}}\text{=}\frac{1}{{{k}_{1}}+\frac{{{k}_{2}}}{\delta {{W}_{\text{p}}}}}$ | (2) |
其中
| ${{k}_{1}}=1-\frac{3{{M}_{\text{Si}}}}{{{M}_{\text{SN}}}}$ | (3) |
| ${{k}_{2}}\text{=}\frac{2{{M}_{{{\text{N}}^{2}}}}}{{{M}_{\text{SN}}}}$ | (4) |
| $\delta {{W}_{\text{p}}}\text{=}\frac{\Delta {{W}_{\text{p}}}}{W_{\text{p}}^{0}}$ | (5) |
式(3)~式(5)中:ΔWp为实验样品反应过程中质量变化;δWp为实验样品反应过程中相对质量变化;MSi、MSN、MN2分别表示Si、Si3N4和N2的相对摩尔质量.
由上述关系式得到硅的转化率可以表达为:
| ${{X}_{\text{Si}}}=\frac{1-{{W}_{\text{Si}}}}{1+\left( \frac{{{M}_{\text{SN}}}}{3{{M}_{\text{Si}}}}-1 \right){{W}_{\text{Si}}}}$ | (6) |
硅粉直接氮化合成氮化硅有以下2种途径:
| $\begin{align} & 3\text{Si}\left( \text{s} \right)+2{{\text{N}}_{2}}\left( \text{g} \right)=\text{S}{{\text{i}}_{3}}{{\text{N}}_{4}}\left( \text{s} \right) \\ & {{\Delta }_{f}}G_{m}^{\phi }=-722.836+0.315T\left( \text{kJ/mol} \right)\left( T<1678\text{K} \right) \\ \end{align}$ | (7) |
| $\begin{align} & 3\text{Si}\left( \text{I} \right)+2{{\text{N}}_{2}}\left( \text{g} \right)=\text{S}{{\text{i}}_{3}}{{\text{N}}_{4}}\left( \text{s} \right) \\ & {{\Delta }_{f}}G_{m}^{\phi }\text{=}-874.456\text{+}0.405T\left( \text{kJ/mol} \right)\left( T\ge 1678\text{K} \right) \\ \end{align}$ | (8) |
由以上2个反应可以得到硅粉直接氮化合成氮化硅时,氮气压力与硅氮化反应生成吉布斯自由能在不同温度条件下的关系. 图 3所示为氮化硅的生成吉布斯自由能在不同温度下随氮气分压的变化图.
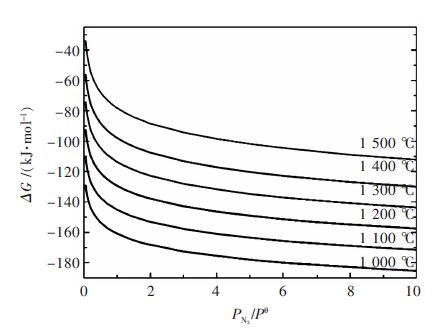 |
| 图 3 在不同温度条件下硅氮化生成氮化硅的反应吉布斯自由能与氮气压力的关系 Fig. 3 Relationship between nitrogen pressure and Gibbs free energy of silicon nitride at different temperature |
从图 3可以看到,随着氮气压力的增加,氮化硅生成吉布斯自由能减小.在温度一定的条件下,氮化硅生成吉布斯自由能的最大变化范围为60 kJ/mol;在给定氮气压力的条件下,反应生成吉布斯自由能随温度的增加而增加,并且当温度达到硅粉熔点温度以上(1 400~1 500 ℃)时,相比低于硅粉熔点温度,其生成吉布斯自由能增加的幅度较大,说明随温度的增加反应越发困难.这是因为硅粉的氮化温度属于气固反应,并且硅粉的直接氮化反应为放热反应,因此在氮化过程中局部过热将导致硅粉部分熔化,生成的熔体将未反应的硅粉包裹,使氮化过程不能够进行,进而影响硅粉的转化率.
从图 3还可以看出,当氮气分压很低时,硅粉直接氮化合成氮化硅的反应仍然可以发生,并且在硅粉熔点温度以下越有利于氮化反应的进行.
2.2 差示扫描量热曲线与温度的关系硅粉直接氮化是硅粉和氮气在非氧化气氛条件下,通过氮气向硅粉颗粒内部扩散进行氮化反应从而得到氮化硅,其主要反应式为:
| $3\text{Si}\left( \text{s} \right)+2{{\text{N}}_{2}}\left( \text{g} \right)=\text{S}{{\text{i}}_{3}}{{\text{N}}_{4}}\left( \text{s} \right) \Delta H=-722.5\text{kJ/mol}$ | (9) |
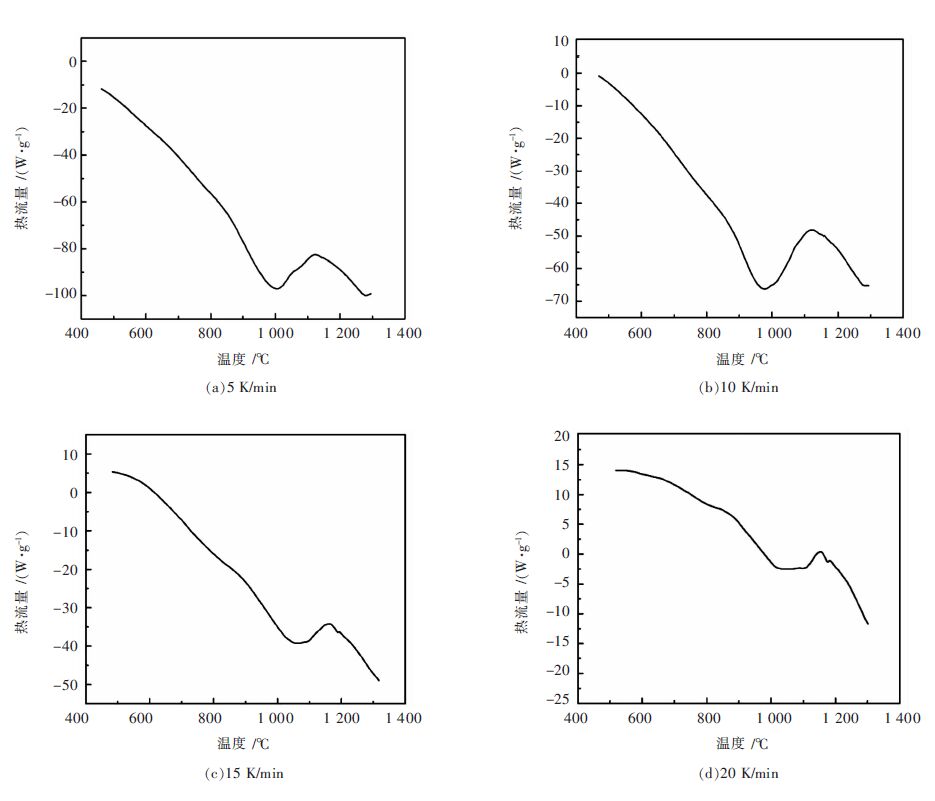
在不同升温速率(5 K/min、10 K/min、15 K/min和20 K/min)下,硅粉直接氮化反应的差示扫描量热曲线如图 4所示. 从图 4可以看到一个吸热峰和一个放热峰. 第1个吸热峰出现在1 000 ℃左右,是由气氛中的残氧首先与表面的Si反应生成SiO所致,其主要反应式为:
| $\text{Si}\left( \text{s} \right)\text{+}1/2{{\text{O}}_{2}}\left( \text{g} \right)\text{=SiO}\left( \text{g} \right) \Delta H=93.2\text{kJ/mol}$ | (10) |
随后在1 100~1 200 ℃时出现一个放热峰,由式(9)可知硅粉直接氮化反应为放热反应,说明硅粉直接氮化反应开始温度为1 100 ℃,除式(9)之外还发生以下反应:
| $\begin{align} & \text{3SiO}\left( \text{g} \right)+2{{\text{N}}_{2}}\left( \text{g} \right)=\text{S}{{\text{i}}_{3}}{{\text{N}}_{4}}\left( \text{s} \right)+3/2{{\text{O}}_{2}}\left( \text{g} \right) \\ & \Delta H=-417.14\text{kJ/mol} \\ \end{align}$ | (11) |
由此可知,位于1 000 ℃左右的吸热峰由式(10)的发生而形成,放热峰则由SiO气体氮化形成,即SiO气体的生成是通过硅粉的氧化反应得到,氮化硅则通过硅粉的直接氮化和SiO气体的氮化两种方式生成,这与李勇等[10]的研究结果一致.
从图 4可以看出,随着升温速率的增加,放热峰向右移动,同时表 3给出不同升温速率下各个放热峰所对应的DSC曲线峰温度值Tm.
 |
| 图 4 不同升温速率下硅粉直接氮化反应的差示扫描量热曲线 Fig. 4 DSC curves of silicon nitride at different heating rates |
| 表3 不同升温速率下硅粉氮化反应的DSC 峰温数值 Table 3 DSC peak temperature values of nitriding reaction of silicon powder at different heating rates |
 |
| 点击放大 |
2.3 不同升温速率条件下氮化硅转化率、质量变化速率与温度的关系
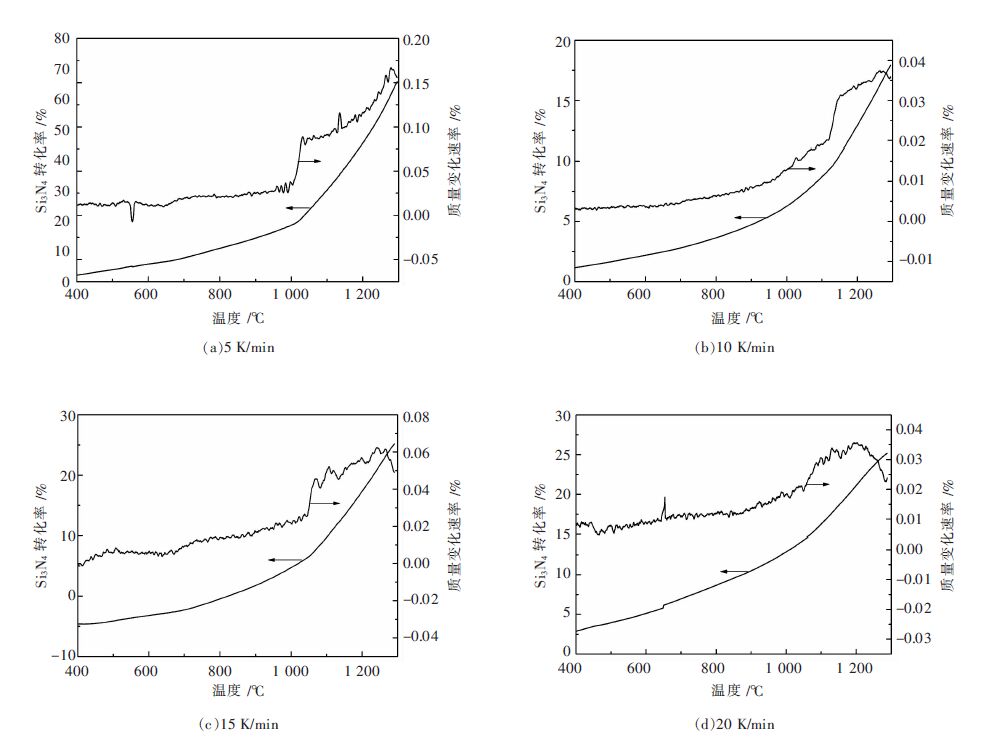
图 5所示为从室温经5 K/min、10 K/min、15 K/min、20 K/min不同升温速率升温到1 300 ℃时热重分析仪同步记录的反应体系质量变化速率随温度的变化关系及经过式(6)处理TG曲线得到氮化硅转化率随温度的变化关系.
从图 5可以看出,在升温初期即温度较低条件下,质量变化率随温度的变化较为平稳,对应着氮化硅转化率变化不大,说明在此阶段温度是限制硅粉直接氮化的主要因素;随着温度的升高,氮化硅转化率大幅度增加. 同样可以明显看出,在不同升温速率下,当温度上升至1 000~1 100 ℃时,质量变化速率随温度的变化曲线出现突然增加的趋势,对应着氮化硅转化率随温度变化曲线出现明显的拐点,说明此时反应速率明显加快,反应处于动力学(界面化学反应)控制阶段;当温度在1 200~1 300 ℃范围内时,质量变化速率随温度的变化曲线出现明显下降趋势,说明反应速率开始下降. 这是由于硅粉颗粒表面的硅已与氮气反应生成的氮化硅,形成产物层(氮化硅)覆盖在反应物(硅粉颗粒)的表面,阻碍硅粉与氮气的接触,使反应速率变慢,此时硅粉氮化反应已经处于界面化学反应与内扩散混合控制阶段.
从图 5中还可以看出,当升温速率增加,在1 000~1 100 ℃范围内,质量变化随温度的变化曲线增加幅度有明显下降趋势;在1 200~1 300 ℃范围内,质量变化随温度的变化曲线下降的拐点也有明显的向左偏移的趋势. 以上2点说明界面化学反应与内扩散混合控制阶段有所提前,即裸露在表面的硅早已反应完毕,进而阻碍硅粉的进一步氮化.
 |
| 图 5 不同升温速率下转化率尧质量变化率随温度变化 Fig. 5 Relationships in conversion rate and mass change rate with temperature at different heating rates |
2.4 动力学模型的建立
采用非等温动力学分析的方法对硅粉直接氮化气固相反应的动力学参数进行提取.常用于非等温动力学分析的方法有单曲线法(模型拟合法)和多曲线法(等转化法). 单曲线法主要利用单条热分析曲线通过假定动力学模型来拟合动力学曲线;多曲线法利用升温速率不同的求出反应的表观活化能,由于不需要假定反应的动力学模型,相比较单曲线法而言,多曲线法在近年来受到普遍的重视[13].
由质量作用定律有:
| $\frac{\text{d}\alpha }{\text{d}t}=K{{\left( 1-\alpha \right)}^{n}}$ | (12) |
式(12)中:K为反应速率常数,α为转化率,t为反应时间,n为反应级数.
Arrhenius公式如式(13):
| $K=A\text{exp}\left( \frac{-E}{RT} \right)$ | (13) |
式(13)中:E为表观活化能,J/mol;A为频率因子,min-1,R为气体常数,R=8.314 J /(mol·K);T为温度,K.
将式(13)代入到式(12)中可得:
| $\frac{\text{d}\alpha }{\text{d}t}=A\text{exp}\left( \frac{-E}{RT} \right){{\left( 1-\alpha \right)}^{n}}$ | (14) |
在恒定的程序升温速率中,设升温速率为β,$\beta =\frac{\text{d}T}{\text{d}t}$,将$\text{d}t=\frac{\text{d}T}{\beta }$代入式(14)可得:
| $\frac{\text{d}\alpha }{\text{d}t}=\frac{A}{\beta }\text{exp}\left( \frac{-E}{RT} \right){{\left( 1-\alpha \right)}^{n}}$ | (15) |
依据上述4个公式,用Kissinger法、Kissinger-Crane法[14-16]计算动力学参数.
Kissinger法通常适用于微分动力学曲线求解表观活化能.Kissinger[15]认为,气-固反应的速率与固体未转化率的n次方成正比,因此微分动力学曲线可用式(14)表示,并将式(14)微分可得:
| $\frac{\text{d}}{\text{d}t}\left( \frac{\text{d}\alpha }{\text{d}t} \right)=\frac{\text{d}\alpha }{\text{d}t}\left[ \frac{E\beta }{R{{T}^{2}}}-An\text{exp}\left( \frac{-E}{RT} \right){{\left( 1-\alpha \right)}^{n-1}} \right]$ | (16) |
令微分动力学曲线的峰点温度为Tm,峰点的转化率为αm,则有:
| $\frac{\text{d}}{\text{d}t}\left( \frac{\text{d}\alpha }{\text{d}t} \right)=0$ | (17) |
利用式(17)可求得:
当n=1时,
| $\frac{E\beta }{RT_{m}^{2}}=A\text{exp}\left( \frac{-E}{R{{T}_{m}}} \right)$ | (18) |
当n≠1时,
| $\frac{E\beta }{RT_{m}^{2}}=An\text{exp}\left( \frac{-E}{R{{T}_{m}}} \right){{\left( 1-{{\alpha }_{m}} \right)}^{n-1}}$ | (19) |
线性升温时$\beta =\frac{\text{d}T}{\text{d}t}=\text{const}$,将式(15)积分可得:
| $\frac{1-{{\left( 1-\alpha \right)}^{n-1}}}{1-n}=\frac{A}{\beta }\int_{0}^{T}{\text{exp}\left( \frac{-E}{RT} \right)}\text{d}T$ | (20) |
令$x=\frac{E}{RT}$代入式(20)可以得到:
| $\frac{A}{\beta }\int_{0}^{T}{\text{exp}\left( \frac{-E}{RT} \right)}\text{d}T\frac{E}{R}\int_{0}^{\infty }{{{x}^{-2}}}{{e}^{-x}}\text{d}x$ | (21) |
采用逐次分部积分,可得:
| $\begin{align} & \frac{A}{\beta }\int_{0}^{T}{\text{exp}\left( \frac{-E}{RT} \right)}\text{d}T= \\ & \frac{E}{R}\left[ 1-\frac{2!}{x}+\frac{3!}{{{x}^{2}}}+\cdots +\frac{{{\left( -1 \right)}^{n+1}}n!}{{{x}^{n-1}}}+\cdots \right]{{x}^{-2}}{{e}^{-x}} \\ \end{align}$ | (22) |
式(22)方括号内的项是迅速收敛的,取前两项也可以足够接近于精确值,将式(22)代入式(20)可得:
| $\frac{1-{{\left( 1-{{\alpha }_{m}} \right)}^{1-n}}}{1-n}=\frac{ART_{m}^{2}}{E\beta }\left[ 1-\frac{AR{{T}_{m}}}{E\beta } \right]\text{exp}\left( \frac{-E}{R{{T}_{m}}} \right)$ | (23) |
由式(19)可得:
| $\text{exp}\left( \frac{-E}{R{{T}_{m}}} \right)=\frac{E\beta }{ART_{m}^{2}}\left[ \frac{1}{n{{\left( 1-{{\alpha }_{m}} \right)}^{1-n}}} \right]$ | (24) |
将式(24)代入式(23)则有:
| $n{{\left( 1-{{\alpha }_{m}} \right)}^{1-n}}=1+\left( n-1 \right)\frac{2R{{T}_{m}}}{E}$ | (25) |
通常情况下$\left( n-1 \right)\frac{2R{{T}_{m}}}{E}\le 1$,因此
| $n{{\left( 1-{{\alpha }_{m}} \right)}^{1-n}}\approx 1$ | (26) |
将式(26)代入到式(19)中即可得到式(18),并将式(18)取对数后对微分可得:
| $\frac{\text{d ln}\left( \beta /T_{m}^{2} \right)}{\text{d}\left( 1/{{T}_{m}} \right)}=\ln \left( \frac{AR}{E} \right)-\frac{E}{R{{T}_{m}}}$ | (27) |
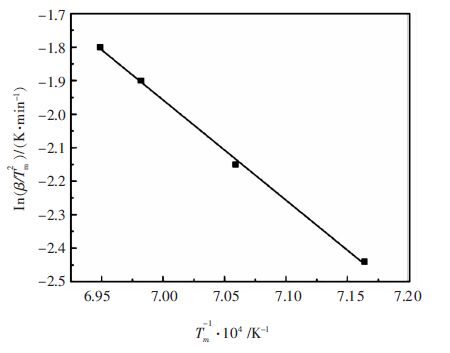
式(27)为Kissinger方程.不同升温速率下动力学曲线的峰点温度均可以通过实验测得,In(β/Tm2)对1/Tm作图得到一条直线,通过斜率-E/R可求得反应活化能E,通过截距可求得频率因子A. 取表 3数据作图结果如图 6所示.由数据拟合得到直线方程为y=26.005-48 653.7x.求得反应表观活化能E=404.5 kJ/mol,频率因子A=9.57×1015 m/s.
 |
| 图 6 $\text{ln}\left( \beta /T_{m}^{2} \right)$与1/Tm的关系图 Fig. 6 Relationship between $\text{ln}\left( \beta /T_{m}^{2} \right)$and 1/Tm |
由α=Hp/ΔHP,ΔHP为DSC曲线下的总反应热,HP为转化率为a时反应热,代入式(14)中并微分得:
| $\begin{align} & \frac{{{\text{d}}^{2}}{{H}_{p}}}{\text{d}{{T}^{2}}}=A\left( \frac{\Delta {{H}_{p}}}{\beta } \right)\exp \left( \frac{-E}{RT} \right) \\ & \left[ {{\left( 1-\alpha \right)}^{n}}\frac{E}{R{{T}^{2}}} \right]-n{{\left( 1-\alpha \right)}^{n-1}}\frac{\text{d}\alpha }{\text{d}T} \\ \end{align}$ | (28) |
当处于DSC曲线放热峰峰值时$T={{T}_{m}},\frac{{{\text{d}}^{2}}{{H}_{p}}}{\text{d}{{T}^{2}}}=0$,因而有:
| $\frac{\text{d}\alpha }{\text{d}T}=\frac{1-\alpha }{n}\left( \frac{E}{RT_{m}^{2}} \right)$ | (29) |
式(15)与式(29)相比较得到:
| $\frac{E}{RT_{m}^{2}}=\frac{A}{\beta }n{{\left( 1-\alpha \right)}^{n-1}}\exp \left( \frac{-E}{R{{T}_{m}}} \right)$ | (30) |
对上式两边取对数得:
| $\ln \beta =\ln \left( \frac{nAR}{E} \right)+\left( n-1 \right)\ln \left( 1-\alpha \right)+\ln {{T}_{m}}-\frac{E}{R{{T}_{m}}}$ | (31) |
将上式两边对1/Tm微分可得:
| $\frac{\text{d}\ln \beta }{\text{d}\left( 1/{{T}_{m}} \right)}=\frac{\left( n-1 \right)T_{m}^{2}}{1-\alpha }\cdot \frac{\text{d}\alpha }{\text{d}T}-2{{T}_{m}}-\frac{E}{R}$ | (32) |
将式(29)代入式(32)可得:
| $\frac{\text{d}\ln \beta }{\text{d}\left( 1/{{T}_{m}} \right)}=-\left[ \frac{E}{nR}+2{{T}_{m}} \right]$ | (33) |
当$\frac{E}{nR}$≥2Tm时得:
| $\frac{\text{d}\ln \beta }{\text{d}\left( 1/{{T}_{m}} \right)}\approx -\left( \frac{E}{nR} \right)$ | (34) |
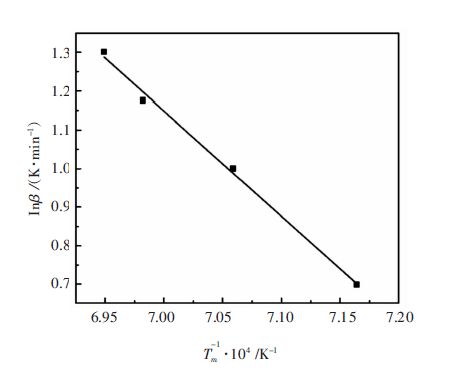
由式(34)可知,lnβ与1/Tm呈线性关系,其直线斜率为-E/nR,可求得反应级数n. 取表 3数据作图结果如图 7所示. 由数据取点拟合得到直线方程为y=42.322-51 223.5x,由式(34)可得反应级数n=0.95.
 |
| 图 7 lnβ与1/Tm 的关系 Fig. 7 Relationship between lnβand 1/Tm |
用非等温过程得到动力学参数后,进一步判断反应机理. SATAVA和SETAK[17]认为:假设在一个无限小的时间间隔内,非等温过程可以看成等温过程.将实验求得的动力学参数E、A、n代入式(14)可得反应速率方程为:
| $\frac{\text{d}\alpha }{\text{d}t}=9.57\times {{10}^{15}}\exp \left( \frac{-4.046\times {{10}^{5}}}{RT} \right){{\left( 1-\alpha \right)}^{0.95}}$ | (35) |
1) 从热力学分析来看,在温度一定的条件下,氮化硅生成吉布斯自由能的最大变化范围为60 kJ/mol;在给定氮气压力的条件下,反应温度在硅粉熔点以下有利于氮化反应的进行,且当氮气分压很低时,该反应仍然可以发生.
2) 从动力学机理分析来看,硅粉直接氮化反应呈现出明显的阶段性,因而不能使用单一的反应机理描述该反应过程.具体分析如下:
3) 温度上升至1 000~1 100 ℃时,质量变化率随温度的变化曲线出现明显的增加,对应着氮化硅转化率随温度变化曲线出现明显的拐点,说明反应处于界面化学反应控制阶段.该阶段持续至1 200~1 300 ℃时,质量变化速率随温度的变化曲线出现明显下降趋势,说明由于样品中硅粉颗粒表面的硅已有氮化硅生成,此时反应已经处于界面化学反应与内扩散混合控制阶段.
4) 用Kissinger法、Kissinger-Crane法得到表观活化能E=404.5 kJ/mol,频率因子A=9.57×1015 m/s,反应级数n=0.95,最终得到反应的速率方程$\frac{\text{d}\alpha }{\text{d}t}=9.57\times {{10}^{15}}\exp \left( \frac{-4.046\times {{10}^{5}}}{RT} \right){{\left( 1-\alpha \right)}^{0.95}}$.
| [1] |
SHUKLA P P, LAWRENCE J. Fracture toughness modification by using a fibre laser treatment of a silicon nitride engineering ceramic[J].
Journal of Materials Science, 2010,45 (23):6540–6541. DOI: 10.1007/s10853-010-4743-6. |
| [2] | 鲁元, 杨建锋, 李京龙.碳热还原-反应烧结法制备多孔氮化硅陶瓷[J]. 无机材料学报,2013,28 (5):469–473. |
| [3] | 李金富, 李康, 李拥军, 等.工艺参数对自蔓燃制备氮化硅粉体的影响[J]. 硅酸盐通报,2007,26 (2):252–255. |
| [4] | 李亚伟, 张忻, 田海兵, 等.硅粉直接氮化反应合成氮化硅研究[J]. 硅酸盐通报,2003,22 (1):30–34. |
| [5] | 王勇, 沃银花, 姚奎鸿, 等.流态床CVD 法纳米氮化硅粉体的制备[J]. 无机材料学报,2006,21 (1):41–45. |
| [6] | 李虹, 黄莉萍, 蒋薪.碳热还原法制备氮化硅粉体的反应过程分析[J]. 无机材料学报,1996,11 (2):241–246. |
| [7] | 万小涵, 张广清, JOHNSHARP, 等.高氮分压对碳热还原/氮化法合成氮化硅的影响[J]. 有色金属工程,2015,5 (4):9–12. |
| [8] | 马啸尘, 尹洪峰, 张军战, 等.以木屑为碳源制备氮化硅粉体的研究[J]. 耐火材料,2015,49 (1):31–35. |
| [9] | 古亚军, 曹迎楠, 李发亮, 等.铁纳米颗粒催化氮化硅粉[J]. 硅酸盐学报,2014,42 (12):1585–1589. |
| [10] | 李勇, 朱晓燕, 王佳平, 等.反应烧结氮化硅–碳化硅复合材料的氮化机理[J]. 硅酸盐学报,2001,39 (3):447–451. |
| [11] | 高梅, 李勇, 秦海霞, 等.闪速燃烧合成氮化硅铁的氮化机理[J]. 硅酸盐学报,2015,43 (3):358–362. |
| [12] | 李绍芬. 反应工程[M]. 北京: 化学工业出版社 , 2013 . |
| [13] | 郭汉杰. 冶金物理化学[M]. 北京: 高等教育出版社 , 2006 . |
| [14] | 杨福明, 王立, 尹少武, 等.硅粉常压直接氮化过程的非催化气固反应模型[J]. 北京科技大学学报,2013,35 (6):785–792. |
| [15] |
KISSINGER H E. Reaction kinetics in differential thermal analysis[J].
Analytic Chemistry, 1957,2 (11):1702–1704. |
| [16] | 沈兴. 热重分析与非等温固相反应动力学[M]. 北京: 冶金工业出版社 , 1995 . |
| [17] |
STAVA V, SETAK J. Computer calculation of the mechanism and associated kinetic data using a non-isothermal integral method[J].
Journal of Thermal Analysis and Calorimetry, 1975,8 (3):477–489. DOI: 10.1007/BF01910127. |
 2016, Vol. 7
2016, Vol. 7


