| pH对中度嗜热混合菌氧化载金黄铁矿生物氧化的影响 |
b. 江西理工大学资源与环境工程学院,江西 赣州 341000;
c. 中南大学资源与生物工程学院,长沙 410083
b. Jiangxi Key Laboratory of Mining Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China;
c. School of Minerals Processing and Bioengineering, Central South University, Changsha 410083, China
随着易浸金矿的日益匮乏,难处理金矿已成为目前开采的主要金矿资源,细粒浸染和硫化矿包裹的难处理金矿已成为主要的黄金资源[1]. 硫化矿包裹难处理金矿氰化浸出前必须要经过预处理,目前工业上常用的预处理工艺有焙烧、生物氧化和热压浸出. 相比焙烧和热压浸出,生物氧化工艺具有流程简单、操作方便、成本低和环境友好等优点,因此生物氧化是难处理硫化金矿最有潜力的预处理工艺[2-3]. 自1986年世界上第一座生物氧化提金厂建成投产以来,已有几十家黄金企业采用生物氧化技术处理难处理金矿. 据不完全统计,我国已建成10个左右难处理金矿生物氧化厂[4].
黄铁矿和砷黄铁矿是包裹金最主要硫化矿,由于高浓度三价砷离子对微生物生长具有毒害作用,因此采用生物氧化工艺处理的难处理金矿中黄铁矿含量远大于砷黄铁矿[5]. 生物氧化过程中由于硫氧化微生物可将包裹金的硫化矿物(黄铁矿、砷黄铁矿)氧化生成硫酸,因此氧化体系的pH值随着氧化进行而迅速下降,如果不调节生物氧化体系的酸度,第二段生物氧化的pH值通常会达到0.8左右,远低于浸矿微生物的最适生长pH值(1.0~2.5) ,因而抑制微生物生长和硫化矿的氧化溶解[6-8]. 一些生物氧化厂已经在难处理金矿生物氧化过程中采取措施控制生物氧化体系的pH值来促进难处理金矿的生物氧化[9-10].
控制载金黄铁矿生物氧化过程的pH值对载金黄铁矿生物氧化的影响研究较少. 因此,文中以载金黄铁矿为研究对象,通过分析控制中度嗜热菌生物搅拌氧化载金黄铁矿体系的pH值和不控制pH值的氧化效果,采用XRD分析生物氧化渣成分,来揭示控制pH值对载金黄铁矿生物氧化的影响.
1 实 验 1.1 矿物样品实验中所用的载金黄铁矿来自贵州水银洞矿区的浮选金精矿,经摇床富集后进行预处理:用 3 mol/L HCl 浸泡 30 min,过滤后矿样用热丙酮溶液洗涤3次,最后用蒸馏水洗涤多次后于50 ℃下真空干燥.多元素分析结果表明,载金黄铁矿样品主要组成(质量分数):铁(43.68 %),硫( 51.6 %),砷( 3.06 %)和金( 54.79 g/t). 实验所用载金黄铁矿样品均为≤0.037 mm 占 80 %.
1.2 微生物实验所用微生物为从贵州水银洞矿坑水中分离获得的中温和中度嗜热菌的混合菌,主要由 Leptospirillum,A.albertensis,A.ferrooxidans 和 A.caldus 组成,混合菌的最适生长温度为 35~45 ℃.混合菌培养所用培养基为9 K培养基,培养时添加0.02 %酵母提取物.
1.3 生物搅拌氧化试验载金黄铁矿生物搅拌氧化试验是在搅拌反应器中进行,2 L的不锈钢反应器中加入1 L9 K培养基,初始菌种浓度为2×107个细胞/mL,矿浆浓度为10 %,氧化温度40 ℃,氧化时间5 d.当生物氧化体系的pH值下降至设定的控制pH时,开始采用1 mol/L的氢氧化钠调整pH值至设定值.
1.4 检测分析载金黄铁矿生物氧化液的pH 值用 Mettler Toledo SG2 酸度计测定,氧化还原电位采用 HACH SENSION+ 5055 电位计测定,参比电极为 Ag/AgCl. 总铁采用原子吸收分光光度法检测.生物氧化渣制备如文献[11]所述,氧化渣的 XRD 采用日本岛津 X 射线衍射仪 XRD-600 测定,氧化渣进行硫分分析.
2 结果与讨论不控制生物氧化体系pH值条件下,载金黄铁矿生物氧化过程的氧化行为如图 1所示.
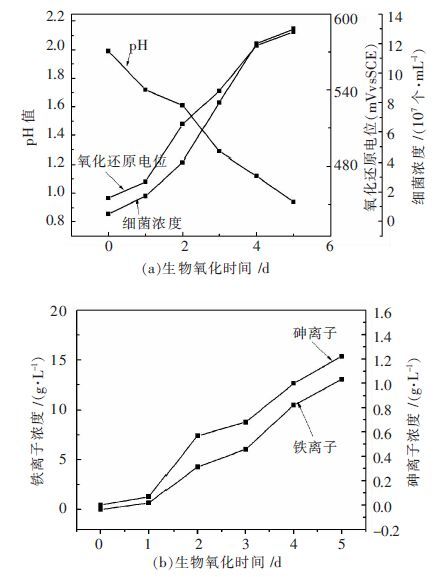 |
| 图 1 不控制pH 值条件下载金黄铁矿生物氧化行为 Fig. 1 Biooxidation behaviors of gold-containing pyrite biooxidation under condition of no system pH values control |
不控制生物氧化体系pH值条件下载金黄铁矿生物氧化体系pH值随氧化进行快速下降,氧化4 d后生物氧化体系的pH值已经低于1,经过5 d氧化pH值约为0.9,低于混合菌的最适生长pH,因此生物氧化后期微生物对载金黄铁矿氧化溶解的促进作用显著降低,这个阶段载金黄铁矿主要是在化学氧化作用下溶解.生物氧化过程中pH值快速下降主要是由于黄铁矿在三价铁离子的氧化作用下按照方程式(1) 和方程式(2) 氧化溶解过程中生成H+,同时黄铁矿氧化溶解过程中形成的单质硫会在硫氧化微生物的作用下按照方程式(3) 氧化生成硫酸生成H+[12-13]. 因此,随着载金黄铁矿的不断氧化溶解,生物氧化体系的pH值不断下降.
| $Fe{{S}_{2}}+8{{H}_{2}}O\text{ }+14F{{e}_{3}}+\to 15F{{e}^{2+}}+2SO_{4}^{2-}+16{{H}^{+}}$ | (1) |
| $2Fe{{S}_{2}}+2{{O}_{2}}+7{{H}_{2}}O\to 2F{{e}^{2+}}+4SO_{4}^{2-}+4{{H}^{+}}$ | (2) |
| $2S+\text{ }3{{O}_{2}}+\text{ }2{{H}_{2}}O\to 2SO_{4}^{2-}+4{{H}^{+}}$ | (3) |
从图 1(a)可知,在搅拌和通气条件下,微生物快速生长,经过1 d缓慢生长后细菌进入对数期,快速生长出现在第2天到第4天,4 d后细菌生长显著变慢.微生物在4 d后生长显著变缓的主要原因是生物氧化体系的pH值4 d后已经低于1.0,低于浸矿微生物的最适pH值,因而抑制微生物生长. Vilcaez等 [14]也发现把浸出体系的初始pH值从1.5降低至1.0,严重抑制了高温菌浸出黄铜矿的效果,表明高酸度抑制微生物的生长和氧化活性.
不控制pH值条件下,铁离子和砷离子浓度变化趋势相同,都随着浸出的进行而快速增大,表明载金砷黄铁矿和载金黄铁矿在生物氧化过程中快速氧化溶解,氧化5 d总铁和总砷离子浓度分别为13.08 g/L和1.22 g/L.
当生物氧化体系的pH值低于1.2开始流加1 mol/L氢氧化钠溶液将生物氧化体系的pH值控制在1.2左右的载金黄铁矿生物氧化行为如图 2所示.从图 2(a)可知,经过4 d的氧化,体系的pH值降低至1.2左右,因此从第4天开始流加1 mol/L氢氧化钠来控制生物氧化体系pH值为1.2左右.
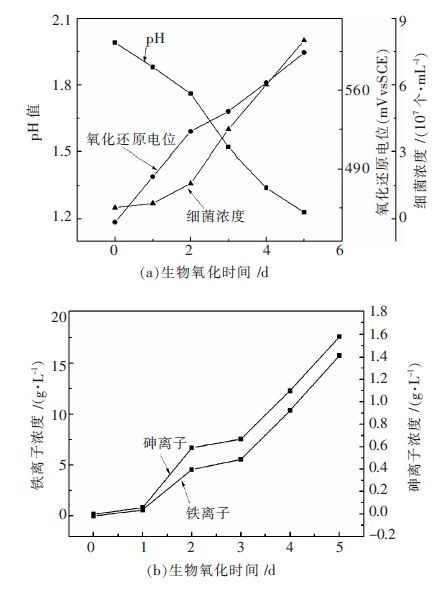 |
| 图 2 控制pH 值为1.2 条件下载金黄铁矿生物氧化行为 Fig. 2 Biooxidation behaviors of gold-containing pyrite biooxidation under condition controlled pH value of system to 1.2 |
对比图 1和图 2可知,控制pH值为1.2对氧化还原电位影响较小,2种情况下生物氧化体系的氧化还原电位都随着生物氧化的进行而持续升高.然而控制pH值至1.2条件下微生物持续快速生长,经过5 d氧化微生物浓度达到2.0×108个细菌/mL,远大于不控制pH值条件下的1.28×108个细菌/mL.控制pH值至1.2使铁离子浓度从13.08 g/L增大至15.75 g/L,表明将载金黄铁矿生物氧化体系pH值控制至1.2显著促进载金黄铁矿生物氧化.
控制载金黄铁矿生物氧化体系的pH值至1.6条件下载金黄铁矿的生物氧化特征如图 3所示.从图 3可知,生物氧化2 d后生物氧化体系的pH值已经达到1.6,因此从2 d后开始流加1 mol/L氢氧化钠来控制生物氧化体系pH值为1.6.从图 1、图 2、图 3可知,控制pH值至1.2和1.6 都比不控制生物氧化体系pH值的生物氧化效果好,经过5 d的氧化总铁浓度分别从不控制pH值的13.08 g/L增大至15.75 g/L和13.58 g/L,该结果和其他研究者的研究结果相似[8].载金黄铁矿生物氧化的最适pH为将体系的pH值控制为1.2.
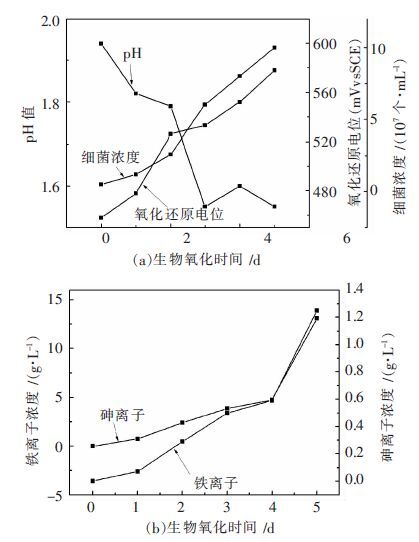 |
| 图 3 控制pH 值为1.6 条件下载金黄铁矿生物氧化行为 Fig. 3 Biooxidation behaviors of gold-containing pyrite biooxidation under condition controlled pH value of system to 1.6 |
不控制生物氧化体系pH值和将pH值控制在1.2和1.6条件下载金黄铁矿生物氧化渣的XRD光谱如图 4所示.
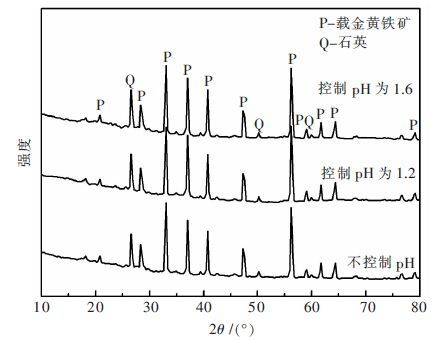 |
| 图 4 载金黄铁矿生物氧化渣的XRD 谱 Fig. 4 XRD patterns of biooxidation residues of gold-containing pyrite |
从图 4可知,载金黄铁矿生物氧化过程中不控制pH值和将pH值控制在1.2和1.6条件下载金黄铁矿生物氧化渣的XRD光谱基本相同,除了未被氧化的黄铁矿特征衍射峰外还含有微量的石英的特征衍射峰. XRD分析结果表明载金黄铁矿生物氧化过程中不生成单质硫和黄钾铁矾等产物,该结果和Zhang等[15] 研究结果相同,它们在采用XRD分析难处理金矿生物氧化过程中形成的产物时,也未检测到固体产物的生成.
3 结 论载金黄铁矿生物氧化过程中控制生物氧化体系的pH值可以显著促进载金黄铁矿生物氧化,将生物氧化体系的pH值控制在1.2可以使铁离子浓度从13.08 g/L增大至15.75 g/L. 载金黄铁矿生物氧化过程中,由于黄铁矿生物氧化产酸使生物氧化体系pH值低于浸矿微生物的最适pH值,进而抑制微生物生长和氧化活性. XRD分析结果表明:载金黄铁矿生物氧化过程中不形成单质硫和黄钾铁矾等固体产物.
| [1] | 李俊萌.难处理金矿石预处理工艺及其选择[J]. 有色金属(选矿部分),2004 (5):16–23. |
| [2] |
OLSON G J, BRIERLEY J A, BRIERLEY C L. Bioleaching review part B: progress in bioleaching: applications of microbial processes by the minerals industries[J].
Applied Microbiology & Biotechnology, 2003,63 (3):249–257. |
| [3] | 周洪波, 肖升木, 胡岳华, 等.金矿石生物氧化预处理研究[J]. 中国矿业,2006,15 (2):39–42. |
| [4] | 李海波, 曹宏斌, 张广积, 等.细菌氧化浸出含金砷黄铁矿的过程机理及电化学研究进展[J]. 过程工程学报,2006,6 (5):849–856. |
| [5] | 朱一民, 魏德洲. 生物技术在矿物加工中的应用[M]. 北京: 冶金工业 , 2008 . |
| [6] | ASWEGEN P C V, NIEKERKJ V, OLIVIER W. The BIOXTM process for the treatment of refractory gold concentrates[M]. Berlin: Springer , 2007 . |
| [7] |
NEALE J W, PINCHES A, DEEPLAUL V. Mintek-BacTech’s bacterial-oxidation technology for refractory gold concentrates: Beaconsfield and beyond[J].
Journal South African Institute of Mining and Metallurgy, 2000,100 (7):415–421. |
| [8] | 宾凌勇, 李荣, 王永平, 等.生物氧化工艺在阿希金矿的应用效果[J]. 新疆有色金属,2008,31 (2):31–32. |
| [9] | 李新春.新疆阿希金矿生物氧化提金工艺的应用[J]. 有色金属工程,2013,3 (5):31–32. |
| [10] | 肖飞, 宋国荣, 于庆强, 等.哈图金矿100 t/d生物氧化的生产调试实践[J]. 新疆有色金属,2011 (1):57–59. |
| [11] |
LIANG C L, XIA J L, ZHAO X J, et al. Effect of activated carbon on chalcopyrite bioleaching with extreme thermophile acidianus manzaensis[J].
Hydrometallurgy, 2010,105 (1/2):179–185. |
| [12] |
PLUMB J J, MUDDLE R, FRANZMANN P D. Effect of pH on rates of iron and sulfur oxidation by bioleaching organisms[J].
Minerals Engineering, 2008,21 (1):76–82. DOI: 10.1016/j.mineng.2007.08.018. |
| [13] |
XIA J L, YANG Y, HE H, et al. Surface analysis of sulfur speciation on pyrite bioleached by extreme thermophile Acidianus manzaensis using Raman and XANES spectroscopy[J].
Hydrometallurgy, 2010,100 (3/4):129–135. |
| [14] |
VILCAEZ J, YAMADA R, INOUE C. Effect of pH reduction and ferric ion addition on the leaching of chalcopyrite at thermophilic temperatures[J].
Hydrometallurgy, 2009,96 (1/2):62–71. |
| [15] |
ZHANG Z Q, LIU S M, CHAO L I, et al. Bacterial pre-oxidation of refractory gold concentrate from the high altitude areas and cyanidation leaching of gold[J].
Chinese Journal of Process Engineering, 2012,12 (1):49–53. |
 2016, Vol. 7
2016, Vol. 7


