| 烟化处理针铁矿渣的热力学分析 |
在锌冶炼过程中,不论采用常规湿法炼锌,还是高温高酸浸出或氧气直接浸出技术炼锌,都不可避免会产生大量渣料[1-3],而锌浸出渣作为一种典型的湿法渣,含有铅、锌、铟、铜等多种有价金属[4],这些金属大都以硫酸盐的形式存在,除硫酸铅外都可以溶于水. 重金属离子和硫酸根离子可以随着雨水进入地表,对地表水造成污染,同时对于其中所含的有价金属造成资源浪费[5],因此,综合回收锌浸出渣中的有价元素对环境保护和节约资源具有重大意义[6-7].
我国现行的湿法炼锌浸出渣的处理方式主要有两种,即湿法和火法[8].湿法以热酸浸出为主,并根据热酸浸出液除铁方式的不同又分为黄钾铁矾法[9]、针铁矿法[10]、赤铁矿法[11]等;火法则以回转窑法[12]、烟化炉法[13]、Ausmelt法[14]为主. 这其中又以针铁矿法的应用最为广泛,但所得铁渣由于铁含量小,难以达到炼铁工业的要求,一般送往渣场堆存,占用宝贵的土地资源,渣场运行费用不菲;同时铁渣中铜、镉、铅、锌、砷、锑、锡等有色金属含量较高,在自然界长期堆存条件下,这些有色金属最终会溶出从而污染土壤和水体[15-16].将此类铁渣进行烟化处理后,不仅能有效回收易挥发的有价金属如铅、锌、镉、铟、锗等,同时得到的玻璃渣也更为稳定,能够有效实现无害化,经处理后可以作为建筑材料,实现二次利用[17].文中就烟化处理针铁矿渣的热力学进行分析,为生产实际提供指导.
1 原料分析试验所用原料来自于韶关冶炼厂的针铁矿渣,采用荷兰帕纳科(PANalytical)公司生产的Axios型X射线荧光光谱分析(XRF)、Rigaku公司生产的TTR-Ⅲ型X射线衍射光谱分析(XRD)、日本电子公司JSM-6360LV型扫描电镜(SEM)以及美国Universal 公司生产的SDT Q600 型热重-差热同步热分析仪(TG-DTA)对原料进行分析. 结果如表 1、图 1、图 2所示,锌浸出渣的TG-DTA热分析结果如图 3所示. 测试条件为:升温速度10 ℃/min、氮气流量100 mL/min、升温区间为25~1 000 ℃.
| 表1 针铁矿渣XRF分析结果 /% Table 1 XRF analysis result of goethite residue /% |
 |
| 点击放大 |
 |
| 图 1 针铁矿渣SEM像 Fig. 1 SEM images of goethite residue |
 |
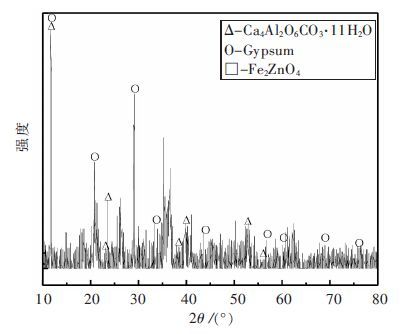
| 图 2 针铁矿渣XRD谱 Fig. 2 XRD patterns of goethite residue |
XRD分析结果表明针铁矿渣的主要成分为铁酸锌(ZnFe2O4)、Fe3O4及Fe2.95Si0.05O4. 根据文献检索和实践调研,针铁矿渣中Fe主要以FeOOH、Fe2O3·xH2O、(H3O)2Fe6(SO4)4(OH)12、Fe2O3·0.64H2O·0.2SO3、Fe2(SO4)3等形式存在,其微观形貌也多为针状[18],但实验所取样品却呈现出不规则的团聚状态,这可能是由于实际生产中对反应条件的控制及其长期堆放后发生副反应,主要以复杂的多金属硫酸盐、硅酸盐形式存在. Zn主要是以ZnSO4形式存在于渣中,此外还有少量没有反应的ZnO和ZnS. Pb主要以PbSO4、PbFe6(SO4)4(OH)12形式存在于渣中.
图 2表明,针铁矿渣颗粒尺寸大小不一,粒径分布宽,微观形貌为无定型的团聚体.图 3结果表明,针铁矿渣的DTA曲线分别在126.05 ℃、245.43 ℃、447.04 ℃、560.23 ℃等处均有吸热峰存在,在126.05 ℃的吸热峰对应于锌浸出渣中吸附水的挥发,245.43 ℃的吸热峰对应于结晶水的脱除,447.04 ℃和560.23 ℃的吸热峰可能对应于Fe2(SO4)3和ZnSO4等硫酸盐或其它杂质化合物的分解挥发.与此对应的TG曲线上有三个失重平台.温度低于245 ℃时,失重率约为9 %;在580~720 ℃之间,失重率约为0.7 %~0.8 %;温度大于900 ℃时,试样又开始缓慢失重,应该是某些化合物高温热分解或挥发所致[19].
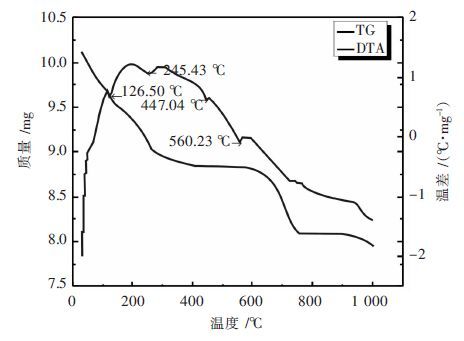 |
| 图 3 针铁矿渣的TG-DTA谱 Fig. 3 TG-DTA patterns of goethite residue |
2 复杂化合物及金属硫酸盐的分解
在1 200~1 500 ℃高温下,针铁矿渣首先可能发生以下分解反应:
| $\begin{align} & 2FeOOH=F{{e}_{2}}{{O}_{3}}+{{H}_{2}}O\uparrow \\ & F{{e}_{2}}{{O}_{3}}\cdot x{{H}_{2}}O=F{{e}_{2}}{{O}_{3}}+x{{H}_{2}}O\uparrow \\ & {{\left( {{H}_{3}}O \right)}_{2}}F{{e}_{6}}{{\left( S{{O}_{4}} \right)}_{4}}{{\left( OH \right)}_{12}}=3F{{e}_{2}}{{O}_{3}}+4S{{O}_{3}}\uparrow +9{{H}_{2}}O\uparrow \\ & PbF{{e}_{6}}{{\left( S{{O}_{4}} \right)}_{4}}{{\left( OH \right)}_{12}}=PbO+3F{{e}_{2}}{{O}_{3}}+4S{{O}_{3}}\uparrow +6{{H}_{2}}O\uparrow \\ & F{{e}_{2}}{{O}_{3}}\cdot 0.64{{H}_{2}}O\cdot 0.2S{{O}_{3}}=\text{ }F{{e}_{2}}{{O}_{3}}+0.64{{H}_{2}}O+0.2S{{O}_{3}}\uparrow \\ & F{{e}_{2}}{{\left( S{{O}_{4}} \right)}_{3}}=F{{e}_{2}}{{O}_{3}}+3S{{O}_{3}}\uparrow \\ \end{align}$ |
针铁矿渣中可能存在复杂化合物ZnO·Fe2O3,在惰性气氛中分解温度为1 020 ℃,在CO气氛中分解温度降至400 ℃:
| $ZnF{{e}_{2}}{{O}_{4}}=ZnO+F{{e}_{2}}{{O}_{3}}$ |
针铁矿中的硫酸锌ZnSO4加热到250 ℃时的各种水合物完全失去结晶水,680 ℃时分解为硫酸氧锌 Zn3O(SO4)2,750 ℃以上进一步分解,最后在930 ℃左右分解为氧化锌ZnO[20]:
| $\begin{align} & 3ZnS{{O}_{4}}\text{ }=\text{ }Z{{n}_{3}}O{{\left( S{{O}_{4}} \right)}_{2}}+\text{ }S{{O}_{3}}\uparrow \\ & ZnS{{O}_{4}}\text{ }=\text{ }ZnO\text{ }+\text{ }S{{O}_{3}}\uparrow \\ \end{align}$ |
PbSO4 在960 ℃以上开始分解:
| $PbS{{O}_{4}}=PbO+S{{O}_{3}}\uparrow $ |
刘群等[21]对熔池熔炼中金属硫酸盐分解的热力学进行研究,结果表明:硫酸盐分解反应的平衡常数随温度的升高而增加,各金属硫酸盐分解由易到难的顺序为:FeSO4、Fe2(SO4)3、ZnSO4、PbSO4.熔池熔炼中温度达到1 043 ℃以上可使针铁矿渣中主要金属硫酸盐较好地分解脱硫.
3 氧化物还原的热力学分析向烟化炉内鼓入空气和粉煤,上述分解反应生成的Fe2O3进而被还原成FeO;FeO再与熔剂一起发生造渣反应[22]:
| $\begin{align} & Si{{O}_{2}}+mFeO+nCaO+jA{{l}_{2}}{{O}_{3}}+kMgO=Si{{O}_{2}}\cdot mFeO \\ & \cdot nCaO\cdot jA{{l}_{2}}{{O}_{3}}\cdot kMgO \\ \end{align}$ |
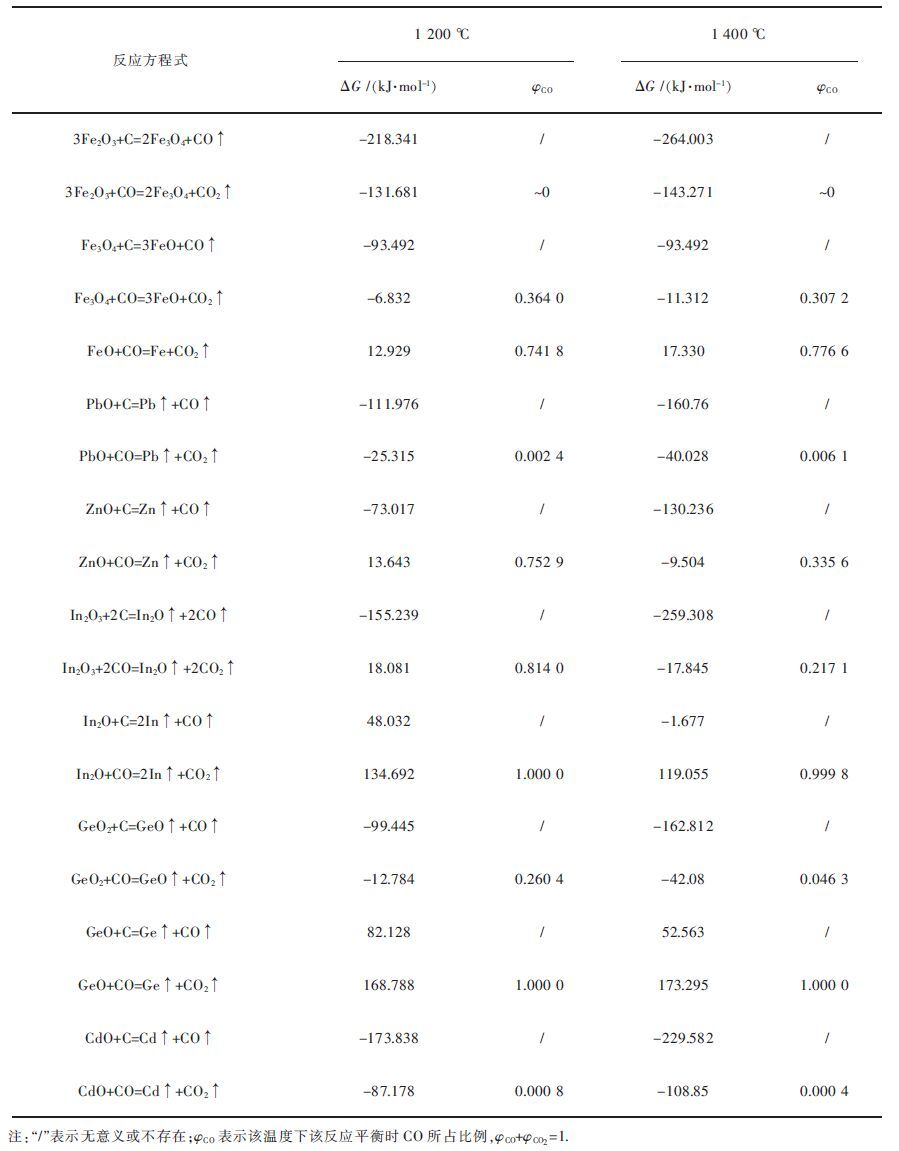
PbO、ZnO、In2O3、GeO2、CdO等氧化物首先被还原成金属蒸汽,各金属氧化物还原的反应方程式及吉布斯自由能见表 2. 由表 2可以看出,除In2O、GeO及FeO的还原外,其余反应均可在常压下进行,由于还原过程是耗氧的,炉膛内的气压随着反应的进行而不断降低,形成低压条件,有利于金属氧化物的还原.还原熔炼造渣时一般不希望铁氧化物过还原形成金属铁,因此需要利用钙铁硅三元相图选择合适的渣型,使得熔渣具有良好的流动性、粘度以及稳定性.各金属氧化物碳热还原的顺序为:Fe2O3> CdO> In2O3> PbO> GeO2> Fe3O4> ZnO.
| 表2 金属氧化物还原反应吉布斯自由能 Table 2 Gibbs free energy of reduction of oxides |
 |
| 点击放大 |
3.1 氧化锌碳还原的热力学分析
在FeO-CaO-SiO2-ZnO多元炉渣体系中,锌主要以游离态氧化锌(ZnO)和硅酸锌(2ZnO·SiO2)形态存在,氧化锌还原反应及其反应的布斯自由能如表 3所列,热力学平衡图如图 4所示.
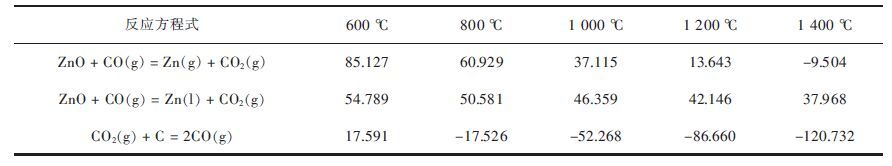
| 表3 氧化锌碳热还原反应及其不同温度下的吉布斯自由能 ΔG /(kJ·mol-1) Table 3 Gibbs free energy date of ZnO during carbonthermal reduction at different temperature /(kJ·mol-1) |
 |
| 点击放大 |
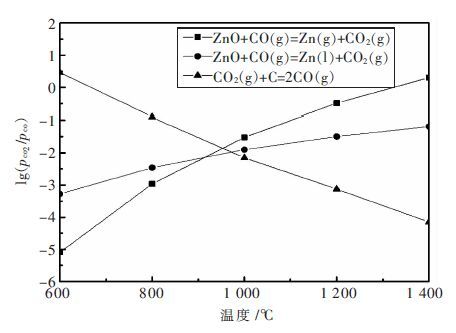 |
| 图 4 ZnO碳热还原热力学平衡图 Fig. 4 Thermodynamic balance diagrams of carbonthermal reduction of ZnO |
从表 3和图 4可以看出,合理地控制CO/CO2气氛,可以促进氧化锌还原反应的发生,在920 ℃以下,锌被氧化,在920~950 ℃以液态存在,高于950 ℃时则以气态存在,并由于锌的挥发而不断促进反应向生成锌的方向进行.
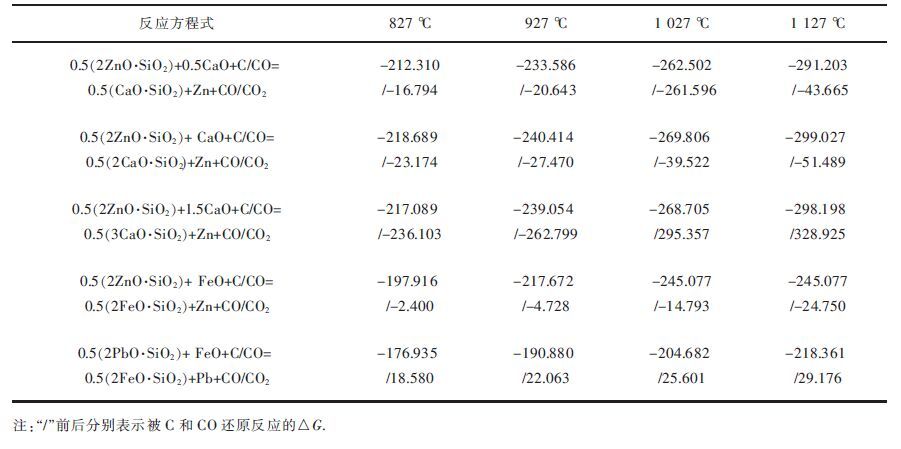
而对于硅酸锌的还原,碱性氧化物FeO和CaO的参与与否决定锌氧化物ZnO、2ZnO·SiO2和ZnO·SiO2的还原次序.FeO和CaO的参与对于硅酸锌的还原反应是有利的.硅酸锌是易熔的化合物,随着炉料在鼓风炉内不断下移,温度逐渐升高,部分造渣成分(FeO、CaO)被熔化或溶解,硅酸锌与FeO和CaO有了良好的接触机会,它们可与上升气流中的CO进行还原反应,或者在穿过焦炭层的时候进行还原反应,硅酸锌在熔炼过程中可能发生的还原反应及其反应的吉布斯自由能如表 4所列.
| 表4 硅酸锌还原反应的吉布斯自由能 ΔG /(kJ·mol-1) Table 4 Gibbs free energy of reduction of zinc silicate /(kJ·mol-1) |
 |
| 点击放大 |
3.2 氧化铅碳还原的热力学分析
在FeO-CaO-SiO2-ZnO多元炉渣体系中,铅主要以游离态氧化铅(PbO)和硅酸锌(PbO·SiO2、2PbO·SiO2)形态存在. 氧化铅发生的反应及其吉布斯自由能如表 5所列,热力学平衡图如图 5所示.
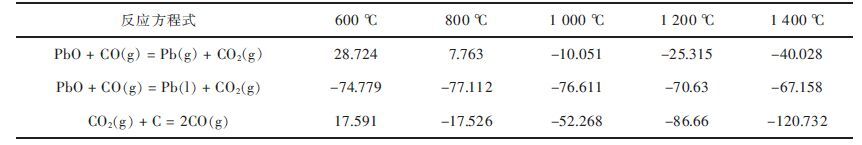
| 表5 氧化铅碳还原热力学数据 Table 5 Thermodynamic data of PbO carbonthermal reduction |
 |
| 点击放大 |
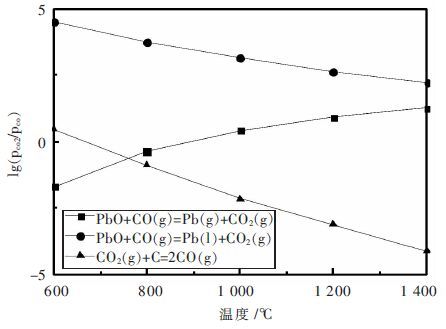 |
| 图 5 氧化铅碳还原热力学平衡关系 Fig. 5 Thermodynamic balance diagrams of carbonthermal reduction of PbO |
从表 5和图 5可以看出,合理地控制CO/CO2气氛,可以促进氧化铅还原反应的发生,在760 ℃以下,氧化铅较稳定,高于760 ℃时则以铅蒸汽存在,并由于铅的挥发而不断促进反应向生成铅的方向进行. 氧化铅还原所需的CO浓度不大,在低于1000 ℃下仅为万分之几,而在高于1 000 ℃时,CO的浓度仅为3 %~5 %,不管是固体氧化铅还是液体氧化铅都是易还原的氧化物,由于上述反应是放热反应,所以温度越高,还原所需的CO浓度也越大.氧化铅直接被C还原的反应为吸热反应,在400~500 ℃时已较为显著,高于700 ℃时则强烈进行.
在没有碱性氧化物FeO和CaO参与的情况下,铅氧化物被还原的顺序依次为PbO、2PbO·SiO2和PbO·SiO2. 但在有碱性氧化物存在的情况下,还原的难易程度发生变化,如CaO存在时,最易还原的是PbO·SiO2和PbO;FeO存在时,最易还原的是PbO·SiO2,其次是PbO和2PbO·SiO2.
硅酸铅的直接还原或间接还原,如果没有碱性氧化物参与是很困难的,甚至是不可能的,因此要使硅酸铅还原反应顺利进行,需要FeO和CaO的参与,这种反应在炉料没熔化之前进行得很缓慢,而在炉料熔化后为主要发生反应的时期.硅酸铅是易熔的化合物,随着炉料在鼓风炉内不断下移,温度逐渐升高,部分造渣成分(FeO、CaO)被熔化或溶解,硅酸铅与FeO和CaO有了良好的接触机会,它们可与上升气流中的CO进行还原反应,或者在穿过焦炭层的时候进行还原反应,具体发生的反应及其反应的吉布斯自由能如表 6所列.
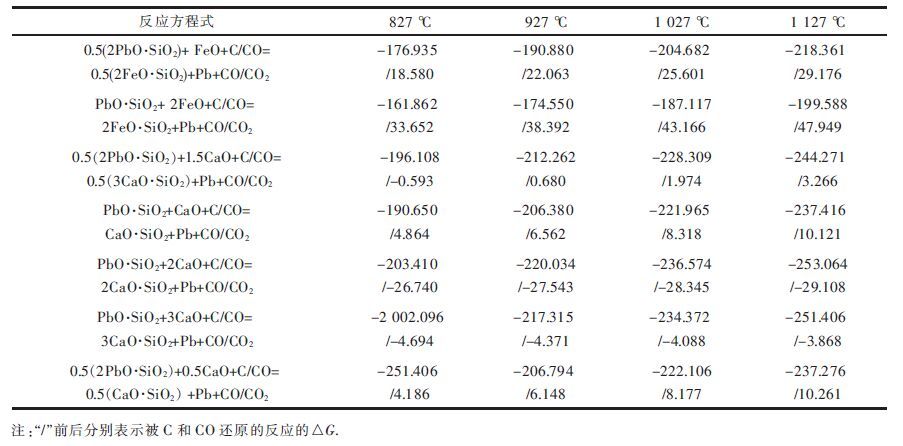
| 表6 硅酸铅还原反应的吉布斯自由能 ΔG /(kJ·mol-1) Table 6 Gibbs free energy of lead silicate reduction /(kJ·mol-1) |
 |
| 点击放大 |
4 金属的氧化
金属铅、锌、镉、铟、锗蒸汽在烟化炉上部空间和表冷管里被三次风口吸入的空气重新氧化成氧化物,最终以烟尘的形式得以回收,具体反应及其反应的吉布斯自由能如表 7和图 6所示.
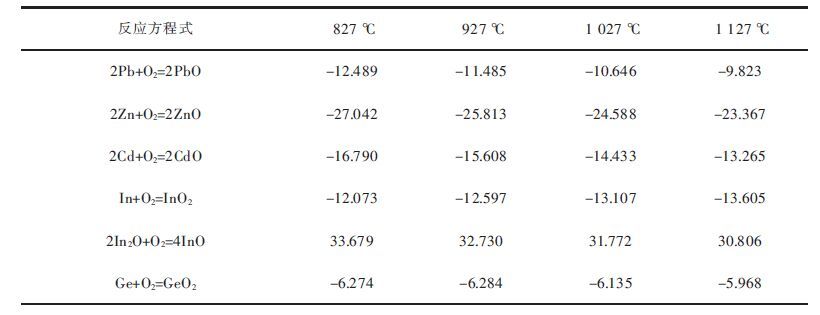
| 表7 金属氧化反应的吉布斯自由能 ΔG /(kJ·mol-1) Table 7 Gibbs free energy of metals oxidation /(kJ·mol-1) |
 |
| 点击放大 |
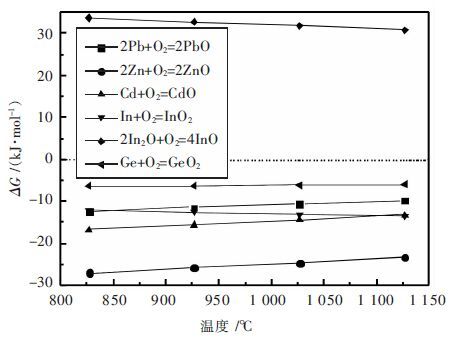 |
| 图 6 金属氧化热力学平衡关系 Fig. 6 Thermodynamic balance diagrams of metals oxidation |
从表 7和图 6可以看出,铅、锌、镉、铟、锗都能在常压、1 100~1 400 K、氧化性气氛下以低价气态氧化物的形式存在,说明在烟化反应温度下,各金属氧化物均能稳定存在并在烟化炉炉膛上部金属蒸气遇空气氧化生成氧化物,随后在收尘系统中得以回收,各金属的氧化顺序为:Zn>Cd>In>Pb>Ge,其中827 ℃时Pb比In更易氧化.
5 熔渣的表征在熔炼温度1 280 ℃,保温时间180 min,焦粉用量为原料的5 %,铁硅比1.6,钙硅比0.5的试验条件下,重复进行3次试验.并对试验所得熔渣进行成分分析、XRD及SEM-EDS表征,结果如表 8、图 7~图 9所示.
| 表8 熔渣化学成分分析结果 /% Table 8 Chemical analysis result of slag /% |
 |
| 点击放大 |
 |
| 图 7 熔渣XRD谱 Fig. 7 XRD patterns of slag |
 |
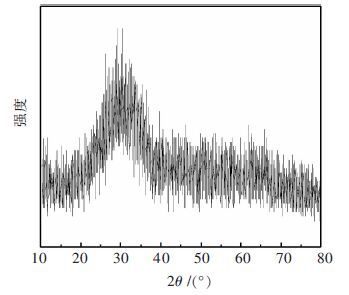
| 图 8 熔渣SEM像 Fig. 8 SEM images of slag |
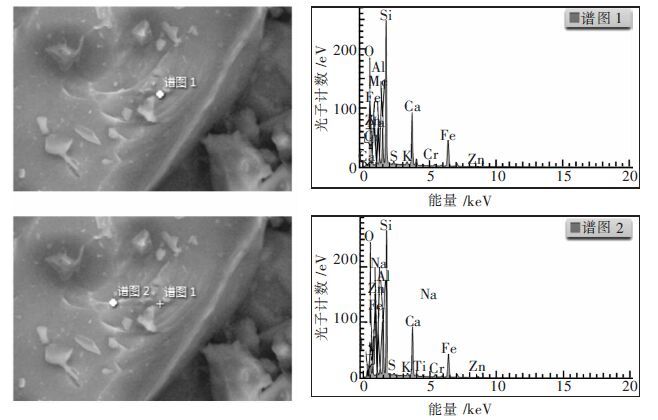 |
| 图 9 熔渣SEM-EDS分析 Fig. 9 SEM-EDS analysis of slag |
与原料相比,铅的挥发率高达99 %,锌的挥发率高达96 %,说明烟化处理针铁矿渣可有效回收铅、锌等易挥发的有价金属,同时实现熔渣的无害化处理.图 7所示XRD检测所得峰图成弥散状,正是符合急冷(水淬)玻璃体的特征从图 8中可以看出,熔渣微观形貌与铅还原渣相似,棱角分明,说明其结构稳定,同时由于水淬骤冷,有类台阶纹,从图 9可以看出,所取两点处成分基本一致,元素分析的结果也表明熔渣主要为钙铁硅氧化物.
6 结 论1)锌浸出渣的主要成分为铁酸锌(ZnFe2O4)、Fe3O4及Fe2.95Si0.05O4,而针铁矿渣中Fe主要以FeOOH、Fe2O3·xH2O、(H3O)2Fe6(SO4)4(OH)12、Fe2O3·0.64H2O·0.2SO3、Fe2(SO4)3等形式存在于渣中;Zn主要是以ZnSO4形式存在于渣中,此外还有少量没有反应的ZnO和ZnS;Pb主要以PbSO4、PbFe6(SO4)4(OH)12形式存在于渣中.
2)熔池熔炼中温度达到1 043 ℃以上可使针铁矿渣中的主要金属硫酸盐:FeSO4、Fe2(SO4)3、ZnSO4、PbSO4均能够较好地分解脱硫.
3)除InO2和GeO的还原外,其余还原反应均可在常压下进行,各金属氧化物碳热还原的顺序为:Fe2O3> CdO> In2O3> PbO> GeO2> Fe3O4> ZnO.利用钙铁硅三元相图选择合适的渣型,可以使得熔渣具有良好的流动性、粘度以及稳定性.
4)铅、锌、镉、铟、锗都能在常压、1 100~1 400 K、氧化性气氛下以低价气态氧化物的形式存在,各金属的氧化顺序为:Zn>Cd>In>Pb>Ge,其中1 100 K时Pb比In更易氧化,说明在烟化炉炉膛上部金属蒸气遇空气氧化生成氧化物,随后在收尘系统中得以回收.
5)经烟化处理针铁矿渣后,熔渣为钙铁硅氧化物,铅的挥发率高达99 %,锌的挥发率高达96 %,同时实现熔渣的无害化处理.熔渣微观形貌棱角分明,结构稳定,骤冷后产生类台阶纹.
| [1] | 高宝军.锌冶炼技术现状及发展探讨[J]. 中国有色冶金,2008 (3):12–17. |
| [2] | 彭容秋. 锌冶金[M]. 长沙: 中南大学出版社 , 2010 . |
| [3] |
TURAN M D, ALTUNDOGAN H S, TUMEN F. Recovery of zinc and lead from zinc plant residue[J].
Hydrometallurgy, 2004,75 :169–176. DOI: 10.1016/j.hydromet.2004.07.008. |
| [4] |
RAGHAVAN R, MOHANAN P K, PATNAIK S C. Innovative processing technique to produce zinc concentrate from zinc leach residue with simultaneous recovery of lead and silver[J].
Hydrometallurgy, 1998,48 :225–237. DOI: 10.1016/S0304-386X(97)00082-0. |
| [5] | 刘燕庭, 阎丽, 黄春林, 等.锌浸出渣中有价元素综合回收技术研究进展[J]. 湖南有色金属,2014,30 (6):44–48. |
| [6] |
ABDEL-AAL E A. Kinetics of sulfuric acid leaching of low-grade zinc silicate ore[J].
Hydrometallurgy, 2000,55 :247–254. DOI: 10.1016/S0304-386X(00)00059-1. |
| [7] |
MIN X B, XIE X D, CHAI L Y, et al. Environmental availability and ecological risk assessment of heavy metals in zinc leaching residue[J].
Transactions of Nonferrous Metals Society of China, 2013,23 (1):208–218. DOI: 10.1016/S1003-6326(13)62448-6. |
| [8] | 姜涛. 湿法炼锌浸出渣铅、锌、锗、铟回收组合工艺研究[D]. 成都:西南交通大学, 2006. http://cdmd.cnki.com.cn/article/cdmd-10613-1012390975.htm |
| [9] | 刘红萍.锌浸出渣处理工艺概述[J]. 云南冶金,2009,38 (4):34–41. |
| [10] | 吴远桂, 谈定生, 丁伟中, 等.针铁矿法除铁及其在湿法冶金中的应用[J]. 湿法冶金,2014,33 (2):86–89. |
| [11] | 张成松, 赵婷.赤铁矿除铁法在湿法炼锌工艺中的应用[J]. 湖南有色金属,2014,30 (2):39–41. |
| [12] | 梅毅.回转挥发窑在锌浸出渣处理中的应用[J]. 有色金属设计,2003,增1 :113–119. |
| [13] | 蒋荣生, 柴立元, 贾著红, 等.烟化法处理铅锌冶炼渣的生产实践与探讨[J]. 云南冶金,2014,43 (1):58–61. |
| [14] | 杨淑霞.韩国温山锌冶炼厂利用奥斯麦特技术处理锌渣情况介绍[J]. 有色冶金设计与研究,2001,22 (1):18–24. |
| [15] |
ASOKAN P, SAXENA M, ASOLEKER S R. Hazardous jarosite use in developing non-hazardous product for engineering application[J].
Journal Hazardous Materials, 2006,137 (3):1589–1599. DOI: 10.1016/j.jhazmat.2006.04.054. |
| [16] |
ASOKAN P, SAXENA M, ASOLEKER S R. Jarosite characterist-ics and its utilization potentials[J].
Science of Total Environment, 2006,359 (2):232–243. |
| [17] | WINTERS J, VOS L. CANOO C. Goethite: from residue to secondary building material-Union Miniere's Graveliet process[C]//Proceedings of the TMS Fall Extraction and Processing Confer-ence, 2000, 903-915. |
| [18] |
MIRA R, IVANA O, SVETOZAR M. The synthesis and microstru-cture of goethite particles precipitated in highly alkaline media[J].
Journal of Alloys and Compounds, 2013,559 :49–56. DOI: 10.1016/j.jallcom.2013.01.027. |
| [19] |
TEPLOV O A, KORENOVSKII N L, LAINER Y A. Thermogravi-metric study of the dehydration and reduction of red mud[J].
Russian Metallungy, 2015 (1):12–18. |
| [20] |
MIHONE K M, CILKO M, LIDIJA C, et al. Investigation of thermal decomposition of jarosite tailing waste: A prerequisite for compr-ehensive jarosite reuse and waste minimization[J].
Journal of The-rmal Analysis and Calorimetry, 2015,123 :421–430. |
| [21] | 刘群, 谭军, 刘常青, 等.熔池熔炼中金属硫酸盐分解过程的热力学研究[J]. 中国有色金属学报,2014,24 (6):1629–1636. |
| [22] | LLYUSHECHKIN A Y, ROBERTS D. Slagging behaviour of Australian brown coals and implications for their use in gasification technologies[J/OL]. Fuel Processing Technology, 2015-01-1-10. DOI:10.1016/j.fuproc.2015.10.028. |
 2016, Vol. 7
2016, Vol. 7


