| 花状Pt/Bi2WO6微米晶合成、表征及其高可见光催化性能 |
2. 福州大学能源和环境光催化国家重点实验室, 福州, 350002
2. State Key Laboratory of Photocatalysis on Energy and Environment, Fuzhou University, Fuzhou, 350002, PR China
目前人类面临严重的水污染.传统的化工工艺通常难以满足有机污水的处理要求.光催化剂在污水处理等方面有着广泛的应用前景.光催化技术在水处理中具有节能、无二次污染并且工艺较简单等优点[1-3].另外,光催化对不同的有机污染物都具有很强的降解矿化能力,因此是一种绿色环保方法[4-5].
TiO2因其氧化能力强、化学性能稳定、成本低[6]已被广泛用于光催化降解有机污染物.然而,TiO2的一个主要缺点是带隙能过大(3.2 eV),需要用波长短于400 nm的紫外光激发,而难于运用太阳光中大部分的可见光.Bi2WO6具有合适的带隙能(约为 2.6 eV),能吸收可见光[12],可作为有效的可见光催化剂.例如,Chen等[7]采用模拟太阳光,发现Bi2WO6对水体中的抗生素诺氟沙星能进行有效的降解.为了提高Bi2WO6光催化性能,可以在Bi2WO6中进行非金属掺杂[8]、贵金属沉积[9]、半导体耦合等[10]等.在半导体上沉积贵金属纳米粒子(NPs)能很大的提高光催化性能.如Pt/ZnO多孔纳米笼、Pt/WO3纳米片[11]、Ag/TiO2-B纳米四方形[12]、Ag/BiOBr[13]等.沉积的贵金属纳米粒子可以作为电子陷阱促进电子-空穴的分离和降低的e-/h+的复合率.
催化剂的光催化性能的在很大程度上取决于它们的晶体形态和其它微观结构.如Shang等[14]报道了一种Bi2WO6纳米笼,这种Bi2WO6纳米笼具有优异的可见光催化性能.Zhang等[15]发现多孔Bi2WO6薄膜在可见光照射下比无孔膜的光催化活性更高.还有其它一些特殊形貌的Bi2WO6纳米薄片[16]、纳米纤维膜[17]等的报道.超细纳米颗粒在水溶液中通常面临容易集聚和催化剂难回收的问题.如果将纳米颗粒单元组装成三维微米晶,那么形成的微米晶通常将具有大比表面积、易沉降分离的特点[18-19].例如,我们合成的多级PbWO4微米球[18]和空心Pt-ZnO微球[19],在水溶液中进行循环光催化反应中具有高稳定性和催化活性.
本研究利用水热法首先合成了花状Bi2WO6微米晶.然后,通过光化学沉积法将不同浓度的Pt纳米粒子负载在微米晶上.研究了Pt沉积对提高光催化性能的机理.结果表明,这些制备的花状Pt/Bi2WO6复合微米晶具有很高的可见光催化活性和易于回收利用的特点.
1 实验 1.1 花状Pt/Bi2WO6复合微晶的制备通过水热合成首先制备Bi2WO6微米晶.将50 mmol Bi(NO3)3•5H2O和25 mmol Na2WO4•5H2O分别溶解在40 mL去离子水中.搅拌5 min后,将Na2WO4•5H2O溶液逐滴加入到Bi(NO3)3•5H2O溶液中.然后将0.5g的十二烷基苯磺酸钠加入到上述溶液中.搅拌30 min后,将所制备的溶液放置在一个100 mL的聚四氟乙烯高压釜中.将高压釜放在马夫炉中于160℃保温24 h,然后在空气中冷却到室温.收集所产生的黄色沉淀物并用去离子水冲洗,于80℃干燥6 h.得到Bi2WO6微米晶.
制备Pt/Bi2WO6.将1 g Bi2WO6和适量的PtCl4加入到40 mL水溶液中,进行超声分散后置于100 mL的Pryrex瓶中.加入过量甲醇作为空穴清除剂,协助Pt4+还原.搅拌悬浮液,用365 nm的紫外灯照射6 h后,将颗粒通过离心分离并用去离子水清洗,然后在80℃下真空干燥8 h,得到Pt/Bi2WO6催化剂.负载x(质量分数%)的Pt被表示为(x %)Pt/Bi2WO6.通过X射线荧光分析法(MAGIX 601)测定Bi2WO6中Pt的最终含量.所用的化学药品均为上海化学公司所提供的分析纯试剂.
1.2 表征样品的比表面积在Micromeritics(ASAP 2010)比表面积仪上测定.样品的X-射线粉末衍射(XRD)在Bruker D8-advance X射线衍射仪上获得,管电压为40 kV,管电流为40 mA,入射光为Cu Kα(K=1.5418
用300 W卤钨灯作为可见光源,用滤光片将波长 < 420 nm的光滤掉.将0.05 g催化剂悬浮在100 mL浓度为0.020 g / L的酸性橙II水溶液中.在光照前,为了达到物理吸附/脱附平衡,将悬浮液在黑暗中磁力搅拌40 min.在反应过程中,悬浮液的温度通过外部冷却使反应体系温度保持在22℃.在给定的光照时间内,取出约2 mL悬浮液进行离心.利用Milton Roy Spectronic 3000 Array型分光光度计对上层清液中的染料浓度进行测定.
2 结果与讨论 2.1 晶体结构分析样品的XRD谱如图 1所示.可以看出合成的Pt/Bi2WO6复合样品的XRD衍射图与纯Bi2WO6的很相似.在28.3°、32.8°、47.2°和55.8°处表现出强的衍射峰.这些衍射峰对应的是正交晶系的Bi2WO6 [空间群:B2ab/41].计算出的Bi2WO6的晶格常数(a=0.5456 nm,b=0.5440 nm,c=1.6441 nm)与文献数据基本一致(a=0.5457 nm,b=0.5436 nm,c=1.6427 nm,JCPDS 73-1126)[20].另外,在(113)处的衍射峰的标准强度约为(200)处峰的5倍,可以表示为I(113)/I(200)=5.然而,在这一系列样品中,I(113)/I(200)的值小于2,这意味着这些Bi2WO6晶体沿(001)晶面显示特殊的各向异性生长[21].在Pt/Bi2WO6上观察不到任何Pt的衍射峰,这可能是由于Pt的晶粒尺寸较小或沉积Pt纳米颗粒的浓度低的缘故.
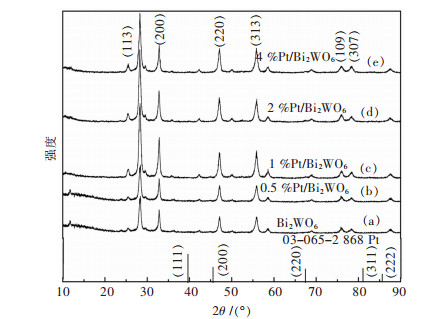 |
| 图 1 Bi2WO6和Pt/Bi2WO6样品的XRD谱 Fig. 1 XRD patterns of Bi2WO6 and Pt/Bi2WO6samples |
制备样品的比表面积见表 1.可见所有样品的比表面积都比较大(23.6~28.8 m2·g-1).Pt纳米粒子的存在对光催化剂的比表面积影响不大.沉积0.5 %~2 %的Pt纳米颗粒仅对比表面积有一个小的提高.Pt浓度的进一步增加导致在比表面积略有下降.可能是由于在Bi2WO6中,沉积高浓度的Pt纳米粒子可能堵塞Bi2WO6微米花的孔道,造成比表面积减少.
| 表1 光催化剂的比表面积 Table 1 Surface areas of the photocatalys |
 |
| 点击放大 |
2.2 扫描电镜与透射电镜分析
首先用扫描电镜对所制备样品的形貌进行了分析,结果如图 2(a) 所示.在低放大倍数的扫描电镜图像中,可以清楚地观察到花状结构微米颗粒.图 2(b) 则进一步表明,花状微米颗粒是由许多二维纳米四方体组装而成的.花状的Bi2WO6微米球颗粒的直径大约是1.5~2 μm.利用透射电镜对Bi2WO6和1%Pt /Bi2WO6样品的具体形貌做进一步分析.图 3(a) 是Bi2WO6的透射电镜照片.可以看到Bi2WO6纳米粒子为50~100 nm纳米四方或长方体.Bi2WO6四方纳米粒子的表面非常光滑.图 3(b)是1%Pt/Bi2WO6的扫描电镜照片.在四方Bi2WO6光滑的表面上可以清楚地观察到一些沉积球形的纳米颗粒.通过能谱分析可以确定这些小的球形纳米颗粒为Pt纳米粒子.Pt纳米粒子的大小估计为3~5 nm.
 |
| 图 2 Bi2WO6样品SEM像 Fig. 2 SEM images of Bi2WO6 sample |
 |
| 图 3 样品TEM像 Fig. 3 TEM images of Bi2WO6 and 1%Pt/Bi2WO6 samples |
图 4所示为1%Pt/Bi2WO6样品的能谱分析显示图.能明显地观察到4个元素(O, W, Bi, Pt), 这进一步证实了Pt纳米粒子成功地沉积在了Bi2WO6纳米体的表面.
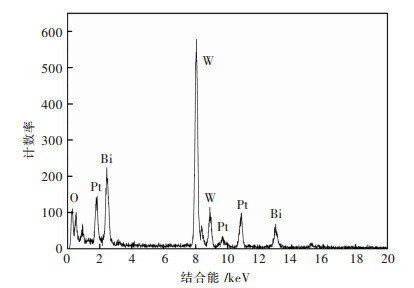 |
| 图 4 1%的Pt/Bi2WO6样品的能谱分析 Fig. 4 EDX spectrum of the 1%Pt/Bi2WO6 sample |
2.3 紫外-可见漫反射光谱
图 5展示了纯的花状Bi2WO6微米晶和Pt/Bi2WO6复合物的紫外-可见吸收光谱.纯的Bi2WO6的光吸收边在448 nm左右,这表明花状Bi2WO6微米晶对可见光的吸收很弱.Pt纳米颗粒的沉积使吸收边稍微向可见光区域移动.不同的Pt/Bi2WO6样品在485 nm附近几乎表现出相同的吸收边.Pt纳米颗粒诱导的可见光吸收的增强可以归因于Pt纳米颗粒弱的表面等离子体吸附[22, 23].因此,Pt纳米颗粒的存在对光的吸收有明显的影响.
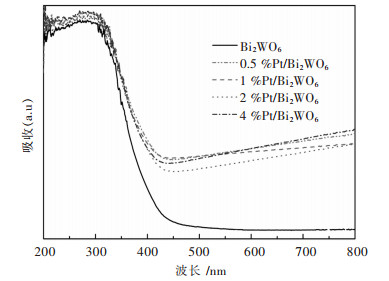 |
| 图 5 Bi2WO6和花状Pt/Bi2WO6微米晶的紫外可见漫反射光谱 Fig. 5 UV-Vis diffuse reflectance spectra of the Bi2WO6 and Pt/Bi2WO6 microflowers |
2.4 红外光谱
通过红外光谱对制备的Bi2WO6和花状Pt/Bi2WO6微米晶的表面性能进行了表征.从图 6中我们可以看到,纯Bi2WO6在400-800 cm-1处显示出一吸收带.该吸收带是由于Bi-O,W-O的拉伸和W-O-W的桥接伸缩模式[24]造成的.而位于813 cm-1的吸收带属于Bi-O;位于731 cm-1的吸收带属于W-O-W.另外两个在3430 cm-1和1630 cm-1突出的吸收峰分别属于表面OH基团和吸附水分子的拉伸和弯曲振动.可见,Pt纳米颗粒的沉积对OH基团的峰强度有明显的影响.沉积Pt纳米颗粒后观察到了表面OH基团的强吸收峰,这表明更多的表面OH存在在花状Pt/Bi2WO6微米晶上.在光催化过程中,表面OH可以与光生空穴(H+)发生反应,产生分解有机分子的主要基团-·OH自由基.
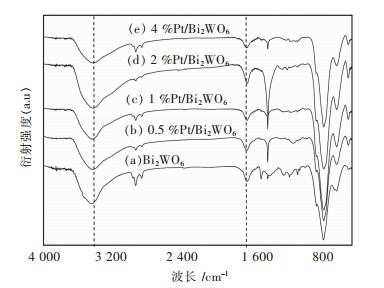 |
| 图 6 Bi2WO6和花状Pt/Bi2WO6微米晶的红外光谱 Fig. 6 IR spectra of the Bi2WO6 and Pt/Bi2WO6 microflowers |
2.5 XPS分析
利用XPS技术分析1%Pt/Bi2WO6中元素的化学状态.图 7是O 1s,Bi 4f, Pt 4f,和W 4f的高分辨XPS谱.从图 7(a)可以看出O 1s区可分别分为529.5和531.5 eV处的2个峰.529.5eV处的小峰是属于样品的表面羟基中的O.在531.5 eV处的主峰属于Bi2WO6的晶格O2-.图 7中Bi的4f谱分为2个峰.结合能为158.4和163.7 eV处的峰分别属于Bi2WO6的BI 4f7/2和Bi 4f5/2区.Bi的主要化学态为+3价[25].Pt 4f的高分辨率XPS谱如图 7(c)所示.74.76和71.46 eV处的结合能分别对应于Pt的4f5/2和PT 4f7/2.结合能的数据表明,Pt的价态是Pt(0)[26].W的4f的38.02 eV结合能对应于W 4f5/2而34.61 eV对应于W 4f7/2,这与文献[27]中的报道一致.
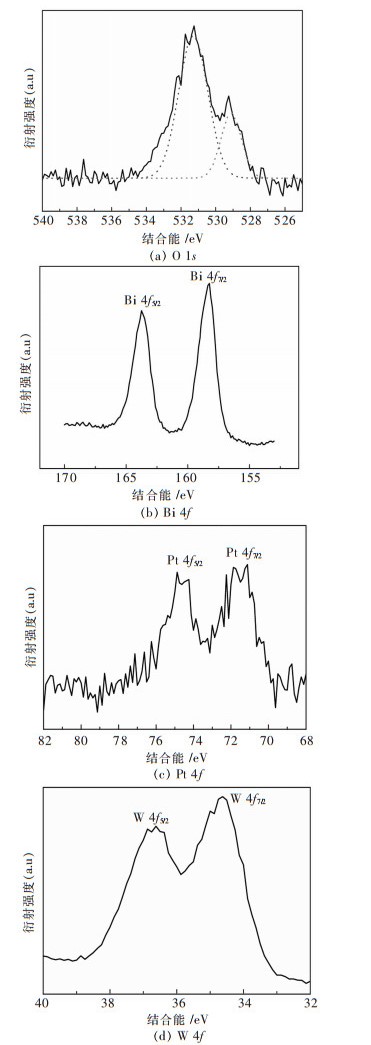 |
| 图 7 1% Pt/ Bi2WO6样品的高分辨率XPS谱 Fig. 7 High resolution XPS spectra 1%Pt/Bi2WO6 sample |
2.6 光催化性能
在可见光照射下(λ > 420 nm),对制备的Bi2WO6和Pt/Bi2WO6微米晶的光催化活性通过降解染料酸性橙II来评价.图 8(a)显示的是花状Pt(1%)/ Bi2WO6复合微米晶降解酸性橙II的过程中染料吸收光谱随时间的变化情况.图 8(b)的空白试验表明酸性橙Ⅱ是一种稳定的分子,其光解可以忽略.样品在可见光下的降解酸性橙Ⅱ是一种光催化反应过程.图 8(c)显示,沉积Pt纳米粒子使降解酸性橙II的光催化活性有很大提高.此外,光催化活性的增强效果与Pt的浓度有关.沉积1~4%的Pt纳米颗粒对活性的增加几乎相同,这表明,进一步增加Pt纳米粒子是不必要的.在这里,我们定义了D=(C0-C)/C0(D:降解率,C0:酸性橙II的初始浓度).可见光照射5小时后,Bi2WO6、0.5%Pt/ Bi2WO6、1%Pt/Bi2WO6、2%Pt/Bi2WO6和4%的Pt/Bi2WO6的D值分别是31.9%、68.2%、89.5%、86.9%和89.1%.最佳负载量为1 wt% Pt的纳米颗粒将活性增加了约2.8倍.另外,这种花状1%Pt/Bi2WO6复合微米晶的另一个优势是在循环反应中易于回收.在循环使用过程中,1%的Pt/Bi2WO6复合微米晶对酸性橙II的降解率如图 8(d)所示.我们发现,1%的Pt/Bi2WO6微米晶的活性随着循环次数的增加仅略有下降,这表明微米晶在水溶液中有良好的稳定性.高稳定性和易回收有利于在降解有机水污染物中的实际应用.
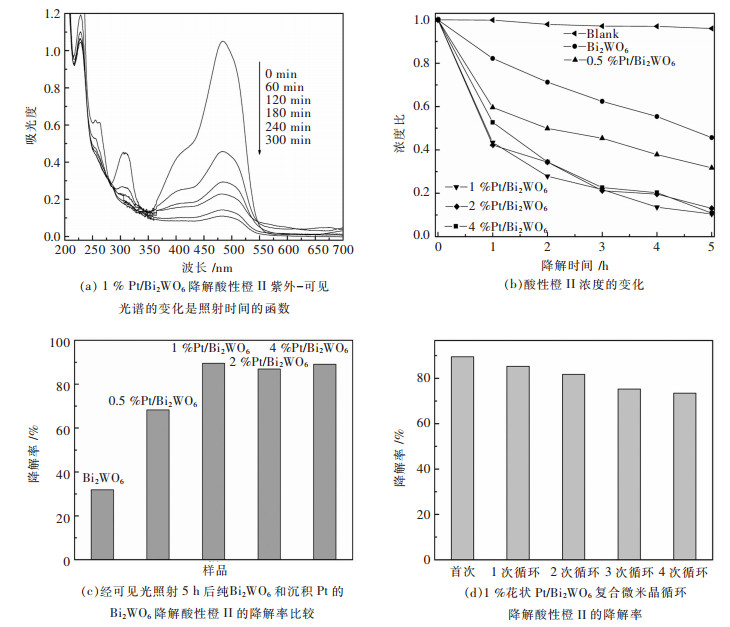 |
| 图 8 Bi2WO6和花状Pt/Bi2WO6复合微米今后对酸性橙II的降解性能 Fig. 8 Performance of Bi2WO6 and Pt/Bi2WO6 composite microflowers in degradation of the acid orange II |
2.7 光催化活性增强的机理
根据相关文献[28, 29]同时结合我们的实验数据,提出光催化增强机理如下:首先,这种三维多级Bi2WO6微米晶对酸性橙II具有很好的吸附作用和对光的吸收性能.当Bi2WO6吸收可见光,Bi2WO6价带的电子(e-)受到激发跃迁到导带,空穴(h+)留在价带.沉积的Pt纳米粒子可以作为电子陷阱捕获光生电子,促进e-和h+的分离.其次,Pt纳米粒子进一步将被捕获的电子传递给Bi2WO6表面吸附的O2.O2可以与电子反应,产生·O2-自由基.所产生的·O2-可以有效地氧化酸性橙Ⅱ.另一方面,·OH和光生空穴也能有效地分解有机化合物,产生最终产物(CO2,H2O等等).花状Pt/Bi2WO6复合微米晶的光催化降解机理的如图 9所示.
 |
| 图 9 花状Pt/Bi2WO6复合微米晶的光催化降解机理 Fig. 9 Photocatalytic degradation mechanism of the Pt/Bi2WO6 composite microflowers |
3 结论
在水热条件下,合成并将Bi2WO6纳米块组装成1.5~2 μm的花状Bi2WO6微米晶,然后经过光化学沉积法沉积Pt纳米粒子.沉积的Pt纳米粒子可以促进催化剂对可见光的吸收,并且可以作为电子陷阱降低e-与h+的复合率,从而使Pt/Bi2WO6复合微米晶具有很高的可见光催化活性.在可见光照射下(λ>420 nm),这些Pt/Bi2WO6复合微米晶在降解酸性橙Ⅱ时表现出高活性和稳定性.另外,这种Pt/Bi2WO6复合微米晶的多级结构有利于催化剂的分离回收使用.
| [1] | 魏龙福, 余长林.石墨烯/半导体复合光催化剂的研究进展[J]. 有色金属科学与工程,2013,4 (4):34–39. |
| [2] | 余长林, 操芳芳, 李鑫, 等.纳米BiOI的稳定性、结构及光催化性能研究[J]. 有色金属科学与工程,2011,2 (4):86–91. |
| [3] | 李鑫, 余长林, 樊启哲, 等.溶剂热制备球状ZnS纳米光催化剂及其光催化性能[J]. 有色金属科学与工程,2012,3 (3):21–26. |
| [4] |
Amano F, Ishinaga E, Yamakata A. Effect of Particle Size on the Photocatalytic Activity of WO3 Particles for Water Oxidation[J].
Journal of Physical Chemistry C, 2013,117 (44):22584–22590. DOI: 10.1021/jp408446u. |
| [5] |
ZHOU W, YU CL, Fan Q, et al. Ultrasonic fabrication of N-doped TiO2 nanocrystals with mesoporous structure and enhanced visible light photocatalytic activity[J].
Chinese Journal of Catalysis, 2013,6 (6):1250–1255. |
| [6] |
OllIS D, PICHAT P, SERPONE N. TiO2 photocatalysis-25 years[J].
Applied Catalysis B Environmental, 2010,99 (3):377. |
| [7] |
CHEN M, WEI C. Efficient Degradation of an Antibiotic Norfloxacin in Aqueous Solution via a Simulated Solar-Light-Mediated Bi2WO6 Process[J].
Industrial & Engineering Chemistry Research, 2012,51 (13):4887–4893. |
| [8] |
SUN S, WANG W, ZHANG L. Bi2WO6 Quantum Dots Decorated Reduced Graphene Oxide: Improved Charge Separation and Enhanced Photoconversion Efficiency[J].
Journal of Physical Chemistry C, 2013,117 (18):9113–9120. DOI: 10.1021/jp4004592. |
| [9] |
ZHANG Z, WANG W, GAO E, et al. Photocatalysis Coupled with Thermal Effect Induced by SPR on Ag-Loaded Bi2WO6 with Enhanced Photocatalytic Activity[J].
Journal of Physical Chemistry C, 2012,116 (49):25898–25903. DOI: 10.1021/jp309719q. |
| [10] |
BHATTACHARYA C, LEE H C, Bard A J. Rapid Screening by Scanning Electrochemical Microscopy (SECM) of Dopants for Bi2WO6 Improved Photocatalytic Water Oxidation with Zn Doping[J].
J. Phys. Chem. C, 2013,117 (19):9633–9640. DOI: 10.1021/jp308629q. |
| [11] |
XU J, WANG W, SUN S, et al. Enhancing visible-light-induced photocatalytic activity by coupling with wide-band-gap semiconductor: A case study on Bi 2WO6/TiO2[J].
Applied Catalysis B Environmental, 2012,111 (2):126–132. |
| [12] |
ZHANG G, GUAN W, SHEN H, et al. Organic Additives-Free Hydrothermal Synthesis and Visible-Light-Driven Photodegradation of Tetracycline of WO3 Nanosheets[J].
Industrial & Engineering Chemistry Research, 2014,53 (13):5443–5450. |
| [13] |
YU C, WEI L, LI X, et al. Synthesis and characterization of Ag/TiO2-B nanosquares with high photocatalytic activity under visible light irradiation[J].
Materials Science & Engineering B, 2013,178 (6):344–348. |
| [14] |
YU C, FAN C, MENG X, et al. A novel Ag/BiOBr nanoplate catalyst with high photocatalytic activity in the decomposition of dyes[J].
Reaction Kinetics Mechanisms & Catalysis, 2011,103 (1):141–151. |
| [15] |
ZHANG L, WANG Y, CHENG H, et al. ChemInform Abstract: Synthesis of Porous Bi2WO6 Thin Films as Efficient Visible-Light-Active Photocatalysts[J].
Cheminform, 2009,40 (23):1286–1290. |
| [16] |
YANG C, HUANG Y, LI T, et al. ChemInform Abstract: Bi2WO6 Nanosheets Synthesized by a Hydrothermal Method: Photocatalytic Activity Driven by Visible Light and the Superhydrophobic Property with Water Adhesion[J].
European Journal of Inorganic Chemistry, 2015,46 :2560–2564. |
| [17] |
ZHAO G, LIU S, LU Q, et al. Controllable Synthesis of Bi2WO6 Nanofibrous Mat by Electrospinning and Enhanced Visible Photocatalytic Degradation Performances[J].
Industrial & Engineering Chemistry Research, 2012,51 (31):10307–10312. |
| [18] |
YU C, CAO F, LI X, et al. Hydrothermal synthesis and characterization of novel PbWO4 microspheres with hierarchical nanostructures and enhanced photocatalytic performance in dye degradation[J].
Chemical Engineering Journal, 2013,219 (3):86–95. |
| [19] |
YU C, YANG K, XIE Y, et al. Novel hollow Pt-ZnO nanocomposite microspheres with hierarchical structure and enhanced photocatalytic activity and stability[J].
Nanoscale, 2013,5 (5):2142–2151. DOI: 10.1039/c2nr33595f. |
| [20] |
ZHANG C, ZHU Y. Synthesis of square Bi2WO6 nanoplates as high-activity visible-light-driven photocatalysts[J].
Chemistry of Materials, 2005,17 (13):3537–3545. DOI: 10.1021/cm0501517. |
| [21] |
LI Y, LIU J, HUANG X, et al. Hydrothermal Synthesis of Bi2WO6 Uniform Hierarchical Microspheres[J].
Crystal Growth & Design, 2007,7 (7):1350–1355. |
| [22] |
ZHANG Z, SHAO X, YU H, et al. Morphosynthesis and Ornamentation of 3D Dendritic Nanoarchitectures[J].
Chemistry of Materials, 2004,17 (2). |
| [23] |
CHEN J, Wiley B, Mclellan J, et al. Optical properties of Pd-Ag and Pt-Ag nanoboxes synthesized via galvanic replacement reactions[J].
Nano Letters, 2005,5 (10):2058–2062. DOI: 10.1021/nl051652u. |
| [24] |
YU C, CAO F, GAO L, et al. Novel noble metal (Rh, Pd, Pt)/BiOX(Cl, Br, I) composite photocatalysts with enhanced photocatalytic performance in dye degradation[J].
Separation & Purification Technology, 2013,120 :110–122. |
| [25] |
DHARMADHIKARI V S, SAINKAR S R, BADRINARAYAN S, et al. Characterisation of thin films of bismuth oxide by X-ray photoelectron spectroscopy[J].
Journal of Electron Spectroscopy & Related Phenomena, 1982,25 (2):181–189. |
| [26] |
FLEISCH T H, ZAJAC G W, SCHREINER J O, et al. An XPS study of the UV photoreduction of transition and noble metal oxides[J].
Applied Surface Science, 1986,26 (4):488–497. DOI: 10.1016/0169-4332(86)90120-0. |
| [27] |
ZHAO X, YAO W, WU Y, et al. Fabrication and photoelectrochemical properties of porous ZnWO4 film[J].
Journal of Solid State Chemistry, 2006,179 (8):2562–2570. DOI: 10.1016/j.jssc.2006.05.004. |
| [28] |
ISMAIL A A, BAHNEMANN D W. Mesostructured Pt/TiO2 Nanocomposites as Highly Active Photocatalysts for the Photooxidation of Dichloroacetic Acid[J].
J.phys.chem.c, 2011,115 (13):5784–5791. DOI: 10.1021/jp110959b. |
| [29] |
KNOLL J D, HIGGINS S L H, WHITE T A, et al. Subunit Variation to Uncover Properties of Polyazine-Bridged Ru(II), Pt(II) Supramolecules with Low Lying Charge Separated States Providing Insight into the Functioning as H2O Reduction Photocatalysts to Produce H2[J].
Inorganic Chemistry, 2013,52 (17):9749–9760. DOI: 10.1021/ic4004406. |
 2016, Vol. 7
2016, Vol. 7


