| 镁电解质挥发特性研究 |
目前,电解法是工业上生产金属镁的重要方法[1-2],电解过程是在比金属镁熔点(648 ℃)高的温度下,通过直流电将KCl/CaCl2-NaCl-MgCl2熔盐体系中的 MgCl2电解为金属镁和氯气的过程[3-4].随着电解的进行,部分电解质将随着氯气一起挥发出来,并在氯气管道内沉积,若不能及时清理,将会造成氯气管道堵塞,使得镁-氯副反应增加,引起镁氯损失加剧,造成电流效率下降;若长时间堵塞氯气管道,氯气将会从集镁室中溢出,恶化工作环境的同时带来严重的环境污染.但当前文献研究的主要为镁电解质的密度,黏度,表面张力,初晶温度等参数[5-9],而对镁电解质挥发特性的研究则未见报道,此外,已有的热力学数据差别较大,温度范围也较小且温度很少在工业生产温度区间内,使用非常不便.
物质挥发特性一般用饱和蒸汽压这一指标进行定量表述[10],测定饱和蒸汽压方法较多[11-13],由于镁电解质挥发性相对较小,适合采用恒体积法进行测定,即在一个恒定体积的密封反应釜内放入待测物,之后对体系进行升温,以测定不同温度下,釜内达到平衡时的压力,即该温度下的饱和蒸汽压.通过恒体积法对不同温度和组分的镁电解质挥发特性进行研究,旨在为生产提供指导,研究所用的电解质体系为 KCl-NaCl-MgCl2三元系.
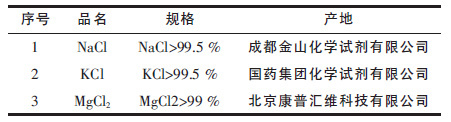
1 试验 1.1 试验原料试验选用的试剂见表 1.
| 表1 试验选用试剂一览 Table 1 Reagents of experiment |
 |
| 点击放大 |
1.2 试验装置和仪器
试验过程的加热装置为硅钼管式电阻炉,反应釜采用的是钢质空心圆柱形,尺寸Φ300 mm×600 mm,壁厚20 mm,考虑到工作温度和蒸汽压力选择了耐高温压力容器用钢OCr18Ni9Ti 钢.釜体工作时使用水冷,密封方式为密封胶圈加真空密封脂,试验过程中对反应釜内的温度和压力进行在线监测并输出.整个装置的示意如图 1.试验装置见表 2.
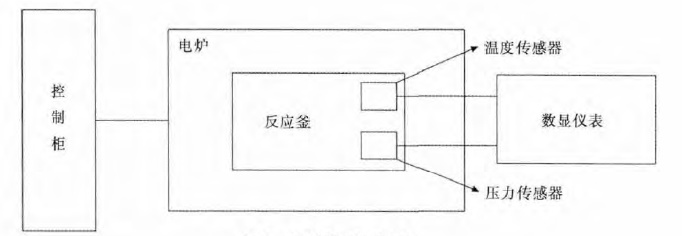 |
| 图 1 试验装置示意图 Fig. 1 Sketch of experimental equipment |
| 表2 试验装置列表 Table 2 List of experimental devices |
 |
| 点击放大 |
1.3 试验步骤
1)试验开始前对温度传感器进行校准,使用标准热电偶对试验用热电偶进行校准,分别选择600 ℃、650 ℃、700 ℃和750 ℃ 4 个温度进行校准,热电偶所测结果与标准热电偶所测结果偏差均小于2 ℃,控温时炉温波动范围小于3 ℃,最后对反应釜的气密性进行检查,保证釜体密封时气密性良好.
2)试验开始前对3 种试验用盐进行真空脱水,在300 ℃条件下,真空脱水4 h.然后将试验用电解质体系配好,以MgCl2质量浓度计分别为0 %,5 %,10 %,15 %,20 %的5 种体系,其中的KCl 与NaCl 的质量比均为3:1,对其进行真空密封存储以备试验使用.
3)取500 g 配好的电解质体系,将其置于反应釜中,对反应釜进行抽真空,考虑到旋叶泵的工作能力和釜体在高温下的耐压强度,抽真空至10 Pa 后停止.然后对反应釜进行升温,升温至650 ℃后保温,观察釜内压力,待压力稳定后记录压力数据,之后分别升温至675 ℃,700 ℃,725 ℃,750 ℃(工业上电解镁的温度处在650~750 ℃温度范围)后进行保温,当压力显示稳定后分别记录不同温度下的饱和蒸汽压,利用相同的方法测定其他电解质体系在650 ℃,675 ℃,700 ℃,725 ℃,750 ℃稳定时的气压值.
4)对预先配好的3 种体系进行热重测试,测定时置于空气气氛中.
2 结果分析 2.1 分析方法在分析相平衡时,广泛使用的是Clausius - Clapeyron[14]关系式:
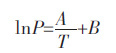
|
该关系式用于描述单组分相平衡问题.本文在研究电解质体系时首先尝试利用单组分模型模拟电解质体系,温度设定为650~750 ℃之间,在评价所建模型描述蒸汽压变化规律准确性时,使用RMSE 和Rsquare值作为评价模型准确性的指标.
RMSE(Root mean squared error)均方根:是指原始数据yi和预测数据$\hat{y}$i对应点误差平方和的均值的平方根:
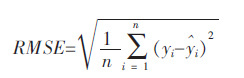
|
该值越接近于0 说明所建模型描述实际值越准确.
R-square 确定系数; 是对预测数据$\hat{y}$ i和原始数据yi以及原始数据平均值yi进行处理得到:
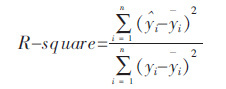
|
确定系数通过数据变化来表征一个数据的好坏,其值越接近于1,说明模型对数据拟合越准确.
2.2 温度的影响将不同组分和不同温度下测定的电解质蒸汽压列于表 3 中,表 3 中压力测定结果已经减去釜内初始残余气体因升温而变化后的压力.
| 表3 不同温度和不同氯化镁浓度下蒸汽压测定值/Pa Table 3 Testing results of vapor pressure of different temperatures and concentration of MgCl2 |
 |
| 点击放大 |
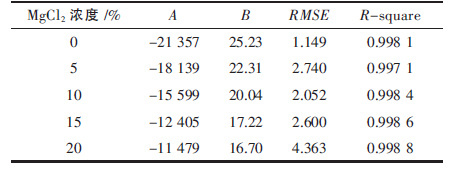
在电解质组分一定的条件下将蒸汽压对温度进 行拟合,所得结果见表 4.
| 表4 蒸汽压对温度拟合结果和准确性评价 Table 4 Accuracy of fitting between vapor pressure and temperatures |
 |
| 点击放大 |
由表 4 可以看出,对温度的拟合结果与试验测定情况基本吻合,误差较小.
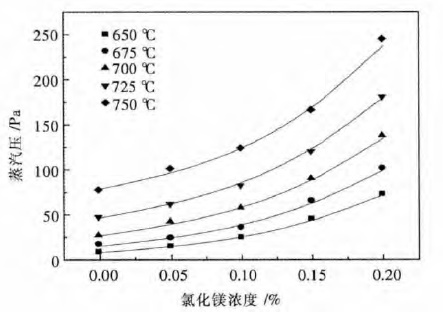
图 2 可以看出体系蒸汽压随温度升高而升高,这是由于温度升高将导致分子所携带的能量提高,更多的电解质分子能够从液相表面逸出进入气相.在温度由650 ℃升温至725 ℃范围内,体系的蒸汽压增加缓慢,但增速在加快,当温度超过725 ℃后,蒸汽压开始随温度的升高而迅速增加,导致电解质体系挥发严重.
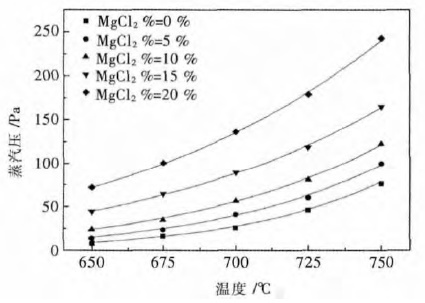 |
| 图 2 不同温度与氯化镁浓度条件下的蒸汽压曲线 Fig. 2 Vapor pressure curves under the conditions of different temperatures and concentration of MgCl2 |
2.3 组分的影响
根据文献[15-16]可知,在KCl-NaCl-MgCl2三元系中,KCl 和NaCl 是完全的离子化合物,蒸汽压较小,且比较稳定,在体系中对蒸汽压影响小,而MgCl2不是完全的离子化合物,其蒸汽压变化较大,对体系的饱和蒸汽压影响也最大,本文主要研究MgCl2对体系蒸汽压的影响规律.
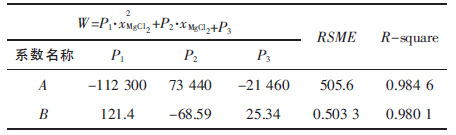
将拟合出的方程中系数A 和B 对电解质中氯化镁含量拟合,拟合模型使用常规多项式方程的形式,经过拟合,多项式中最高项设为2 次较为合适,拟合结果见表 5.
| 表5 系数A 和B 与氯化镁浓度拟合结果 Table 5 Fitting results of A and B versus concentration of MgCl2 |
 |
| 点击放大 |
图 3 可以看出,系数A 随MgCl2浓度的增加而增加,系数B 随浓度增加而减小,结果导致电解质蒸汽压随着氯化镁浓度的增加而增加,主要是由于 MgCl2中只有部分的离子键,其蒸汽压较高.其含量增加后将直接导致体系饱和蒸汽压的增加,当MgCl2浓度超过15 %后,系数A,系数B 随浓度增加变化减慢,结合图 2 可以看出,当氯化镁浓度超过15 %后,蒸汽压增加迅速,导致电解质挥发严重.
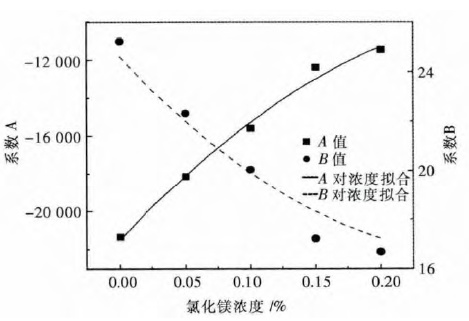 |
| 图 3 系数A 和B 与氯化镁浓度关系曲线 Fig. 3 Relationship between A(&B) and concentration of MgCl2 |
将蒸汽压与温度和组分关系综合后得到的关系如下:
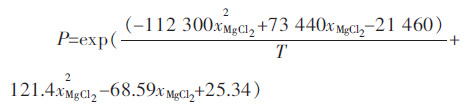
|
其中P 为体系的饱和蒸汽压,Pa,T 为温度,K,xMgCl2为MgCl2的质量浓度.该关系式可用于描述温度在650~750 ℃,W(KCl):W(NaCl)=3:1(质量比)的 KCl -NaCl-MgCl2三元系镁电解质的饱和蒸汽压.将试验测定结果与拟合结果绘于图 4 中,图 4 中连续曲线为拟合结果,曲线旁边的点为实验测定结果.可以看出,拟合结果和测定结果误差很小,试验测定点基本都落在拟合曲线上.
 |
| 图 4 试验测定蒸汽压和拟合值关系 Fig. 4 Relationship between testing results of vapor pressure and fitting results |
2.4 热重分析
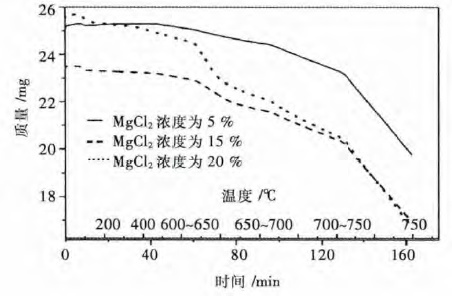
对电解质W(KCl):W(NaCl)=3:1,质量比中氯化镁含量为5 %,15 %,20 %的3 种体系进行热重分析,升温规律如表 6.试验过程不通保护气,所得曲线绘于图 5 中.
| 表6 热重试验升温规律 Table 6 Heating curve of experiment |
 |
| 点击放大 |
 |
| 图 5 不同氯化镁浓度的热重曲线 Fig. 5 TG curves of different concentration of MgCl2 |
图 5 可以看出,在温度超过725 ℃后,电解质失重明显,挥发量变大,当氯化镁浓度超过15 %后,相同条件下失重率明显提高,不同氧化镁浓度下体系的失重率见表 7,实验证明电解质挥发特性与模型预测结果基本一致,说明所建模型对电解质挥发特性描述较为准确.因此,在使用该三元系进行镁电解生产时,体系温度应控制在725 ℃以下,同时电解质中的氯化镁浓度不应超过15 %.
| 表7 不同氯化镁浓度下体系的失重率 Table 7 Weight loss ratio of the system with different concentration of MgCl2 |
 |
| 点击放大 |
3 结论
1)镁电解质饱和蒸汽压随着温度的增加而增加,当温度超过710 ℃后,蒸汽压明显增加,电解质挥发开始严重.
2)电解质饱和蒸汽压随着氯化镁含量的增加而增加,当电解质中氯化镁含量超过15 %后.蒸汽压迅速增加.
3)在650℃到750℃温度范围内,W(KCl):W(NaCl)=3:1(质量比)的镁电解质的电解质体系中饱和蒸汽压与温度和氯化镁组分的关系满足关系式:
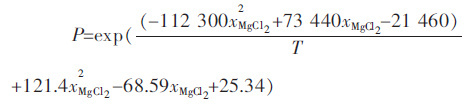
|
| [1] | 韩凤文. 影响镁电解电流效率的因素[J]. 轻金属, 2000(6): 44–45. |
| [2] | 杨宝刚, 于佩志, 李冰, 等. MgO 在氯化镁电解过程中的电泳行为[J]. 轻金属, 2000(10): 43–45. |
| [3] | 赵飞, 陈志远, 陈洪智. 1090 K下MgCl2-KCl-CaCl2三元熔盐体系的密度预测[J]. 有色金属科学与工程, 2014, 5(6): 35–41. |
| [4] | 王龙蛟, 罗洪杰, 王耀武, 等. 熔盐电解法制镁工艺研究进展[J]. 中国有色冶金, 2014, 43(5): 48–52. |
| [5] | Sharma R A1.Method for producing magnesium metal from magnesium oxide: USA, 5279716 [P]. 1994-01-18. |
| [6] | Tobias C W. Advances in electrodes and electrochemical engineering[M]. New York: Wiley and Sons Inc , 1967: 162-240. |
| [7] | 陈金钟, 刘江宁, 李冰, 等. MgCl2-NaCl-KCl-CaCl2熔盐体系电导率估算与测定[J]. 轻金属, 2006(8): 56–61. |
| [8] | 牛丽萍, 张廷安, 王文博, 等. 基于熔融态氯化镁热解实现新镁钛联合的研究[J]. 稀有金属材料与工程, 2014, 43(12): 3138–3142. |
| [9] |
Deutscher R L, Sharna R A. Electrowinning magnesium from its oxide in a containing neodymium chloride[J].
J. Appl. Electrochem, 1999, 27: 404–409. |
| [10] | Reid R C, Prausnitz J M, Poling B E. The properties of gases and liquids[M]. 4th ed, New York: McGraw-Hill , 1987: 205. |
| [11] | 聂丽, 雷群芳, 宗汉兴, 等. 多组份体系饱和蒸气压的测定[J]. 石油化工, 1997, 26(9): 626–630. |
| [12] | 刘文彬, 朱建军, 卢锦梭. 含盐二元物系等温汽液平衡的研究[J]. 化工学报, 1990, 12(2): 56–60. |
| [13] |
Sako T, Hakuta T, Yoshitome H. Vapor-liquid equilibria of strong electrolyte aqueous solutions[J].
Fluid Phase Equilibria, 1987, 38: 63–81. DOI: 10.1016/0378-3812(87)90004-5. |
| [14] | 李鸿仪. 蒸汽压方程参数的理论预测[J]. 上海第二工业大学学报, 1996(2): 23–29. |
| [15] | 张永健. 镁电解生产工艺学[M]. 长沙: 中南大学出版社 , 2006: 262-263. |
| [16] | David G, Braithwaite, Ronald J. Allain anhydrous magnesium chloride using ethylene glycol and ammonia[P]. US Patent: 3966888, 1976-06-29. |
 2015, Vol. 6
2015, Vol. 6

