| 碱性高砷渣晶化稳定处理技术研究 |
2. 国家重金属污染防治工程技术研究中心,长沙 410083
2. Chinese National Engineering Research Center for Control & Treatment of Heavy Metal Pollution, Changsha 410083, China
我国是全世界砷污染最严重的地区之一,据统计50 %以上的砷污染来自于采矿及金属冶炼行业.有色金属采选业产生的含砷“三废”是环境中砷的主要污染源[1-2].
目前,将砷制备成结晶性良好的臭葱石(Scorodite,FeAsO4·2H2O)是公认的处理含砷废物的最佳方式之一,主要是由于臭葱石在酸性条件下具有较强的稳定性[3-5].但在实际生产过程,有色冶炼常常产生砷碱渣等强碱性高砷污染物,制备臭葱石不仅需要消耗大量的酸,而且偏酸性的臭葱石对后续的水泥固化等工序也会产生不利影响.因此,现有含砷废物的处理仍以钙砷沉淀等技术为主.然而,这种方法容易产生不稳定、无定型的钙砷化合物污泥,而且此类含砷污泥长期稳定性差,砷二次污染严重[6-7],亟需对现有钙砷沉淀污泥进行稳定化处理.
目前利用钙砷沉淀技术处理含砷废水已有相关报道,但针对其产生污泥的后续稳定化研究主要以水泥等胶凝固化处理为主,比如Jung-Wook,等报道了用高炉渣对含砷废渣进行固化[8],Deok Hyun,等用牡蛎壳对含砷固废进行固化研究[7],使用波特兰水泥、炉窑灰、粉煤灰固化也有相关的报道[9-13].普通水泥固化大多都存在增容比高、长期稳定性差等问题.此外,针对钙砷污泥中钙砷化合物微观结构特点及其环境活性的研究尚不完善,有必要针对钙砷污泥中钙砷化合物结构性质与其环境活性的关系开展相关研究[14].
相比于无定型结构,晶体的分子有序紧密排列,欲破坏高度有序的晶体结构需要更高的能量,因而其具有更好的环境稳定性.基于此,本研究通过调控含砷化合物的结晶过程,实现钙砷污泥中的非稳态砷向稳定态四水合碱式砷酸钙晶体高效转变,最终实现含砷固废的高效稳定化处理[15].处理后的含砷化合物稳定性好、浸出毒性低,可有效降低水泥用量,有利于实现含砷污染物的低增容、长期稳定化处置[16-19].
1 材料及方法 1.1 材料本实验所用碱性高砷渣取自湖南某锑冶炼企业,是砷碱渣浸出回收碱后处理高砷废水产生的污泥,其含水率约为50 %,呈橙黄色,烘干后密度约为2.83 g/cm3,pH 值约为12.通过ICP 对碱性高砷渣的化学成分进行分析,结果如表 1 所示.渣中主要成分为Ca、As,其含量分别为20.3 %和21.2 %.采用《GB5085-2007》中的方法对原渣进行浸出毒性分析,结果显示其砷的浸出毒性高达1 348.67 mg/L.结合XRD 图谱和SEM 显微照片,说明原渣是不稳定的,无定型的钙砷化合物.本实验钙基晶化剂选用氧化钙等分析纯化合物.
| 表1 碱性高砷渣的主要化学成分(质量分数,%) Table 1 Chemical component of high-arsenic caustic sludge(massfraction,%) |
 |
| 点击放大 |
1.2 实验方法
本实验将碱性高砷渣在105 ℃下烘干后,用振动磨样机(XZM-100,武汉探矿机械厂) 磨细,过0.15 mm 筛备用.称取30 g 渣样,按不同钙砷摩尔比及液固质量比添加钙基晶化剂,在六联搅拌器下进行反应,控制搅拌速度在450 r/min 左右,考察反应温度和反应时间对结果的影响.反应完成后,将样品抽滤并烘干,依据《固体废物浸出毒性浸出方法硫酸硝酸法》(HJ/T 299-2007)进行浸出毒性的实验.采用 ICP(ICAP 6000,Thermo)测定浸出液的砷含量.采用 SEM-EDS(JSM-6360LV,FEI 公司)获取样品表面形貌及能谱,并进行XRD(TTR-III,日本理学株氏会社)检测,得到其物相组成.
2 结果与讨论 2.1 钙砷摩尔比对钙砷晶化的影响钙砷摩尔比对砷浸出浓度的影响如图 1 所示.结果表明随着钙砷摩尔比从2.0:1 上升到3.0:1,砷浸出浓度稍有下降并保持稳定,但仍高达1 000 mg/L;而当钙砷摩尔比从3.0:1 升高至3.5:1 时,砷浸出浓度突然降至0.65 mg/L,之后随着钙砷摩尔比升高到5.0:1 的过程中,砷浸出浓度基本维持在0.4 mg/L左右.
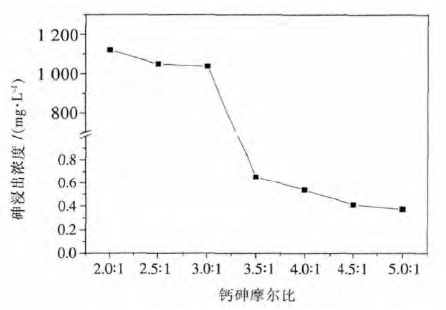 |
| 图 1 钙砷摩尔比与砷浸出毒性的关系 Fig. 1 Plot of As leaching concentration against Ca/As molar ratio from 2.0:1 to 5.0:1 |
为了明确钙砷摩尔比从3.0:1 到3.5:1 对钙砷晶化的影响,考察了钙砷摩尔比3.1:1,3.2:1,3.3:1 及3.4:1时对砷浸出浓度的影响,结果如图 2 所示.当钙砷摩尔比从3.0:1 变化到3.5:1 时,砷浸出浓度由1 048 mg/L逐步下降到0.65 mg/L,实现砷浸出毒性达标.
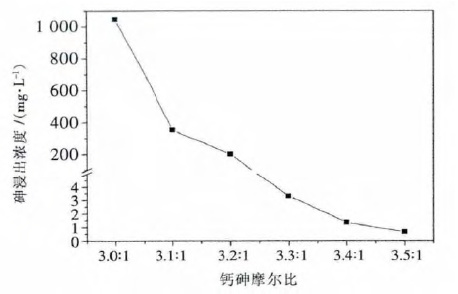 |
| 图 2 钙砷摩尔比从3.0:1 变化到3.5:1 时与砷浸出毒性的关系 Fig. 2 Plot of As leaching concentration against Ca/As molar ratio from 3.0:1 to 3.5:1 |
不同钙砷摩尔比处理后样品的XRD 图谱如图 3所示,由图 3 可以看出,原渣中无法检测出明显的钙砷化合物的特征峰,但随着钙砷摩尔比的升高,四水合碱式砷酸钙(Ca4(OH)2(AsO4)2·4H2O)的特征峰强度有明显增强,这说明钙砷摩尔比的升高有利于四水合碱式砷酸钙晶体的形成.此外随着钙砷摩尔比的增高,产物中氢氧化钙的特征峰强度也有明显的增强,而钙锑化合物的特征峰基本没有变化.所以,本研究认为,最优钙砷摩尔比为3.5:1.
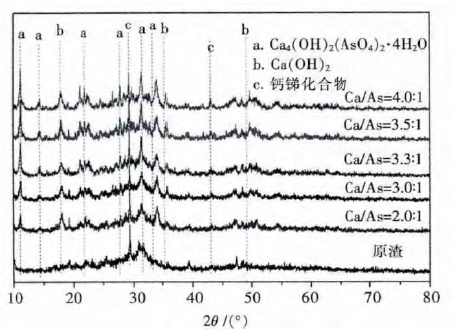 |
| 图 3 不同钙砷摩尔比条件下样品的XRD 图谱 Fig. 3 XRD patterns of samples at different Ca/As molar ratio |
2.2 液固质量比对钙砷晶化的影响
在最优钙砷摩尔比下,考察液固质量比对钙砷晶化的影响,其工艺参数为:钙砷摩尔比3.5:1,反应温度为20 ℃,反应时间3 h.处理后废渣的砷浸出浓度随液固质量比变化如图 4 所示.结果表明,不同液固质量比对砷浓度浸出毒性影响不大,其值维持在0.5 mg/L 左右.考虑到实际生产过程中的搅拌混合效果及单位体积搅拌槽处理效率,将液固质量比确定为3:1.
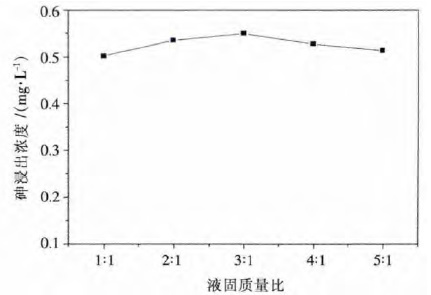 |
| 图 4 砷浸出浓度与液固质量比关系图 Fig. 4 Plot of As leaching concentration against liquid to solid mass ratio |
2.3 反应温度对钙砷晶化的影响
反应温度是钙砷晶化体系中一个重要因素,在最优的钙砷摩尔比、液固质量比的条件下,考察了反应温度从20 ℃到50 ℃对钙砷晶化的影响,结果如图 5 所示.由图 5 可以看出,当反应温度从20 ℃升高到40 ℃时,砷浸出浓度呈现出明显下降,而当反应温度从40 ℃变化到50 ℃时,砷浸出浓度已经没有很明显的下降趋势.当反应温度为40 ℃时,此时,砷浸出浓度为1.42 mg/L.
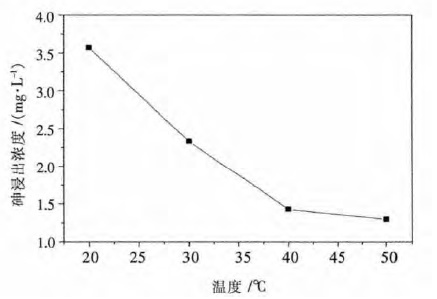 |
| 图 5 砷浸出浓度与反应温度的关系 Fig. 5 Plot of As leaching concentration against temperature |
不同反应温度下样品的XRD 图谱如图 6 所示,可以看出晶化后产物主要为四水合碱式砷酸钙、氢氧化钙、硫酸钙.且随着反应温度升高,各物质的特征峰强度明显增大,但在40 ℃下,样品的四水合碱式砷酸钙特征峰强度高于50 ℃下的样品.这说明在40 ℃的条件下,更有利于四水合碱式砷酸钙晶体的生长.综合经济成本等因素,本研究认为最优反应温度为40 ℃.
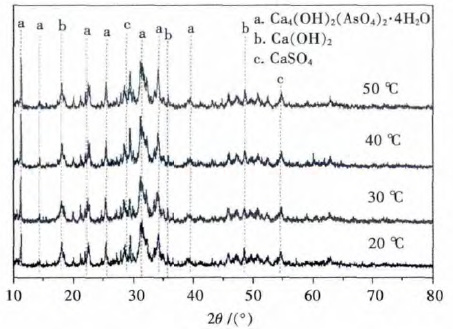 |
| 图 6 不同反应温度下样品的XRD 图谱 Fig. 6 XRD patterns of samples treated at different temperature |
2.4 反应时间对钙砷晶化的影响
在最优的钙砷摩尔比,液固质量比和反应温度的条件下,考察了反应时间从0.5 h 到8 h 对钙砷晶化的影响,结果如图 7 所示.结果表明,当反应时间在2 h 内,砷浸出浓度稍有下降,但基本维持在0.8 mg/L 左右,而当反应时间达2 h 后,砷浸出浓度呈现明显的下降趋势,当反应时间延长到8 h,砷浸出浓度低至0.13 mg/L.这是因为随着反应时间的增加,促进了四水合碱式砷酸钙晶体的生长.
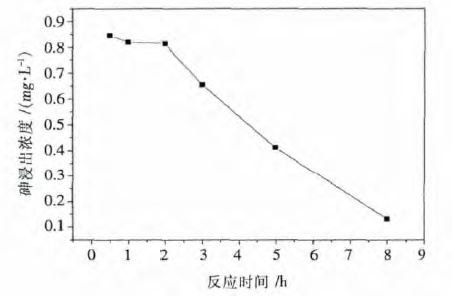 |
| 图 7 砷浸出浓度与反应时间的关系 Fig. 7 Plot of As leaching concentration against reaction time |
不同反应时间下样品的XRD 图谱如图 8 所示,分析结果表明晶化后产物主要由四水合碱式砷酸钙、氢氧化钙、硫酸钙以及一些钙锑化合物组成.反应0.5 h 并未检测到四水合碱式砷酸钙的特征峰,随着反应时间的增加,四水合碱式砷酸钙的特征峰地强度明显逐渐增大.综合浸出毒性的变化规律,研究认为,反应时间的增加有助于晶体更好的生长,故将最优反应时间确定为8 h.
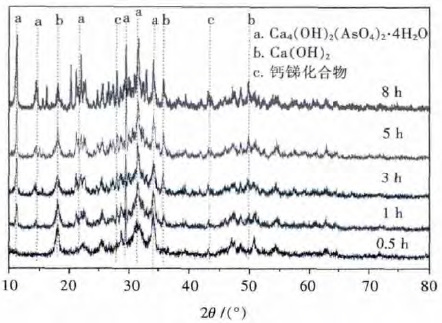 |
| 图 8 不同反应时间下样品的XRD 图谱 Fig. 8 XRD patterns of samples treated at different reaction time |
2.5 晶体及形貌分析结果
为了获取原渣和处理后样品的表面形貌和能谱分析结果,对其进行SEM-EDS 检测(图 9),其中图 9(a)为原渣的在10 000 倍下的表面形貌图,可以发现其为松弛的无定型的物质;而图 9(b)及图 9(c)为最优工艺条件下的形貌图,由图 9(b)可以看出,在最优工艺条件下,样品从絮体结构转变为表面覆盖有颗粒物的晶体结构,由图 9(c)可以更清晰地看出颗粒密集并有层次地包裹在表面上,颗粒尺寸约为0.5 μm,用 Scherrer 公式计算得到晶粒大小21.1 nm.图 9 (b)中红框区域的EDS 分析如图 9(d),结果表明该区域主要有Ca、As、O 等元素.结合XRD 图谱的分析结果可以判定,随着晶化反应的进行,晶体得到了充分得生长.
 |
| 图 9 SEM 显微照片及能谱图 Fig. 9 SEM micrographs of the original sludges and treated samples and EDS spectra |
综上所述,通过晶化处理后,含砷污泥中原有的无定型钙砷化合物,可有效转化为稳定的含砷晶体(如Ca4(OH)2(AsO4)2·4H2O),这种过程是砷浸出毒性降低的主要机制.
3 结论1)通过实验探索出碱性高砷渣钙砷晶化解毒的最佳工艺条件:钙砷摩尔比为3.5:1,液固质量比为3:1,反应温度为40 ℃,反应时间为8 h.原渣经钙砷晶化解毒后的砷浸出浓度从1 348.67 mg/L 下降到0.13 mg/L,优于《GB 5085.3-2007》规定的5 mg/L 的标准值.
2)通过SEM 和XRD 分析结果表明,浸出毒性降低的主要机制是原渣中的无定型钙砷化合物经过钙砷晶化后,转变成为结晶良好的四水合碱式砷酸钙.
| [1] | 熊如意, 宋卫峰. 环境砷污染及其治理技术发展趋势[J]. 广东化工, 2007, 34(11): 92–94. |
| [2] | 郭朝晖, 程义. 有色冶炼废渣的矿物学特征与环境活性[J]. 中南大学学报(自然科学版), 2007, 38(6): 1100–1105. |
| [3] |
LeBerre J F, Gauvin R, Demopoulos G P. A study of the crystallization kinetics of scorodite via the transformation of poorly crystalline ferric arsenate in weakly acidic solution[J].
Colloids and Surfaces A: Physicochem. Eng. Aspects, 2008, 315: 117–129. DOI: 10.1016/j.colsurfa.2007.07.028. |
| [4] |
Krause E, Ettel. Solubilities and stabilities of ferric arsenate compounds[J].
Hydrometallurgy, 1989, 22: 311–337. DOI: 10.1016/0304-386X(89)90028-5. |
| [5] | 巫瑞中. 石灰-铁盐法处理含重金属及砷工业废水[J]. 江西理工大学学报, 2006, 27(3): 58–61. |
| [6] |
Nishimura T, Robins R G. A Re-evaluation of the solubility and stability regions of calcium arsenites and calcium arsenates in aqueous solution at 25 ℃[J].
Mineral Proc and Extr Met Reviews, 1998, 18: 283–308. DOI: 10.1080/08827509808914159. |
| [7] |
Nishimura T, Tozawa K. The reaction for the removal of As and As from aqueus solutions by adding calcium hydroxide[J].
J Min Met Inst Japan, 1984, 100: 1085–1091. |
| [8] |
Jung W, Kim M Y, Chae J. Solidification of arsenic and heavy metal containing tailings using cement and blast furnace slag[J].
Environ Geochem Health, 2011, 33: 151–158. DOI: 10.1007/s10653-010-9354-2. |
| [9] |
Deok H, Moon K W. Stabilization of arsenic-contaminated mine tailings using natural and calcined oyster shells[J].
Environ Earth Sci, 2011, 64: 597–605. DOI: 10.1007/s12665-010-0890-y. |
| [10] |
Choi W H, Lee S R, Park J Y. Cement based solidification/stabilization of arsenic-contaminated mine tailings[J].
Waste Management, 2009, 29: 1766–1771. DOI: 10.1016/j.wasman.2008.11.008. |
| [11] |
Palfy P, Vircikova E, Molnar L. Processing of arsenic waste by precipitation and solidification[J].
Waste Management, 1999, 19: 55–59. DOI: 10.1016/S0956-053X(99)00014-8. |
| [12] |
Camacho J, Wee H Y. Arsenic stabilization on water treatment residuals by calcium addition[J].
Journal of Hazardous Materials, 2009, 165: 599–603. DOI: 10.1016/j.jhazmat.2008.10.038. |
| [13] |
Carlo V, Veroniek D. Solidification/stabilisation of arsenic bearing fly ash from the metallurgical industry[J].
Waste Management, 2002, 22: 143–146. DOI: 10.1016/S0956-053X(01)00062-9. |
| [14] |
Leist M, Casey R J. The management of arsenic wastes:Problems and prospects[J].
Journal of Hazardous Materials, 2000, 76: 125–138. DOI: 10.1016/S0304-3894(00)00188-6. |
| [15] | 朱义年, 张华. 砷酸钙化合物的溶解度及其稳定性随pH 值的变化[J]. 环境科学学报, 2005, 25: 1652–1660. |
| [16] |
James V Bothe, Paul J R, Brown W. Arsenic immobilization by calcium arsenate formation[J].
Environmental Science and Techn-ology, 1999, 33: 3806–3811. DOI: 10.1021/es980998m. |
| [17] |
Jie C, Du Y G. A new process of continuous three-stage co-precipitation of arsenic withferrous iron and lime[J].
Hydro-metallurgy, 2014, 146: 169–174. |
| [18] |
James V B, Paul Jr, Brown W. The stabilities of calcium arsenates at 23±1 ℃[J].
Journal of Hazardous Materials, 1999, 69: 197–207. DOI: 10.1016/S0304-3894(99)00105-3. |
| [19] | 雷杰, 彭兵. 用电解锰渣制备高铁硫铝酸盐水泥熟料[J]. 材料与冶金学报, 2014, 13(4): 257–261. |
 2015, Vol. 6
2015, Vol. 6


