| 纳米多孔引入强化工业硅中杂质脱除研究 |
1b. 昆明理工大学,冶金与能源工程学院,昆明 650093;
2. 云南大学物理科学技术学院,昆明 650091
1b. Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093, China;
2. Faculty of Physical Science and Technology, Yunnan University, Kunming 650091, China
近年来,太阳能因其储量无穷、不受地域限制、清洁无污染等优点而备受世界各国关注[1].硅凭借其在地球近28 %的高储存量、合适的能带结构、洁净无污染性、相对成熟的制备工艺和高的性能稳定性等优势,成为当今世界商品化太阳能电池的主要材料.
长期以来,探索开发一种低成本太阳能级硅(SoG-Si)制备新工艺一直是许多国内外研究者关注的热点之一[2].在众多方法中冶金法被认为是一种应用前景较好的低成本SoG-Si 制备方法[3-4].通常,为了实现工业硅中杂质的深度去除,在纯化流程中往往需要包含多次高温精炼过程,它们往往对设备要求高、耗能较大,这也就导致目前冶金法所制备的SoG-Si在价格上并不具备绝对优势.
工业硅湿法提纯技术因其成本低、能耗少及适合规模化应用等特点而被广泛关注.早在1961 年,Walter 等[5]就在专利US 2972521 中公开一种通过对工业硅进行硫酸、王水、氢氟酸等酸浸处理,获得纯度满足微波二级管要求硅料的方法.Hunt 等[6]以粒径约50 μm 的硅粉为原料,在酸浸温度75 ℃条件下,经王水、HCl、HF 浸出12 h 后,工业硅中的杂质去除率超过90 %.Santos 等[7]以98 %的冶金硅为原料,经HCl和HF 酸洗后,硅料纯度提高到99.9 %.Sahu 等[8]探讨了在HCl 介质中加入三氯化铁和硫代硫酸钠对硅中杂质去除效果的影响,研究结果表明氧化剂的加入可以明显地改善硅中杂质的去除效果.Juneja 等[9]发现冶金硅在50 ℃条件下经HF 酸洗后提纯效果最好,他们利用粒径为150 μm 的冶金硅料经上述酸浸后,得到的硅纯度为99.95 %.
然而,大量研究结果表明单独依靠湿法酸浸处理欲实现硅中杂质的深度去除仍然面临挑战,酸浸处理后硅纯度难以达到99.99 %或更高的水平.为了提高湿法除杂的效率,多种不同的强化手段被运用来改善酸浸除杂效果.Dietl[10]研究认为小粒径硅料有助于硅中杂质的暴露,有利于在酸浸过程中杂质的去除[11-12].Ma 等[12]在酸浸过程中引入超声搅拌强化,研究结果表明超声搅拌比传统机械搅拌更有利于硅中杂质去除.李阳等[13]、谢克强等[14]分别通过引入紫外光照、高压、微波加热等外场强化酸浸,发现工业硅中杂质的去除率都得到了不同程度的提高.除在湿法酸浸过程中引入外场强化手段外,一些研究者还通过对硅料进行预处理后再结合湿法酸浸来达到硅中杂质深度去除的目的.其中精炼结合湿法酸浸除杂就是较常用的一种方法.罗学涛等[15]引入钙系渣(CaO-SiO2-CaF2)对硅料进行精炼,再结合HF/HCl 混合酸浸处理,该方法不但提高了金属杂质Fe、Al、Mn、Ti 的去除效果,也对 B、P 杂质的去除具有较好的促进作用.Guo 等[16]在超重力下开展了Si-Al 合金溶剂精炼,并用王水溶解Al,可以将硅的纯度从99.59 %提高到99.92 %.Esfahani等[17-18]引入Fe-Si 精炼结合酸浸处理,研究结果表明通过对Fe-Si 合金进行快速淬火处理有利于酸浸过程中杂质的去除,杂质总去除效率达98.9 %.Morita[19]和 Meteleva-Fischer[20]的研究结果表明,通过Ca-Si 合金化可以促进杂质与工业硅的分离.中科院过程所王志等[21]在Sn-Si 精炼过程中引入金属钙,再结合湿法酸浸处理,发现硅中主要金属杂质及B、P 杂质含量都显著降低.除上述几种金属外,金属Ti[22]、Cu[23]与硅合金化后结合酸浸除杂的研究也有报道.
本文采用化学刻蚀法和金属纳米颗粒辅助刻蚀法在其表面引入纳米孔道,来实现硅料中各包裹杂质与酸溶液的高效接触以达到工业硅中杂质高效去除的目的.选取工业硅为研究对象,以Fe、Al 2 种主要金属杂质的去除效率为评价指标,研究了不同刻蚀方法中氧化剂浓度对工业硅表面引入纳米孔道结构及杂质去除效率差异的影响.
1 实验 1.1 试验原料试验中所用的工业硅来源于云南某硅企业,经过破碎、冲洗、干燥、研磨后获得粒径尺寸为200 目(约75 μm)的工业硅粉,其硅含量及主要杂质Fe、Al 含量如表 1 所示.
| 表1 工业硅中硅含量及主要杂质含量/(质量分数,%) Table 1 Silicon and main metal mpurity content in industry silicon/(massfraction,%) |
 |
| 点击放大 |
除对硅料进行化学成分分析外,还对硅料进行了 XRD 分析,其结果如图 1 所示,通过表征可以发现除了硅的衍射峰以外,并没有其他物相的峰存在,这主要是由于硅中各杂质含量都非常低,并不足于形成能够被XRD 表征所能识别的杂质相.
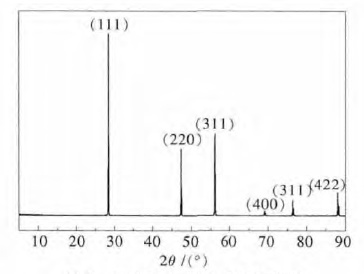 |
| 图 1 工业硅原料的XRD 结果 Fig. 1 XRD pattern of raw industry silicon powder |
1.2 试验试剂与仪器
去离子水,H2O2、HF、HNO3、AgNO3均为分析纯,电子分析天平(AL204,上海梅特勒托利多仪器有限公司),超声波清洗仪(SK5210HP,上海科导超声仪器有限公司),磁力搅拌器(AM-5250B,天津奥特赛恩斯仪器有限公司),电热鼓风干燥箱(上海恒科学仪器有限公司),扫描电镜(FEI Quanta 200,加速电压30 kV),采用电感等离子发射光谱法(ICP-AES)对刻蚀后样品中主要元素Si、Fe、Al 进行测定.
1.3 实验步骤称取5 g 工业硅粉,将其置于去离子水中超声清洗15 min,在室温下用浓度为5 %的HF 浸泡10 min,之后用大量去离子水冲洗至中性烘干备用.
化学刻蚀中,将洗净的硅粉浸于HF/HNO3的混合刻蚀液中,HF 为4.6 mol/L,HNO3分别为0.5 mol/L,1 mol/L,1.5 mol/L,反应在室温下进行2 h,刻蚀过程中进行搅拌处理,刻蚀结束后用大量去离子水冲洗样品直至中性,将样品过滤烘干后进行SEM 和ICP-AES检测;在一步金属辅助刻蚀中,将5 g 硅粉浸于HF/ AgNO3的混合溶液中,HF 为4.6 mol/L,AgNO3分别为0.01 mol/L,0.04 mol/L,0.08 mol/L,刻蚀过程在室温避光条件下进行2 h,反应结束后将硅粉置于40 %的 HNO3溶液中浸泡0.5 h 以去除硅粉中刻蚀时沉积在硅颗粒表面的银颗粒,用大量去离子水冲洗样品直至中性,将样品过滤烘干后待测;在两步金属辅助刻蚀中,硅粉先浸于浓度分别为0.01 mol/L 和4.6 mol/L的AgNO3/HF 的混合液中进行银纳米粒子沉积,沉积时间60 s,沉积结束过滤后再置于HF/H2O2混合液中反应2 h,刻蚀液中HF 为4.6 mol/L,H2O2分别为:0.5 mol/L,1 mol/L,1.5 mol/L,刻蚀结束后将硅粉置于浓度为40 %的HNO3溶液中浸泡0.5 h 后用大量去离子水冲洗样品直至中性,将样品过滤烘干后待测.
2 结果与分析 2.1 化学腐蚀法对工业硅中杂质去除效率的影响为研究化学刻蚀法对工业硅中Fe、Al 杂质去除效率的影响,先对不同氧化剂浓度条件下获得的样品进行SEM 表面及截面表征,结果如图 2 所示.
 |
| 图 2 化学腐蚀法在不同的HNO3浓度下形成的粉末多孔硅表面及截面SEM 像 Fig. 2 Surface and cross-sectional SEM micrograph of powder porous silicon by stain etching under different HNO3 concentrations |
从图 2(A)中可以看出硅粉表面呈现出“海绵状”酥松结构,硅颗粒表面出现大量细密的腐蚀坑和沟壑.Lehmann 等[24]认为腐蚀液与硅颗粒接触后会形成大量的局部原电池,在局部阴极发生硝酸的还原反应,硅中的空穴迁移到局部阳极导致硅的氧化和溶解,同时消耗由阴极迁移而来的空穴,氧化形成的 SiO2在HF 作用下溶解形成多孔结构.由于化学刻蚀中硅的溶解是一个析氢过程,因此伴随着硅溶解将释放大量气体,氢在气化过程中由于体积的膨胀会对多孔硅内部产生压力,而导致硅晶体内部较脆弱的部位(如晶界附近) 形成裂纹.当HNO3浓度为0.5 mol/L时,其在反应过程中很快消耗殆尽,留下刻蚀初期所形成的大量细密沟壑和腐蚀坑而呈现海绵状.当硝酸浓度增加到1.0 mol/L 时,硅颗粒表面孔径尺寸明显增加,约为200~500 nm 且分布比较均匀,并呈现出一定的规则形状(如图 2(B)中所示),当HNO3的浓度增加,到1.5 mol/L 时,硅颗粒表面形成了大量方形腐蚀坑,尺寸普遍较大(均在微米量级).同时,由于 HNO3浓度的增加使得硅孔壁的过度溶解,而导致了孔与孔的合并而形成较大的长条形方孔,且导致颗粒表面的孔隙率明显降低,硅颗粒表面的粗糙度明显增加.由样品的截面SEM 表征可以看出,化学刻蚀法所得的粉末多孔硅颗粒表层的多孔层与基底层的界线并不清晰,该现象主要由于硅在HF/HNO3体系中的刻蚀显示各向同性刻蚀所致.硅粉末作为一种多晶材料,其表面不同区域处的电极电位是不一样的.一旦硅粉与化学浸蚀液接触,这些电极电位不同的区域将构成局部阳极和局部阴极,形成许多微小的电池并发生腐蚀.在多孔硅形成的初期,由于硅晶体的表面存在大量的缺陷(机械应力导致的缺陷或者杂质固溶导致的晶格畸变等),使得缺陷区域的势垒降低,从而具有较高的化学活性,这使得空穴容易注入硅的价带中,形成硅基体表面多孔硅的成核部位.然而,从以上的实验结果也可以看出HNO3浓度在较小范围内变动对多孔硅的形貌影响较大,因此多孔硅的均匀性不容易控制.
为了研究化学腐蚀法对工业硅中杂质去除效率的影响,实验中对刻蚀前后样品中的杂质进行了测试,结果如图 3 所示.结果表明在HF/HNO3体系中对工业硅进行化学刻蚀,在硅表面引入多孔结构的同时,也会对硅中的杂质具有酸浸去除效果,Fe、Al 杂质含量都随着硝酸浓度的增加而降低,最优去除效率分别为98 %和85.5 %.
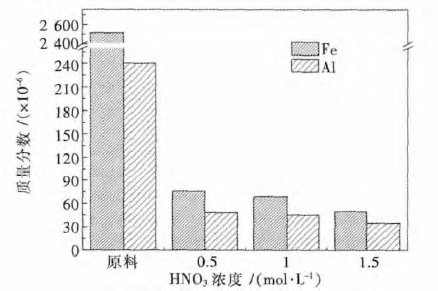 |
| 图 3 不同HNO3浓度下一步金属辅助刻蚀法前后工业硅中 Fe、Al 含量表征 Fig. 3 Iron and aluminum content before and after chemical etching of industry silicon powder under different HNO3 concentration |
2.2 一步金属辅助刻蚀法对工业硅中杂质去除效率的影响
图 4 中分别为不同的AgNO3浓度下一步金属辅助刻蚀法形成的多孔硅的形貌图.由图 4 可看出一步法制备的多孔硅均为“海绵状”,在硅表面有很多细小的腐蚀坑,随着Ag+浓度的增加,孔径尺寸呈现增加趋势,硅粉表面也变得更加酥松多孔.结合Smith 等[25]的观点,在一步金属辅助刻蚀法腐蚀工业硅粉的过程中,溶液中的银离子(Ag+)能够捕获来自硅价带中的电子而发生自沉积,沉积后形成的纳米银颗粒将进一步催化硅基底被氧化并被溶液中的HF 溶解.银纳米颗粒与硅基底之间形成了纳米电化学池,纳米银颗粒充当纳米阴极,而与之接触的硅基底充当阳极,其阴极和阳极所发生的反应如下所示.
 |
| 图 4 一步金属辅助刻蚀法在不同AgNO3浓度下形成多孔硅粉的SEM 表面及截面表征 Fig. 4 Surface and cross-sectional SEM images of porous silicon powder by 1-step metal assisted chemical etching under different AgNO3 concentrations |
阴极(还原反应):Ag++e-→Ag;
阳极(氧化反应):Si+6F-→[SiF6]2-+4e-
上述银纳米粒子催化下的氧化还原反应交替持续进行,使得其底部的硅不断溶解,从而导致银纳米粒子往硅基体内部“钻”出大量纳米孔道.通过对其截面进行表征,可以发现该方法形成的纳米孔道同样是由大量的硅纳米柱分隔而成,与前期实验中以单晶硅为原料获得样品形貌类似[26].根据上述分析可知,随着溶液中Ag+浓度的增加,沉积在硅颗粒表面的银颗粒尺寸势必会增大,且在后期刻蚀过程中,更加充足的 Ag+将带来硅基底的更多氧化和溶解,使得硅颗粒表面的孔尺寸和孔隙率都逐渐增大.图 4(a)、图 4(b)和图 4(c)的截面表征也证实了硅颗粒表面的孔道深度随着Ag+浓度的增加而增加,孔的生长速率也从0.05 μm/min 增加到0.10 μm/min.
图 5 中对一步金属纳米颗粒辅助刻蚀后样品中的 Fe、Al 杂质进行分析,通过检测可以发现一步金属纳米颗粒辅助刻蚀法后,多孔工业硅粉中的Fe、Al 杂质含量均有大幅下降,且去除效率与化学刻蚀法相比有了进一步提高,Fe、Al 杂质最好去除效率分别在98.7 %和91.5 %.根据Li 等[27]的观点,在金属纳米辅助刻蚀硅的过程中,一些硅中的金属杂质可能也会在纳米金属颗粒表面被氧化而进入溶液,同时结合SEM 表征可以发现,一步刻蚀过程中引入的大量纳米孔道势必会为HNO3清洗过程中Fe、Al 杂质的脱除起到促进作用.
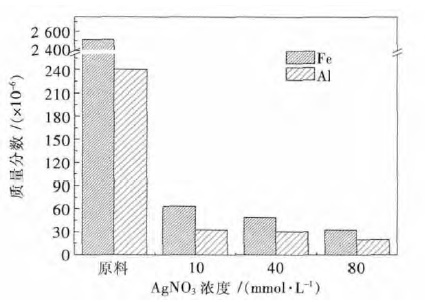 |
| 图 5 不同AgNO3浓度下一步金属辅助刻蚀法前后工业硅中 Fe、Al 含量表征 Fig. 5 Iron and aluminum content before and after 1-step metal-assisted chemical etching of industry silicon powder under different AgNO3 concentration |
2.3 两步金属辅助刻蚀法对工业硅中杂质去除效率的影响
图 6 中分别为两步金属辅助刻蚀法分别在H2O2浓度为0.5 mol/L、1 mol/L 和1.5 mol/L 的条件下形成的多孔硅粉的SEM 表面及截面形貌图.
 |
| 图 6 两步金属辅助刻蚀法在不同的H2O2浓度下形成的多孔硅粉SEM 表面及截面表征 Fig. 6 Surface and cross-sectional SEM images of porous silicon powder by 2-step metal assisted chemical etching under different H2O2 concentrations |
工业硅粉的表面SEM 表征中可以看出当H2O2浓度在1.0 mol/L 及更低时,得到的多孔硅粉呈现出十分均匀酥松的“海绵状”结构,多孔硅表面被大量细密的孔洞所覆盖,其尺寸大小约为50~150 nm 左右.当双氧水浓度增加到1.5 mol/L 时,硅颗粒表面多孔结构呈现出大量粗糙的网络状,孔洞普遍在200~300 nm之间且其形状多表现为方形结构,表面形貌表征结果表明两步金属辅助化学刻蚀法制备的多孔硅粉其孔洞均匀性较好,其尺寸大小随着H2O2浓度的升高而明显增大,且较容易控制.结合Peng 等[28]的观点,两步金属纳米颗粒辅助刻蚀时,在银纳米粒子表面(阴极)和与之接触的硅基底(阳极)发生如下反应:
阴极:H2O2+2H+→2H2O2+h+(2H++2e-→H2↑)
阳极:Si+4h++6HF→H2SiF6+4H+
与一步金属纳米颗粒辅助刻蚀类似,上述氧化还原反应的持续进行使得孔道不断延伸,因此H2O2浓度的增加能够确保阴极反应更加持久地进行,从而使得与之对应的阳极硅氧化溶解反应不断进行,而使得孔道深度随着H2O2浓度增加而增加(如图 6(b)所示).但当H2O2浓度为1.5 mol/L 时,孔深度有所下降,这主要是由于构成多孔结构的硅线顶部被氧化刻蚀所致,这一点可以通过图 6(c)中较秃的硅纳米线顶部所证实,通过截面表征可发现,孔的生长速率一开始从0.35 μm/min 增加到0.5 μm/min 后,随H2O2浓度继续增加而又下降到0.36 μm/min,这主要是由于高浓度条件下过度氧化或侧向刻蚀所导致[29].
由上述实验结果可知不同刻蚀方法中的不同氧化剂物种和浓度对工业硅表面的多孔形貌结构具有显著的影响.在上述3 种刻蚀过程中氧化剂分别为 HNO3、AgNO3和H2O2,在化学腐蚀法中为NO3-,其氧化还原电位为Eθ(NO3-/NO)=0.957 V,一步金属辅助刻蚀法中氧化物种为Ag+,对应的电极电势:Eθ(Ag+/ Ag)=0.799 6 V,两步刻蚀法中H2O2的电极电势为 Eθ=(H2O2/H2O)=1.776 V,上述3 种氧化剂都具备足够的氧化还原电位将空穴注入到硅价带,且其氧化还原电位越高越有利于空穴的注入,金属纳米粒子在刻蚀过程中既可以充当氧化剂实现空穴的注入,也能充当催化剂为电子的流通提供通道.在化学腐蚀法中,虽然NO3-具有高的电极电位但在该刻蚀过程中各向同性占据主导位置,所以多孔结构的形成效率较低且多孔形貌不易控制.在金属辅助刻蚀法中,纳米银颗粒在刻蚀中起到催化及孔道延生的引导作用,所以能够形成明确的大量的纳米孔道.相比而言,由于一步金属纳米颗粒辅助刻蚀过程中Ag+的氧化能力较有限,因此形成的多孔形貌主要呈现海绵状.两步刻蚀法中H2O2有更强的氧化性,因此多孔形成的效率更高且通过调节浓度可以更好地控制其孔道结构和形貌.
图 7 表明,两步金属纳米辅助刻蚀对工业硅中的 Fe、Al 杂质去除具有巨大的促进作用,刻蚀后工业硅中的杂质Fe 去除效率均在99.2 %以上,硅中Fe 杂质(指质量分数)从2.51×10-3 降低到5.58×10-6,最优去除效率为99.8 %.同时,硅中的杂质Al 含量也有大幅降低,从原始的2.4×10-4 下降到1.2×10-5 左右,最高去除效率也能达到94.7 %,与传统的湿法酸浸除杂质相比,通过两步金属纳米刻蚀引入多孔结构对工业硅中杂质酸浸脱除具有巨大的促进作用[30].
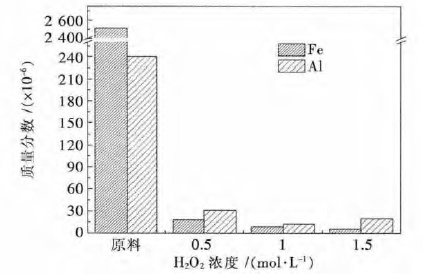 |
| 图 7 不同H2O2浓度下两步金属辅助刻蚀法前后工业硅中 Fe、Al 含量表征 Fig. 7 Iron and aluminum content before and after2-step metal-assisted chemical etching of industry silicon powder under different H2O2 concentration. |
3 结论
1)无论是传统化学刻蚀法还是金属纳米颗粒辅助刻蚀法,均可在工业硅粉表面引入大量微纳米孔道,且样品孔隙率均呈现出随氧化剂浓度的增加而增加的趋势,相比而言,金属纳米颗粒辅助刻蚀方法在孔道生长速率、孔道形貌结构调控方面均表现更加出色,通过选取合适的氧化剂种类和浓度,可以高效地获得孔径在50~300 nm 之间,孔深在约60 μm 范围内可调的多孔工业硅粉.
2)相比于工业硅的传统湿法酸浸除杂,纳米孔道的引入对工业硅中主要金属杂质Fe、Al 的去除,均表现出较好的促进作用,研究结果表明,工业硅粉中纳米孔道的特别使两步金属纳米颗粒辅助刻蚀技术对增强Fe、Al 杂质的去除作用最为明显,在较优的试验条件下,Fe、Al 杂质的去除效率分别可达99.8 %和94.7 %.
| [1] | 薛霜霜, 何洪波, 余长林. 稀土上转换用于提高半导体化合物光催化效率的研究进展[J]. 有色金属科学与工程, 2015, 6(4): 97–103. |
| [2] | 王新刚. 太阳能级多晶硅生产技术研究现状及展望[J]. 化工技术与开发, 2012, 41(9): 27–33. |
| [3] |
Braga A F B, Moreira S P, Zampieri P R, et al. New processes for the production of solar-grade polycrystalline silicon: A review[J].
Solar Energy Materials and Solar Cells, 2008, 92(4): 418–424. DOI: 10.1016/j.solmat.2007.10.003. |
| [4] | 谭毅, 郭校亮, 石爽, 等. 冶金法制备太阳能级多晶硅研究现状及发展趋势[J]. 材料工程, 2013(3): 90–96. |
| [5] | Walter V. Production of pure silicon: US, 2972521[P]. 1961-02-21. |
| [6] |
Hunt L, Dosaj V, McCormick J, et al. Purification of metallurgical-grade silicon to solar-grade quality[J].
Electrochemical Society, 1976: 200–215. |
| [7] |
Santos I, Goncalves A, Santos C S, et al. Purification of metallurgical grade silicon by acid leaching[J].
Hydrometallurgy, 1990, 23(2): 237–246. |
| [8] |
Sahu S, Asselin E. Effect of oxidizing agents on the hydrometallurgical purification of metallurgical grade silicon[J].
Hydrometallurgy, 2012, 121: 120–125. |
| [9] |
Juneja J, Mukherjee T. A study of the purification of metallurgical grade silicon[J].
Hydrometallurgy, 1986, 16(1): 69–75. DOI: 10.1016/0304-386X(86)90052-6. |
| [10] |
Dietl J. Hydrometallurgical purification of metallurgical-grade silicon[J].
Solar Cells, 1983, 10(2): 145–154. DOI: 10.1016/0379-6787(83)90015-7. |
| [11] |
Fang M, Lu C H, Huang L Q, et al. Separation of metal impurities from metallurgical grade silicon via CaO-SiO2-CaF2 slag treatment followed by leaching with hydrochloric acid[J].
Separation Science and Technology, 2014, 49(14): 2261–2270. DOI: 10.1080/01496395.2014.919323. |
| [12] |
Ma X D, Zhang J, Wang T M, et al. Hydrometallurgical purification of metallurgical grade silicon[J].
Rare Metals, 2009, 28(3): 221–225. DOI: 10.1007/s12598-009-0043-1. |
| [13] | 李阳, 张倩, 赵杰, 等. 紫外光照射下冶金级硅湿法提纯工艺研究[J]. 江苏技术师范学院学报(自然科学版), 2009, 15(2): 14–17. |
| [14] |
Xie K, Yu Z, Ma W, et al. Removal of iron from metallurgical grade silicon with pressure leaching[J].
Advanced Material Science and Technology, Pts 1 and 2, Materials Science Foru, 2011(675/676/677): 873–876. |
| [15] |
Fang M, Lu C, Huang L, et al. Effect of calcium-based slag treatment on hydrometallurgical purification of metallurgical-Grade Silicon[J].
Industrial & Engineering Chemistry Research, 2014, 53(2): 972–979. |
| [16] |
Li J W, Guo Z C, Tang H Q, et al. Si purification by solidification of Al-Si melt with super gravity[J].
Transactions of Nonferrous Metals Society of China, 2012, 22(4): 958–963. DOI: 10.1016/S1003-6326(11)61270-3. |
| [17] |
Esfahani S, Barati M. Purification of metallurgical silicon using iron as impurity getter, part II: Extent of silicon purification[J].
Metals and Materials International, 2011, 17(6): 1009–1015. DOI: 10.1007/s12540-011-6020-x. |
| [18] |
Esfahani S, Barati M. Purification of metallurgical silicon using iron as an impurity getter part I: Growth and separation of Si[J].
Metals and Materials International, 2011, 17(5): 823–829. DOI: 10.1007/s12540-011-1021-3. |
| [19] |
Shimpo T, Yoshikawa T, Morita K. Thermodynamic study of the effect of calcium on removal of phosphorus from silicon by acid leaching treatment[J].
Metallurgical and Materials Transactions B-Process Metallurgy and Materials Processing Science, 2004, 35(2): 277–284. DOI: 10.1007/s11663-004-0029-1. |
| [20] |
Meteleva-Fischer Y V, Yang Y, Boom R, et al. Microstructure of metallurgical grade silicon during alloying refining with calcium[J].
Intermetallics, 2012, 25: 9–17. DOI: 10.1016/j.intermet.2012.02.009. |
| [21] |
Hu L, Wang Z, Gong X Z, et al. Purification of metallurgical-grade silicon by Sn-Si refining system with calcium addition[J].
Separation and Purification Technology, 2013, 118: 699–703. DOI: 10.1016/j.seppur.2013.08.013. |
| [22] |
Johnston M D, Barati M. Calcium and titanium as impurity getter metals in purification of silicon[J].
Separation and Purification Technology, 2013, 107: 129–134. DOI: 10.1016/j.seppur.2013.01.028. |
| [23] |
Visnovec K, Variawa C, Utigard T, et al. Elimination of impurities from the surface of silicon using hydrochloric and nitric acid[J].
Materials Science in Semiconductor Processing, 2013, 16(1): 106–110. DOI: 10.1016/j.mssp.2012.06.009. |
| [24] |
Nakaya H, Nishida M, Takeda Y., et al. Polycrystalline silicon solar cells with v-grooved surface[J].
Solar Energy Materials and Solar cells, 1994, 34(1): 219–225. |
| [25] |
Smith Z R, Smith R L, Collins S D. Mechanism of nanowire formation in metal assisted chemical etching[J].
Electrochimica Acta, 2013, 92: 139–147. DOI: 10.1016/j.electacta.2012.12.075. |
| [26] | 李绍元. 多孔硅制备及其在重金属离子检测中的应用研究[D].昆明: 昆明理工大学, 2014. |
| [27] |
Li X, Xiao Y, Bang J H, et al. Upgraded silicon nanowires by metal assisted etching of metallurgical silicon: A new route to nanostructured solar-grade silicon[J].
Advanced Materials, 2013, 25(23): 3187–3191. DOI: 10.1002/adma.201300973. |
| [28] |
Peng K, Lu A, Zhang R, et al. Motility of metal nanoparticles in silicon and induced anisotropic silicon etching[J].
Advanced Functional Materials, 2008, 18(19): 3026–3035. DOI: 10.1002/adfm.v18:19. |
| [29] |
Li S, Ma W, Zhou Y, et al. Fabrication of porous silicon nanowires by MACE method in HF/H2O2/AgNO3 system at room temperature[J].
Nanoscale Research Letters, 2014, 9(1): 1–8. DOI: 10.1186/1556-276X-9-1. |
| [30] | 麦毅. 冶金法制备太阳能级硅工艺中湿法提纯及半工业化研究[D].昆明: 昆明理工大学, 2014. |
 2015, Vol. 6
2015, Vol. 6


