| 顶空萃取-气相色谱质谱联用检测饮用水源5种典型嗅味物质 |
2. 同济大学环境科学与工程学院,上海 200092;
3. 上海城市水资源开发利用国家工程研究中心,上海 200082
2. Tongji University, Shanghai 200092,China;
3. Shanghai Municipal Water Resource Development and Utilization National Engineering Center Co. Ltd., Shanghai 200082, China
嗅味物质一直以来都是饮用水研究的热点,在我国嗅味物质影响水质的问题也十分突出,然而其低嗅阈值,低浓度的特点使得检测方法的建立成为该类研究的难点与限制性因素[1-3].本研究选择典型的5种嗅味物质:2-甲基异莰醇(2-MIB),β-环柠檬醛(β-Cyclocitral),土嗅素(GSM),二甲基三硫醚(DMTS)以及β-紫罗兰酮(β-Ionone)作为研究对象,利用自动化的顶空萃取-气相色谱-质谱联用方法,建立检测痕量嗅味物质的检测方法.该5种典型嗅味物质中,2-MIB与GSM表现为土霉味,为某些特殊致嗅蓝藻,放线菌等微生物的代谢产物[4];β-Cyclocitral跟随浓度变化(0.5~80 g/L)表现为青草味,木头味,烟草味等,被普遍认为是蓝藻中的铜绿微囊藻所代谢产生[5-6];DMTS为腐败味、烂菜味,是由于水体中藻类等腐败分解后产生,同时也有研究称某些涡鞭藻类的多甲藻属也能够产生[7];β-Ionone为紫罗兰味道,源自蓝藻细胞中经氧化的β-胡萝卜素[8].
固相微萃取(SPME)是顶空萃取方式的一种,作为富集检测低浓度嗅味物质的处理方法,其效果明显,得到较广泛应用.毛敏敏等[9]利用大体积浓缩固相微萃取方法对嗅味物质进行富集检测,各类物质在0 ~ 200 ng/L范围内线性关系良好.张锡辉等[10]利用新型顶空-固相微萃取装置作为样品预处理方法,对嗅味物质进行测定,各类物质检出浓度与峰面积相关性大于0.87.然而上述固相微萃取方法操作复杂,对萃取装置有严格要求.同时萃取过程中,萃取时间,萃取针头深入位置,搅拌强度等参数难以得到精确的控制,不同操作人员在操作该类萃取装置时差异较大.此外,萃取时间较长且后续进样过程较为繁琐,样品数量较多时不宜采用.
针对当前嗅味物质检测问题,本研究利用自动化的顶空萃取进样器,对5种水体中典型嗅味物质进行检测,并利用产嗅藻类的藻液样品进行方法验证,建立出一套简单且易于操作,同时条件控制精确,重现性高的顶空萃取-气质联用检测方法,增强了定量分析嗅味物质的能力,同时也为嗅味物质检测与研究过程中遇到的大量样品测定提供了可行方法.
1 材料与方法 1.1 仪器与材料试验所用检测仪器为气相色谱-质谱联用仪,型号TSQ Quantum XLS(热电,美国),色谱柱为HP5-MS,自动化顶空萃取进样器型号TriPlus(热电,美国).自动顶空萃取纤维型号50/30 m,DVB/CAR/PDMS(Supelco,美国).玻璃纤维膜孔径0.7 m (Whatman,英国).
目标物标准样品(目标物性质见表 1) 与内标物2-异丁基-3-甲氧基吡嗪(2-Isobutyl-3-methoxypyrazine,IB)均为色谱纯(Sigma,美国),使用前用Milli-Q超纯水稀释至所需浓度.甲醇为色谱纯,纯度不低于90 %(Sigma,美国).NaCl、NaOH和HCl(用于调节pH)为分析纯(国药集团化学试剂有限公司,中国).
| 表1 5种嗅味物质物化性质 Table 1 Physical and chemical properties of 5 T&O compounds |
 |
| 点击放大 |
1.2 实验方法 1.2.1 气相色谱-质谱条件
气相色谱(GC)条件:使用高纯氦气(99.999 %)作为载气,柱中流速为1.00 mL/min.分流进样,分流时间1 min,分流速度为30 mL/min.柱温初始为60 ℃,保持3 min,以6 ℃/min 升温至150 ℃,再以15 ℃/min升温至250 ℃,进样口温度为250 ℃.
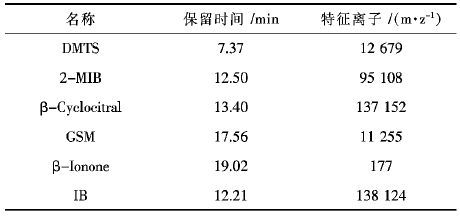
质谱(MS)条件:电子轰击源(EI),离子源温度200 ℃,接口温度为250 ℃,离子扫描范围为 m/z 40 ~ 220,扫描时间为5.0 ~ 20.27 min,选用SIM模式时各物质特征离子及出峰时间见表 2.
| 表2 5种物质和内标物质保留时间与特征离子 Table 2 Characteristic mass ions and retention time for 5 T&O compounds and internal standard content |
 |
| 点击放大 |
1.2.2 自动化顶空萃取预处理方法条件
采用自动化顶空萃取方式富集水中痕量嗅味物质,根据以往研究选取萃取材料为DVB/CAR/PDMS,萃取时间选取30 min,萃取温度为65 ℃,样品体积为10 mL,加入3 g NaCl,促进目标物挥发[12],萃取后转入GC进样口解吸2 min.
1.2.3 藻类样品测试取处于对数生长期的假鱼腥藻(中国科学院武汉水生所藻种库购买)藻液(藻类密度3.0×105 万个/L),吸取1 mL,加入内标物质IB(20 ng/L),稀释至10 mL,放入自动萃取装置进行萃取测定.
2 结果与讨论 2.1 SCAN模式与SIM模式下测定结果由于SCAN模式条件,质谱仪检测样品的特异性较低,因而选择较高浓度样品(5 g/L),以保证各物质均能够正常检出.通过萃取得到结果如图 1表示:由图 1可以发现,仪器基线平整,而各物质峰几乎无拖尾现象,分离效果较好.同时,利用检索库可以检测到目标物即5种嗅味物质均有检出,其中GSM峰值最高最为明显,2-MIB以及IB等物质其次,DMTS最差,且有稍许拖尾状况出现,这与物质结构,以及色谱柱材料流失有关,通过检索库搜索发现,在紧邻DMTS物质峰的旁边(保留时间RT = 7.90 min)有一色谱柱材料流失峰,但5种物质均能检出且峰形明显.
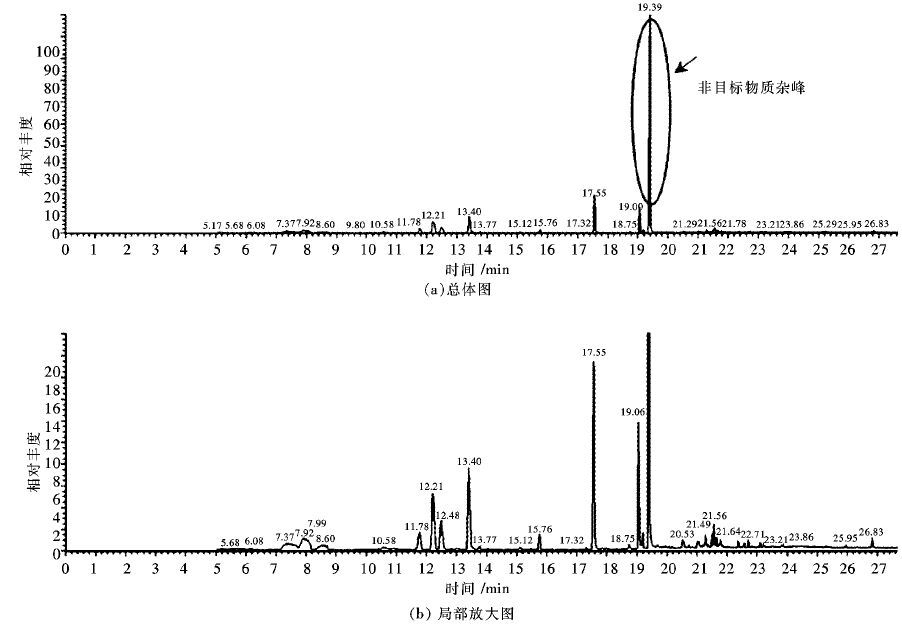 |
| 图 1 SCAN模式标准样品色谱图 Fig. 1 GC-MS-SCAN chromatograms of standard sample |
随后根据各自保留时间(见表 2) 以及特征离子,设定SIM模式扫描.由于SIM模式用于特征扫描,因为降低配制样品浓度至1 000 ng/L.检测得到色谱图见图 2:可以发现利用SIM模式后,基本没有杂峰出现,目标物质虽然浓度下降,但是其峰形状依然保持良好,峰面积较高,说明萃取方法较为合适,仪器检测效果较好.
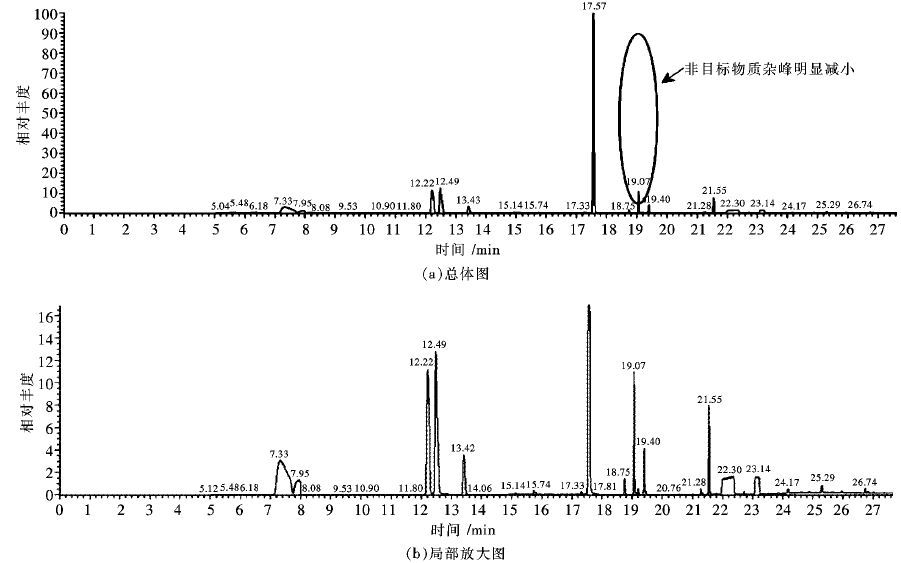 |
| 图 2 SIM模式标准样品色谱图 Fig. 2 GC-MS-SIM chromatograms of standard sample |
2.2 目标物标准曲线建立
SIM模式下优化萃取条件、各段检测时间以及特征离子后,用母液配置0,5 ng/L,20 ng/L,80 ng/L,500 ng/L和1000 ng/L的5种组分与20 ng/L内标物IB的混合标准溶液进行标准曲线的建立.5种物质在0 ~ 1 000 ng/L范围内线性均保持良好,回归系数R2> 0.98(见图 3) .
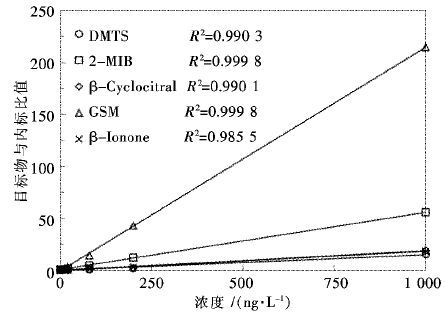 |
| 图 3 目标物质标准曲线与相关性 Fig. 3 Standard curve and relativity for analytes |
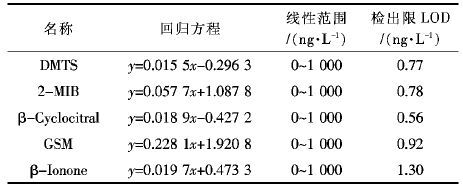
采用3个超纯水加标(20 ng/L)样品进行平行测定,分别计算各物质标准偏差(SD),利用检出限计算公式(1) 得到各物质采用该方法的检出限(limit of detection).
| $LOD{\rm{ }} = {\rm{ }}SD{\rm{ }} \times t\left( {n - 11 - a{\rm{ }} = {\rm{ }}0.95} \right)$ | (1) |
其中t(n-1,1-a = 0.95) 是自由度为n-1,可信度为95 %时的t分布函数.当n=3时,t=2.920,得出各嗅味物质检出限为0.56~1.3 ng/L(见表 3) ,相比较传统方式的固相微萃取预处理方式,其检测限并没有明显增加,反而个别还有所下降[9],可能造成的原因为自动萃取装置为震荡方式,其剧烈程度并不如传统的磁力搅拌方式强烈.但由于自动萃取能够保证萃取条件不受操作人员不同而变化,检测平行样品时标准偏差小,同时节省大量操作时间,因而对于检测大量样品来说,仍有明显的优势.而最高的1.3 ng/L检测限也能够较为精确的保证检测水体中嗅味物质的要求,因此该方法是一种良好的检测方法.
| 表3 5种物质标准曲线线性关系及检出限 Table 3 Linear relationships standard curves and limit of detection |
 |
| 点击放大 |
2.3 藻液样品分析检测
利用本检测方法,对处于生长对数期的假鱼腥藻藻液进行测定,其样品检测结果(图 4) 表明该检测方法对于复杂的水样,特别是富含多种蛋白质、氨基酸、腐植酸以及藻源胞内外有机物的含藻水样,其检测效果较好,干扰杂峰较少,目标物峰值较高.从数值计算发现,该种藻液中存在2种典型嗅味物质2-MIB与β-Ionone,其各自浓度分别为136.78 g/L与1347.88 ng/L,平均单个藻细胞产嗅味物质量为0.45 pg/cell 与4.49 × 10-3 pg/cell,对比以往研究能说明该种藻类能够产生典型嗅味物质,在饮用水处理中应当注意对其的控制[13].
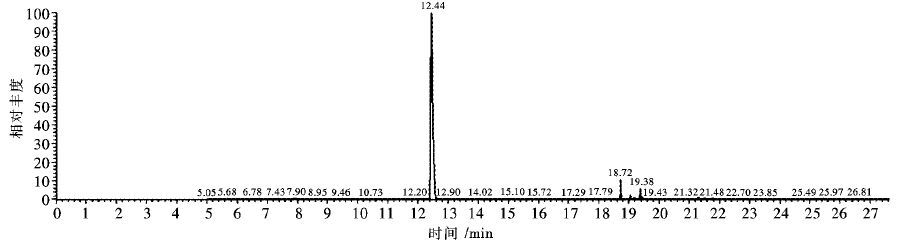 |
| 图 4 SIM模式藻液样品色谱图 Fig. 4 GC-MS-SCAN chromatograms of alga sample |
3 结论
1) 采用自动化顶空萃取装置结合气相色谱质谱联用技术,简单且易于操作,同时条件控制精确,重现性高,增强了定量分析嗅味物质的能力.
2) 为嗅味物质检测与研究过程中遇到的大量样品测定提供了可行方法.
3) 可以同时有效的检测复杂水体中典型嗅味物质含量,并且避免传统萃取技术所带来的操作复杂、耗时长、人为误差大等缺点,适用于大量水体样品中痕量嗅味物质的定量分析检测.
| [1] |
Suffet I H, Corado A, Chou D, et al. AWWA taste and odor survey[J].
Journal of the American Water Works Association, 1996, 88(4): 168–180. |
| [2] | 靳朝喜, 李怀超, 邱颖, 等. 饮用水处理中嗅和味的去除研究进展[J]. 北方环境, 2010, 22(3): 50–53. |
| [3] | 李伟光, 郜玉楠, 黄晓东, 等. 高锰酸钾与粉末活性炭联用去除饮用水中嗅味[J]. 中国给水排水, 2007, 23(5): 18–21. |
| [4] | 徐盈, 黎雯, 吴文忠. 东湖富营养水体中藻菌异味性次生代谢产物的研究[J]. 生态学报, 1999, 19(2): 212–216. |
| [5] |
Young C C, Suffet I H, Crozes G, et al. Identification of a woody-hay odor-causing compound in a drinking water supply[J].
Water Science and Technology, 1999, 40(6): 273–278. DOI: 10.1016/S0273-1223(99)00568-5. |
| [6] |
Lei L, Naiyun G, Yang D, et al. Characterization of intracellular & extracellular algae organic matters (AOM) of Microcystic aeruginosa and formation of AOM-associated disinfection byproducts and odor & taste compounds[J].
Water Research, 2012, 46(4): 1233–1240. DOI: 10.1016/j.watres.2011.12.026. |
| [7] |
Zimba P V, Grimm C C. A synoptic survey of musty/muddy odor metabolites and microcystin toxin occurrence and concentration in southeastern USA channel catfish (Ictalurus punctatus Ralfinesque) production ponds[J].
Aquaculture, 2003, 218(112/314): 81–87. |
| [8] |
Davies J M, Roxborough M, Mazumder A. Origins and implications of drinking water odours in lakes and reservoirs of British Columbia, Canada[J].
Water Research, 2004, 38(7): 1900–1910. DOI: 10.1016/j.watres.2004.01.008. |
| [9] | 毛敏敏, 张可佳, 张土乔, 等. 大体积浓缩-固相微萃取-气相色谱-质谱联用测定水样中6种典型嗅味物质[J]. 分析化学, 2013, 5(5): 760–765. |
| [10] | 张锡辉, 伍婧娉, 王治军, 等. HS-SPME-GC法测定水中典型嗅味物质[J]. 中国给水排水, 2007, 23(2): 78–82. |
| [11] | 魏魏, 郭庆园, 赵云云, 等. 顶空固相微萃取-气质联用法测定水中7种致嗅物质[J]. 中国给水排水, 2014, 30(18): 131–135. |
| [12] |
Buchholz K D, Pawliszyn J. Optimization of solid-phase microextraction conditions for determination of phenols[J].
Analytical Chemistry, 1994, 66(1): 160–167. DOI: 10.1021/ac00073a027. |
| [13] |
Li Z L, Hobson P, An W, et al. Earthy odor compounds production and loss in three cyanobacterial cultures[J].
Water Research, 2012, 46(16): 5165–5173. DOI: 10.1016/j.watres.2012.06.008. |
 2016, Vol. 6
2016, Vol. 6

