| 云母氧化铁的合成及表征 |
云母氧化铁可分为天然云母氧化铁和人工合成云母氧化铁两种.天然云母氧化铁杂质含量多,粒度分布不均.人工合成的云母氧化铁呈正六边形片状,表面平坦光滑、杂质含量少、粒径可控、粒度分布均匀、光亮感与立体感强、颜色多样,应用时比天然云母氧化铁有更大的优势[1].云母氧化铁具有较独特的鳞片状结构,可作为珠光颜料的基片,也是桥梁、车辆等高档防锈漆的主要原料之一,在珠光颜料、防腐蚀涂料、填料等领域起着重要作用.主要用于高档珠光颜料、防腐功能涂料、化妆品以及其他功能涂料方面[2].
云母氧化铁的主要制备方法主要有:机械加工法(主要针对天然云母氧化铁)、水热法(目前运用较广泛的一种方法)、高温熔盐法、气相法(较少使用).本文采用熔盐法、根据晶体生长习性[3]、熔盐法原理[4]及氧化铁的晶型转变[5-6]特点设置多个实验参数,探究合成云母氧化铁的最佳工艺条件.
1 实验 1.1 DTA-TG曲线为确定熔盐体系在加热过程中发生物理化学变化及对应的重要温度点,以制定工艺参数及条件,首先对熔盐体系进行差热(DTA)、热重分析(TG),体系由Fe0.99Al0.01(OH)3-δ,Na2SO4+K2SO4及(NH4)2SO4组成.得到的差热、热重曲线见图 1.
 |
| 图 1 Fe(OH)3/Fe(OH)2+Na2SO4+K2SO4体系的差热-热重曲线 Fig. 1 DTA-TG of Fe(OH)3/Fe(OH)2+Na2SO4+K2SO4 |
上图 1为样品的DTA-TG曲线,样品由(NH4)2Fe(SO4)2)与熔盐及添加剂加入蒸馏水配成饱和溶液,与碳酸钠溶液反应后经烘干后得到的,其中含有Fe0.99Al0.01(OH)3-δ,Na2SO4+K2SO4及(NH4)2SO4•xH2O.从图 1中可以看出,TG曲线在100℃-360℃之间显示出样品出较大的失重,这是由于粉体吸附水的蒸发及(NH4)2SO4•xH2O失去结晶水造成的,对应的DTA曲线在150℃处出现一个吸热峰;样品在TG曲线上360℃-620℃之间也显示较少量的失重现象,对应Fe0.99Al0.01(OH)3-δ分解为Fe2O3和Fe3O4而失水,且在570℃左右发生Fe2O3的结晶,对应的DTA曲线在570℃左右整体显示放热现象.TG曲线在620℃-850℃之间也显示出较大的失重,这是(NH4)2SO4分解为气体挥发引起的,可能是由于熔盐的少量挥发造成的. 由此,根据体系中熔盐的熔融温度及α-Fe2O3分解与结晶温度,在制定合成工艺时,温度的选择应在850℃以上,以促进结晶的进行.
1.2 样品的制备称取一定比例的硫酸亚铁铵(NH4)2Fe(SO4)2)与所需熔盐及添加剂,蒸馏水配成饱和溶液,与碳酸钠溶液反应,再向制得的沉淀氧化至红褐色.将得到的红褐色沉淀放至160℃烘箱中烘干后烧结到指定温度并保温一定时间后自然冷却,然后将所得样品洗涤干燥.
1.3 样品的表征运用图像分析仪BT-1 600 对样品的晶体结构及表面等进行定性分析,确定较好的片状样品形态;XRD图谱对物相的组成及晶体的晶胞参数的变化提供了依据;扫描电镜显示了样品颗粒分布均匀性及清晰的表面形貌.
2 结果与讨论从晶体生长[7]的角度出发,需构建一定的熔盐体系,使得生长基元能够垂直于c轴定向生长[8-11].因此我们探讨了熔融处理时不同条件对氧化铁晶体形貌造成影响的原因.
2.1 实验工艺条件对样品形貌的影响 2.1.1 熔盐处理温度对样品形貌的影响温度处理是熔盐法制备片状氧化铁各步骤中较为关键的环节,根据熔盐法原理[12],温度在熔点范围内,随着温度的升高,扩散系数增大,黏度降低,离子和空位扩散及颗粒重排和粘性塑性流动过程加速,越有利于晶体的生长.
 |
| 图 2 在R=5,保温4h下,不同的烧结温度得到的样品显微图 Fig. 2 CLSM when R = 5,heat preservation= 4 h,at different sintering temperature |
图 2 为采用硫酸复盐、熔盐比为5:1 时,烧结不同的温度,保温4 h后得到的样品的光学显微分析图.当烧结温度为1 000 ℃时,基本没有得到α-Fe2O3,而是生成了大量的黑色颗粒Fe3O4,当温度为1 100 ℃时,生成了少量的片状氧化铁,黑色颗粒团聚减少;当烧结温度为1 150 ℃时,基本均为片状氧化铁,而且具有较好的表面形貌,分布较均匀.继续升高温度时,样品形貌改善不大且温度过大时,反而使片的厚度过大,且表面平整性变差,而且会造成能源的浪费.因此样品在烧结温度为1 150 ℃时为宜.
具有这种规律的原因可由熔盐烧结机理[13]来解释.随着烧结温度的升高,液相的黏度降低,离子间距增大,相互作用力下降,促进了颗粒重排和物质质量传递过程,加速烧结过程,利于晶体的生长.但当温度过高时,由于颗粒重排和传质速率过快,晶体生长空间较大,易引起二次再结晶或间断性晶粒长大.同时,温度升高会促进晶粒的致密化,但晶粒致密度增大到一定程度后,晶粒的径向生长受到阻碍,而温度的继续升高就会促进晶粒在c轴方向上的生长,使片的厚度增加.
2.1.2 保温时间对样品形貌的影响熔盐法制备片状氧化铁工艺中,延长烧结时间一般会不同程度地利于粉体结晶,促使烧结完成.但在烧结后期,保温时间过长,有时会加剧二次再结晶作用[14],反而不利于样品晶粒的正常长大,尤其是对片状粉体的合成.本实验选取烧结温度为1 150 ℃,熔盐比为5 的条件下,图 3为五个不同的保温时间下得到的样品的光学显微图.
 |
| 图 3 在T=1150℃下,不同的保温时间得到的样品光学显微图 Fig. 3 CLSM at the different heat preservation time when T = 1150 ℃ |
图 3中可看出,当保温时间为1 h时,烧结时间过短,氧化铁生长基元来不及择优叠加生长,制得的样品中存在大量的黑色颗粒状Fe3O4 ;当保温时间延长时,粒径增大,但当保温至4 h和5 h时,颗粒变得很不均匀,存在异常长大的颗粒,且小粒径颗粒较多;同时,保温时间较长时,片的厚度增加,表面平整性变差.
依据熔盐化学理论[12],随着反应时间的增长,反应进行的越完全,也就越利于晶体的生长和成形,使所得产品性能更稳定.但是达到一定的界限,再延长烧结时间对改变晶体形貌意义不大,甚至会有负面影响.当烧结时间过短时,体系只达到了自由能损失最小的状态,生长基元来不及择优叠加生长.产物中有较多的黑色颗粒状粉体附着在片状粉体表面,说明氧化铁晶粒的形成或生长时间不足,反应仍不充分,当反应达到2 h以后,产品形貌基本上达到光滑平整.当过多延长保温时间时,一方面会造成二次再结晶现象的产生;另一方面,粒径径向生长到一定程度后,晶粒之间会相互接触,阻碍了继续长大,从而促进了晶粒在c轴方向的生长[15],使厚度增加.
2.2 熔盐的选择对样品形貌的影响 2.2.1 熔盐种类对样品形貌的影响在熔融处理过程中,熔盐种类对粉体的形貌具有较大的影响,图 4 所示为不同熔盐体系在1000 ℃下,烧结4 h得到的粉体在图像分析仪中放大5倍时拍摄的光学显微图片.
 |
| 图 4 不同熔盐种类所得样品的显微图 Fig. 4 the morphology of samples from different types of molten salt |
图 4中可以看出在氯盐体系中得到的样品为黑色颗粒状,没有得到片状氧化铁.而在氯盐与硫酸盐的复盐体系中可得到片状氧化铁,但由于温度的限制,得到的片状样品粒径较小,且存在少量的黑色颗粒Fe3O4 .而且氯盐体系于1 100 ℃,保温4 h条件下烧结样品时,坩埚中的原料几乎完全挥发掉,没有得到产物,而且对仪器设备也造成了一定的损害.
因此可看出,在氯化物、硫酸盐、及氯化物与硫酸盐的复合盐等不同熔盐中,氧化铁生长基元[16-18]的不同,使得所合成的粉体的晶体形貌产生较大差异.由于氯化物离子数比硫酸盐的低,因此离子强度较低,传质速度比硫酸盐的快而且较均匀,从而可使生长基元能够充分移动,因此晶粒结合过程中可有一个短暂的时间来调整晶粒间取向,晶体可自由生长,则较难形成片状;在硫酸盐中,由于硫酸根具有强离子作用,晶粒在结合过程中不能择优生长,而是使由负离子配位多面体按一定方式联结成的生长基元能垂直于c轴定向生长,同时硫酸盐溶解度好,有利于晶体生长成为片状结构,但可能粒径分布不太均匀;而选择氯化物与硫酸盐混合的复合盐,可能会克服两者的不足,使得合成的样品成片性能好且分布均匀.
2.2.2 不同的钠钾盐比对样品形貌的影响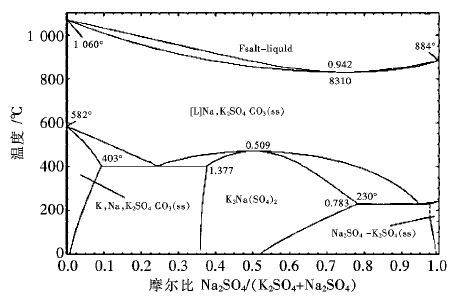 |
| 图 5 K2SO4-Na2SO4相图 Fig. 5 phase diagram of K2SO4-Na2SO4 |
图 5为K2SO4-Na2SO4助熔剂的二元相图,当助熔剂的配比Na2SO4 :K2SO4 =3 :l (0.742:0.258) 时,在831℃有一同成分熔化点.在此温度下,K2SO4 -Na2SO4 发生共晶熔化形成一个熔液相,温度远低于两者的熔点.因此,复合助熔剂一般具有较好的溶解能力,可减低反应体系的温度,使晶体成核与生长的环境更加稳定,得到的晶体形状更规则.由于熔融状态下,钠盐与钾盐在同一温度下的黏度不同,并且钠、钾离子具有不同的性质,因此不同的钠钾盐比例对样品影响较大.
 |
| 图 6 T=1150℃,t=3h下,不同的钠钾盐比样品显微图 Fig. 6 CLSM under different proportion with Na and K salt when T = 1150 ℃,t = 2 h, |
图 6中分别是在钠:钾盐物质的量比为(1:0.5) 、(1:1) 、(1:1.25) 、(1:1.5) 条件下烧结1 150℃、保温3 h后得到的样品显微相貌.从图 6中可看出,当Na+:K+=1:0.5 与Na+:K+=1:1.25 时,粉体颗粒粒径分布较均匀,表面光滑平整;当Na+:K+=1:1/1.5 时,粉体成片大小分布不均匀,存在少量异常长大的较大晶粒,较小晶粒表面较平整.因此,当熔盐中钠:钾盐摩尔比例为1:1.25 时,效果较好.
这是由于Na+的离子半径比K+更小,对Fe3+的斥力和引力都相对更强,因此氧化铁晶粒生长时受到的阻力更大.因此,适当增加钾盐比例可使片的尺寸显著增大,当钾盐比例过多时,可能会造成产品片的厚度增加,样品效果不理想.
2.3 添加剂及其用量对样品形貌的影响在熔盐体系中,添加剂[19-22]能与烧结物形成固溶体,使晶格畸变而得到活化,故可降低烧结温度和保温时间.α-Al2O3 与α-Fe2O3 具有相同的晶体结构,Al3+可以进入α-Fe2O3 的晶格,进而取代Fe3+,影响α-Fe2O3 生长基元的结构形式与稳定性,促进氧化铁的结晶.因此,我们对掺杂了Al3+的样品进行了扫描电镜测试,其测试结果如下图 7所示.
 |
| 图 7 掺杂1% Al3+样品的SEM图片 Fig. 7 SEM of sample with 1%Al3+ |
图 7为掺杂1%Al3+所得样品的SEM图片,图中显示了所得样品粒径的分布均匀性、片的厚度(约在1-2μm左右)和清晰的表面形貌,且绝大部分颗粒呈现片状且表面较光滑,但也存在少量的成片和没有成片的较小颗粒.这些小颗粒的存在,由于位于坩埚底部的原料与氧接触不充分,没有被充分氧化和分解为α-Fe2O3,另一方面可能是盐的分布不均匀,保温时间又不够充分,没有为它们提供较好的传质熔融环境.从右边图中显示有些颗粒表面不光滑,出现凹凸不平的台阶,这是在晶粒生长的过程中,由于晶体在结构上的各向异性,不同的晶体表面具有不同的表面能,这就造成了各晶面生长速率的差异;但晶体的实际形态不仅受自身分子结构的限制,还受其他多方面因素,如生长条件和环境的影响.在熔盐体系中,在样品被烧结的过程中,其外界条件发生的微小变化,都可能会影响了晶体在各个面上的生长速率,造成了面上的凹凸不平.
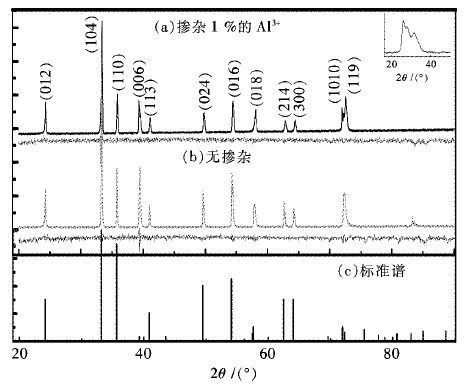 |
| 图 8 掺杂Al3+与未掺杂样品的XRD图谱 Fig. 8 XRD of samples with Al3+ and without Al3+ |
图 8为在掺杂Al3+与不进行掺杂的情况下所得样品的XRD图谱,两谱中的峰位均与α-Fe2O3的标准峰位吻合,且通过物相检索,除α-Fe2O3外没有检索出其他物相.但掺杂了Al3+的样品(样a)的谱图中,在衍射角为晶面指数为(006) 处(40度左右)出现峰的分裂,是由于掺杂进入某些晶体的晶格当中取代部分的Fe3+,而Al3+的离子半径Fe3+的较小,使得该点位的晶面间距减小,根据布拉格方程,相对应的衍射角增大,即对应的XRD图谱峰值右移,而由于参入量掺杂量的限制,只有部分的晶粒被掺杂进去,所以出现在该点位的峰的分裂变宽.对图谱拟合后,样a的晶胞参数相对于未进行掺杂的样品(样b)晶胞参数,在a轴方向上产生缩小,而在c轴方向上拉伸了,晶胞体积V减小.其中两样品的晶胞参数分别为(样a,a=5.00128、c=13.7410(7) 、V=297.66A3; 样b,a=5.02262、c=13.70453、V=299.41A3).在a轴上的缩小也说明了Al3+进入α-Fe2O3 的晶格,取代了部分的Fe3+,使得该轴上的参数变小,晶胞体积相应减小.而少部分Al3+进入晶格中的间隙位置,使得键角和键长发生变化,引起晶胞在c轴方向上的轻微拉伸.
添加剂的用量的不同,Al3+ 取代Fe3+ 的程度就不同,对晶体的形貌会造成一定的影响.在一定的范围内,随Al3+量的增大,样品的粒径应逐渐较小,片变薄,均匀性提高.当Al2O3 量过少时,Al3+ 取代Fe3+ 的程度较少,可能会使部分片状样品的粒径较大,而被Al3+ 取代的晶粒粒径较小,且厚度较薄,粒径分布不太均匀.当Al3+量过多时,可能会造成样品粒径过小,片较薄.下图 9为T=1 150 ℃,保温4 h条件下,分别加入1 %、2 %、3 %和4 %的Al3+得到的样品的显微形貌图.
 |
| 图 9 在T=1 150℃,保温4h下,添加剂用量对样品形貌的影响 Fig. 9 the influence of the dosage of additives on CLSM when T=1 150℃ and t=4h |
由图 9中可看出四组样品的结晶形貌均较好,表面较平整光滑.随添加剂用量的增加,样品的片的大小均匀性变好,且对于我们在珠光颜料中的应用片的大小较适中,颜色逐渐较鲜艳.而由于添加剂用量的增加会使片减小,因此,添加剂用量不宜过多,以4 %为宜,这主要归因于Al3+ 取代Fe3+ 的程度的不同.
3 结论1) 随熔盐处理温度和保温时间的升高与增加,氧化铁的成片表面的光滑度逐渐变好,当温度过高或保温时间过长时,样品成片过大,反而不利于我们在珠光颜料中的应用.
2) 不同熔盐中,由于硫酸根具有强离子作用,晶粒在结合过程中就不能择优生长,而是使由负离子配位多面体按一定方式联结成的生长基元能垂直于c轴定向生长,同时硫酸盐具有较高的溶解能力,因此利于晶体生长成为片状结构.
3) K+对Fe3+的斥力和引力都相对更强,适当增加钾盐比例可使粒径显著增加,当钾盐比例过多时,会造成产品片的厚度增加,样品效果不理想.
4) Al3+的加入可改变晶胞参数、改善样品的表面形貌、使表面光滑,利于成片,且一定范围内,随着Al3+加入的增加合成样品的成片逐渐变小,颜色鲜艳,因此不宜加入过多.
| [1] | 王晓霞,叶红齐.熔盐法合成片状氧化铁粉体的研究[D].长沙:中南大学学报,2006,3(6),6-78. |
| [2] | 王莉玮, 袁占辉, 林棋. 新型片状氧化铁的合成以及在珠光颜料中的应用[J]. 闽江学院学报, 2013(02): 113–118. |
| [3] | Teruaki Danno, Daisuke Nakatsuka, Yoshihiro Kusano, et al.Crystal structure of β‑Fe2O3 and topotactic phase transformation to α-Fe2O3 [J]. Crystal growth design.2013, 13, 770-774. |
| [4] | George W. Par shall. Catalysis in molten salt media[J]. Journal of the American Chemical Society.1972, 12(3):8716-8723 |
| [5] | Petr Brázda, Jaroslav Kohout, Petr Bezdic ka, et al. α-Fe2O3 versus β-Fe2O3: controlling the phase of the transformation product of γ-Fe2O3 in the Fe2O3/SiO2 system[J]. Crystal growth design.2014, 14, 1039-1046. |
| [6] | Ross Macdonald, Russell F. Howe, Sina Saremi-Yarahmadi, et al. Photoinduced super paramagnetism in nanostructured α-Fe2O3 [J]. The Journal of Chemistry letter.2010, 1, 2488-2492. |
| [7] | 袁晰,叶红齐,刘辉.片状α-Fe2O3的制备及其生长机理[J] 中南大学学报(自然科学版) 2010(5):1718-1723. |
| [8] | 施尔畏, 陈之战, 元如林, 等. 水热结晶学[M]. 北京: 科学出版社 , 2009. |
| [9] | 孙桂贤, 李云华, 葛琦, 等. 金云母-氧化铁珠光颜料的制备及性能研究[J]. 非金属矿, 2012(03): 52–54. |
| [10] |
Zhu X, Zhu Y, Murali S, et al. Nanostructured reduced graphene oxide/Fe2O3 composite as a high-performance anode material for lithium ion batteries[J].
American Chemical Society, 2011, 5(4): 3333–3338. |
| [11] | Chin-Cheng Weng, Chen-Ping Chen, Ching-Hua Ting, et al. Using a solution crystal growth method to grow arrays of aligned, individually distinct, single-crystalline TiO2 nanoneedles within nanocavities [J]. Chem. Mater. 2005, 17, 3328-3330. |
| [12] |
BENSON, R, SUNDHEIM, JOSEPRHO SENSTREXH. Molten salt thermocells[J].
JJournal of the American Chemical Society, 1959(6): 419–422. |
| [13] | 龙翔, 陈雯, 叶红齐. 熔盐法制备珠光颜料用片状氧化铝[J]. 粉末冶金材料科学与工程, 2011(01): 73–79. |
| [14] | Kimura, T. Molten Salt Synthesis of Ceramic Powders; Sikalidis,C., Ed.; InTech: Shanghai, China, 2011. |
| [15] |
Mann A K P, Fu J, Desantis C J, et al. Spatial and temporal confinement of salt fluxes for the shape-controlled synthesis of Fe2O3 nanocrystals[J].
Chemistry of Materials, 2013, 25(9): 1549–1555. DOI: 10.1021/cm3038087. |
| [16] | 王玉香. 新型稀土变色珠光颜料的研究[D]. 江西理工大学, 2009. |
| [17] |
Sakthivel R, Vasumathi N, Sahu D, et al. Synthesis of magnetite powder from iron ore tailings[J].
Powder Technology, 2010, 201(2): 187–190. DOI: 10.1016/j.powtec.2010.03.005. |
| [18] | 李功军, 李振民, 刘跃进. 云母氧化铁珠光颜料的研究[J]. 湖南工程学院学报, 2004, 14(2): 70–73. |
| [19] |
Xuan W, Whitty K J, Guan Q, et al. Influence of Fe2O3 and atmosphere on crystallization characteristics of synthetic coal slags[J].
Energy & Fuels, 2015, 29(1): 405–412. |
| [20] | 曹付玲, 吴育飞, 刘辉, 等. 掺铝铁饼状α-Fe2O3微粒的制备及性能[J]. 化学学报, 2008, 66(12): 1405–1410. |
| [21] | 刘瑞辉, 张存满, 马建新. 具有良好热稳定性的A12O3改性Fe2O3基金催化剂[J]. 物理化学学报, 2009, 25(l): 2261–2269. |
| [22] | 朱骥良, 吴申年. 颜料工艺学[M]. 北京: 化学工业出版社精细化工出版中心 , 2002: 13-15. |
 2016, Vol. 6
2016, Vol. 6


