| 直流电协同锌板置换提镉的工艺实践 |
重金属镉是铅锌冶炼的副产物[1],特别是在湿法炼锌过程中,随锌一起浸出,净化处理时富集到铜镉渣中,经硫酸浸出除铜后采用锌粉置换或电解沉积的方法提取镉[2-4].现有技术中应用最为广泛的以铜镉渣为原料的提镉工艺[5-8]为:浸出-锌粉置换-海绵镉造液-净化-镉电解沉积-阴极镉熔化铸锭.该工艺[9-11]具有锌粉消耗量大,生产成本高,生产的海绵镉易被包覆,纯度不高等缺点.现针对以上问题结合湘江流域大型铅锌冶炼企业湿法炼锌存在的镉浸出率低、浸出过程中镉、铜、钴难以分离、镉在各段工序易分散污染且其回收率低的现象[12-15]提出一种行之有效的解决方案.
本文提出直流电协同锌板置换提镉的方法,实验室小试条件考察了电流密度、温度及极距等因素对反应效率的影响.结果表明,在电流密度为100 mA/m2、极距为3 cm、温度40 ℃的条件下提镉率可达96 %以上,考虑到工业实际操作环境及条件的复杂性,据此,将工艺实践的试验条件确定为:电流密度125~75 A/m2,电解液温度30~60 ℃,阴阳极间距9~10 cm.由此可见,采用直流电协同锌板置换的方法一步提取海绵镉,简化生产步骤,降低生产成本,可为以后的工业化生产提供指导.
1 试验原料试验所用为某厂浸出车间产出的铜镉渣的一次硫酸浸出液,其元素组成如表 1所示.
| 表1 铜镉渣浸出液元素成分 /(gL-1) Table 1 Compositions of leaching solution from copper-cadmium slag |
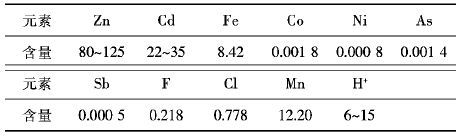 |
| 点击放大 |
置换所用锌板含锌99 %以上,尺寸为80 cm×62 cm.
2 试验设备、原理及方法 2.1 试验设备本实验所用反应槽结构如图 1所示.置换反应槽外部尺寸为4 150 mm×1 575 mm×1 000 mm,内部有效体积约4 m3.采用锌板阳极,起置换作用,含锌99 %以上.纯铝板阴极,尺寸为80 cm×62 cm,实际有效大小为60 cm×60 cm,与置换锌板大小相同.用铜片连接电源和电极,实现直流电与锌板置换的协同作用,提高反应效率.所用电源为硅整流器,其型号参数为:GHS-8000/160.
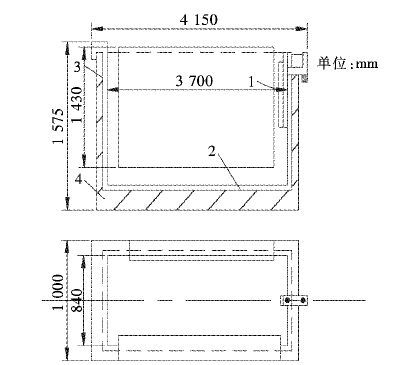 |
| 1.溢流堰;2.软聚氯乙烯塑料衬里;3.沥青油毛毡;4.槽体 图 1 反应槽结构图 Fig. 1 structure of reaction cell |
2.2 试验原理
在水溶液中用一种金属取代出另一种金属的过程叫做置换.根据热力学原理,标准电极电位负的金属都可以置换出溶液中标准电极电位较正的金属离子.因此,置换反应的次序决定于在水溶液中金属的标准电位次序,而且置换趋势的大小决定于它们的电位差.根据能斯特公式和原液中各金属离子含量可计算得到各金属离子的实际电极电位,计算式为式(1) :
| $\phi ={{\phi }^{0}}+\frac{0.0591}{n}\log (a_{Me}^{n+})$ | (1) |
通过查找数据可知Zn的标准电极电位为-0.76 V,镉为-0.403 V,因此它们在溶液中的电极电位计算式为式(2) 和式(3) :
| ${{\phi }_{Zn}}=-0.76+0.0295\log (a_{Zn}^{2+})$ | (2) |
| ${{\phi }_{Cd}}=-0.403+0.0295\log (a_{Cd}^{2+})$ | (3) |
对于锌粉置换镉反应的电位差为式(4) :
| $U=\phi _{C{{d}^{2+}}/Cd}^{\Theta }-\phi _{Z{{\text{n}}^{2\text{+}}}/Zn}^{\Theta }+0.0295\log \frac{{{a}_{C{{d}^{2+}}}}}{{{a}_{Z{{n}^{2\text{+}}}}}}$ | (4) |
当U=0时反应达到平衡,此时
本文提出的锌板置换协同直流电作用下提镉,即在置换过程中辅之以微电流的作用,锌板不断地失去电子使锌板溶解变成锌离子,进入溶液中.一方面促进了锌片表面的点蚀,使置换比表面积增大,活性增强,另一方面促进了置换过程锌的负电位和镉的正电位之间的电位差,所以促进了置换过程.反应方程式为式(5) ~式(8) :
阳极:
| $\text{Zn-2}{{\text{e}}^{\text{-}}}\text{=Z}{{\text{n}}^{\text{2+}}}$ | (5) |
| $\text{Zn+C}{{\text{d}}^{\text{2+}}}\text{=Z}{{\text{n}}^{\text{2+}}}\text{+Cd}$ | (6) |
| $\text{Z}{{\text{n}}^{\text{2+}}}\text{+2}{{\text{e}}^{\text{-}}}\text{=Zn}$ | (7) |
| $^{\text{2+}}\text{+2}{{\text{e}}^{\text{-}}}\text{=Cd }$ | (8) |
试验以锌板为置换板(阳极),铝板为导电板(阴极),以铜镉渣一次浸出液为反应原液,在反应槽通以微电流的作用下进行置换提镉.过程控制电流密度125~75 A/m2,溶液温度30~60 ℃,阴阳极间距9~10 cm,未反应完的锌板可在下次反应中继续使用直至溶穿,阴极不参与反应,可重复多次使用.实验基本步骤为:
1) 装槽前准备:向反应槽中泵入浸出液,待溶液温度降到设定温度后计量初始反应液体积,并取样分析溶液组成;
2) 以锌板为阳极,以铝板为阴极,按反应槽尺寸以及设定的同极距大小进行阴阳极板的布置,按照设定的电流密度通电进行电置换;
3) 定时刮去阳极表面的置换出的海绵镉,并取溶液20 mL,分析Zn、Cd含量和酸度,取反应得到海绵镉分析其中Zn、Cd的含量;
4) 置换反应结束后阴阳极出槽.分析残液中Zn、Cd含量和酸度;反应后液通过压滤机得到滤液与海绵镉,分析滤液中海绵镉纯度以及滤液中Zn、Cd含量;
5) 加入新鲜浸出液,装入阴阳极进行下一槽置换.
3 结果与讨论试验过程中对主要元素锌、镉及溶液酸度变化进行实时监测,并对最终得到的产品海绵镉进行共4槽实验,反应结束后对每槽海绵镉取样进行ICP全分析、X-射线衍射(XRD)分析后,同时对所得产品进行电镜扫描(SEM)表征,对其微观形态进行分析.
3.1 各槽试验条件对比试验共进行4次,所选试验条件均根据实验室条件优化的基础上有所调整,各槽条件如表 2所示.
| 表2 各槽试验条件对比 Table 2 The contraction of experiment conditions between each cell |
 |
| 点击放大 |
试验原料来源于铜镉渣除铜一次浸出液,未经处理,反应无添加剂,各元素初始含量与原来矿物及前工序操作条件有关,本实验条件为:电流密度为75~125 Am2,电解液温度为30~60 ℃,阴阳极板间距为9~10 cm,反应时间为550~850 min.
3.2 各槽反应情况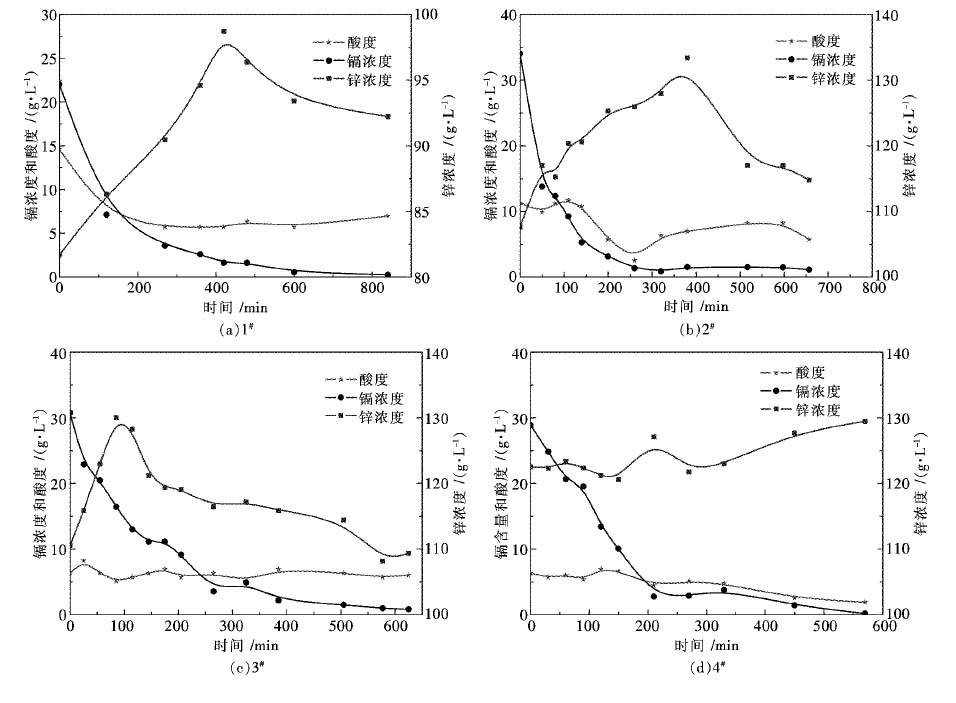 |
| 图 2 各槽Zn2+、Cd2+、H+浓度随时间的变化 Fig. 2 Changes of concentration over time in each cell |
图 2为置换过程中镉离子、锌离子浓度和反应溶液酸度随置换过程进行的变化曲线.从图 2(a)中可以看出Cd2+浓度在开始的200 min内下降很快,这是由于反应前期锌板活性较高,至600 min后变化已不再明显,至850 min停止置换时,镉的浓度降到了0.269 g/L,以最终残液中镉浓度计算1#槽整个过程提镉率为96.74 %,同时可见酸度在开始的一段时间内下降很快,这可能是由于锌板溶解引起,至300 min后变化不再明显,此时酸溶解消耗的酸与电积过程产生的酸近似相等,达到一个平衡状态.而锌离子浓度有一个先升后降的过程,因为刚开始时锌的酸溶和电溶使溶液锌离子浓度快速升高,在后期置换接近完成时,锌的电积过程开始占主导,因此锌离子浓度下降.
从图 2(b)、图 2(c)、图 2(d)中可以看出2#、3#、4#槽中Cd2+浓度变化趋势与1#槽一致.图 2(b)中Cd2+浓度在300 min后已接近平衡,继续延长置换时间镉的浓度已变化很小,同时酸度也基本不再变化.而锌的浓度有一个先升高后降低的过程,这一趋势与第一槽一样,2#槽提镉率为96.71 %.
从图 2(c)中可以看出3#槽Cd2+浓度在开始的400 min内下降很快,在400 min后镉浓度已接近平衡水平,达2 g/L左右,继续延长置换时间镉的浓度已变化很小,同时酸度在整个过程中近似不变,提镉率为97.28 %.锌的浓度趋势与前两槽一样,只是峰值点出现的较早,在100 min左右,这与初始溶液的酸度较低有关,酸度低,锌片溶解少,因而溶液中锌离子浓度较低.
从图 2(d)中可以看出4#槽中Cd2+浓度在开始的200 min内已接近平衡水平,达2.5 g/L左右,整个过程提镉率为99.34 %,较前三槽都高.锌的浓度呈缓慢升高的趋势,最后接近130 g/L,这是因为减少极板,相当于增大了电流密度,使锌片的溶解加快.
3.3 产品海绵镉分析结果取反应结束后的海绵镉产品,进行ICP全分析检测,结果如表 3所示;同时将适量产品海绵镉在真空干燥箱中烘干24 h后研磨,用0.106 mm筛子筛分得到的粉末进行XRD以及SEM检测分析,得到如图 3和图 4所示结果.
| 表3 各槽海绵镉成分分析/(μgL-1)(Cd、Zn单位为%) Table 3 Composition analysis of sponge cadmium in each cell/μg•L-1(Cd、Zn为%) |
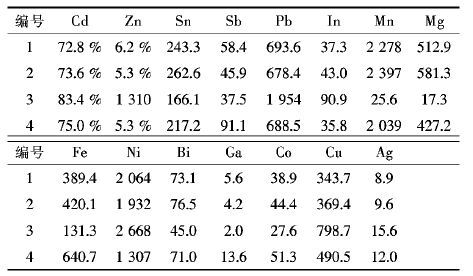 |
| 点击放大 |
由表 3可知,在直流电协同锌板置换反应的工艺中得到海绵镉的纯度达70 %以上,而锌含量则在5 %左右,铅、铜、铁等元素则更少,相比传统的锌粉置换与电解沉积,不仅大大减少锌粉的损耗,降低电耗,且改善了污染源相对分散而导致环境危害大的状况,该工艺在生产实践中具有较好应用价值,有一定的应用前景.
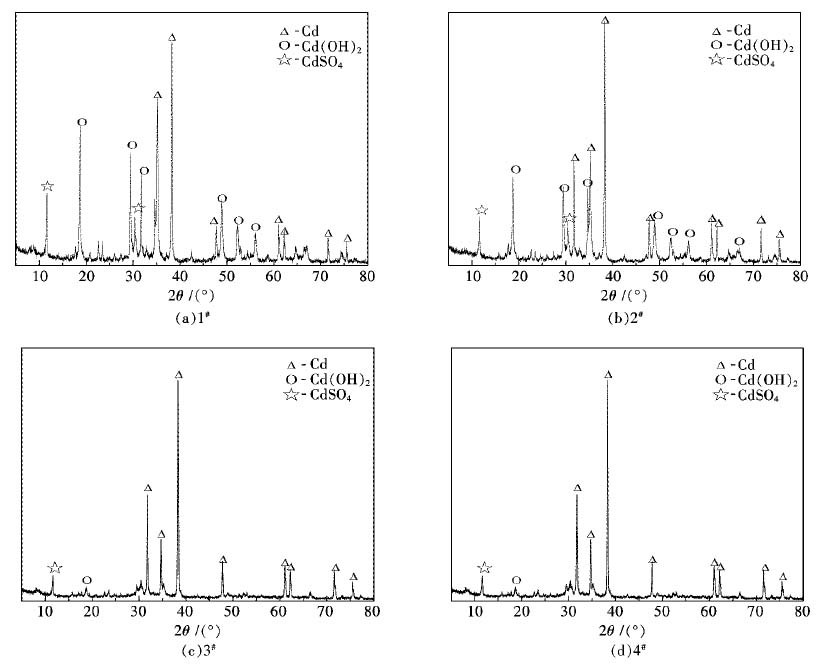 |
| 图 3 各槽海绵镉XRD表征 Fig. 3 XRD patterns of sponge cadmium in each cell |
从图 3中可以看出,产品主要为镉的单质,同时还有少量的Cd(OH)2和CdSO4,可能是由于冲洗不完全和在冲洗过程中的水解所引起的,说明产品纯度较高,没有其它非镉化合物的杂峰出现.
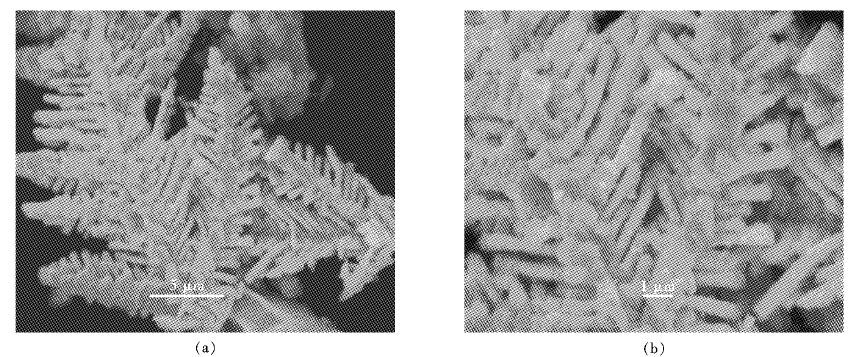 |
| 图 4 海绵镉的SEM表征 Fig. 4 SEM images of sponge cadmium |
从图 4可以看出,析出的海绵镉带有树枝状的枝晶组织,与传统锌粉置换出的球团状海绵镉相比,这样的形貌不易于被锌粉包覆,不仅提高海绵镉的纯度,使硫酸锌溶液有更好的除杂效果,更进一步减少锌粉的过量消耗,节约生产成本.
4 结论1) 在本次工艺实践中,由于环境因素及操作条件的复杂性,对反应条件的合理控制还未能十分准确,以下几点需要特别注意:控制电极电位大于Eθ(Zn2+/Zn)的其他杂质金属如Fe、Cu、Bi、Pb、Cr的析出;控制反应温度,避免镉的复溶;控制阳极的溶解反应弱于与镉的置换过程;控制阴阳极板间距的大小以避免镉绵的膨胀影响反应的进行,减少中途捞镉渣的工作,降低人工成本.
2) 通过工艺实践的结果分析可以看出:随着实验室条件下扩大实验的研究,由于直流电的协同作用强化了锌板的置换,提高锌板的利用率,其成本比锌粉置换低,提镉率相对较高,对设备的要求不高,所以该工艺的工业化应用是十分可行的.
3) 在实验室条件下得到的结果优于工业试验的结果,这是由于小试工艺条件容易控制且影响因素较简单,而工艺实践中随着设备及处理原料的扩大,外界因素影响较复杂,工艺条件的控制也不够精细化,如果能够在管理和控制方面有所提高和加强,产品海绵镉的纯度可达80 %以上.
| [1] | 梅光贵. 湿法炼锌学[M]. 长沙: 中南大学出版社 , 2001. |
| [2] | 森维,孙红燕,彭林,等.从铜镉渣中回收锌、镉、铜试验研究[J]. 湿法冶金. 2015,34(1):29-31. |
| [3] | 王凤朝, 马永涛. 锌冶炼渣综合利用与节能减排的工艺探讨[J]. 环保与综合利用, 2008, 24(1): 47–49. |
| [4] |
Sadegh S M, Bafghi M S, Moradkhani D. A review on hydrometallurgical extraction and recovery of cadmium from various resources[J].
Minerals Engineering, 2007, 20(3): 211–220. DOI: 10.1016/j.mineng.2006.07.001. |
| [5] |
Ju S H, Lu S D, Peng J H, et al. Removal of cadmium from aqueous solutions using red mud granulated with cement[J].
Transactions of Nonferrous Metals Society of China, 2012, 22(12): 3140–3146. DOI: 10.1016/S1003-6326(12)61766-X. |
| [6] | 冶玉花, 张昱琛. 铜镉渣生产镉绵的工业实践[J]. 中国有色冶金, 2014, 43(4): 32–34. |
| [7] | 刘远, 郑雅杰, 孙召明. 锌冶炼含镉烟尘制备高纯镉粉的新工艺[J]. 中国有色金属学报, 2014, 24(4): 1070–1075. |
| [8] | 向红霞, 罗琳, 薛伟. 冶锌废渣中铜锌镉的湿法回收试验研究[J]. 矿业研究与开发, 2009, 29(1): 38–39. |
| [9] | 梁龙伟.湿法炼锌新三段净化工艺研究[D]. 昆明:云南昆明理工大学,2012. |
| [10] | 刘丽君. 水环境中镉污染处理的研究进展[J]. 环境科学与管理, 2012, 37(6): 124–127. |
| [11] | 戴世明, 吕锡武. 镉污染的水处理技术研究进展[J]. 安全与环境工程, 2006, 13(3): 63–65. |
| [12] | Safarzadeh M S,Moradkhani D.The electrowinning of cadmium in the presence of zinc[J]. Hydrometallurgy,2010,105:168—171. |
| [13] | 邵琼, 杜霞, 汪玲, 等. 铜镉渣的回收利用现状[J]. 湿法冶金, 2003, 22(2): 66–68. |
| [14] | 唐谟堂, 张鹏, 何静, 等. Zn(II)-(NH4)2SO4•H2O体系浸出锌烟尘[J]. 中南大学学报(自然科学版), 2007, 38(5): 867–872. |
| [15] | 舒毓璋. 锌系统生产技术的发展[J]. 株冶科技, 1993, 21(1): 27–31. |
 2016, Vol. 6
2016, Vol. 6


