| 氢气在不同还原条件还原磁铁矿的试验研究 |
随着钢铁工业的迅速发展和人们对环境质量的日益密切关注,铁矿石,焦炭资源的日益匮乏,同时炼焦过程中对环境造成了巨大污染,所以直接还原越来越受到研究者的重视[1-7].气基直接还原是指在矿石尚未熔化温度下,采用气体对矿粉进行还原,直接将铁氧化物还原成金属铁的工艺方法,还原产品呈多孔低密度海绵状结构,被称为直接还原海绵铁(DRI)[8].氢气作为一种清洁能源,其还原产物为H2O,不产生CO2等温室气体,完全环保,而且氢气反应是吸热反应,温度越高越有利于反应的进行,这就为反应提供了很好的热力学与动力学条件,同时由于氢气分子具有质量小,易扩散,反应速度快等优点,成为21世纪钢铁环保生产研究的热点[9-14],本文采用氢气在不同温度下对矿粉进行还原研究,以期能对后续混合气基直接还原的有效利用提供理论支撑.
1 试验原料在实验室中进行试验,试验原料为山西某地所产磁铁矿,主要矿物相为磁铁矿Fe3O4,其XRD图谱如图 1所示.
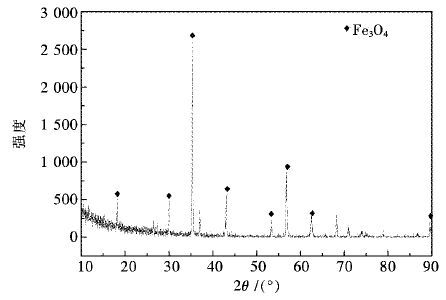 |
| 图 1 磁铁矿原矿的XRD图谱 Fig. 1 XRD map of magnetite |
该矿粉磨圆度好,粒度均匀,其主要化学成分如表 1所示.
| 表1 磁铁矿元素组成 (/%) Table 1 Particle size analysis of ore samples |
 |
| 点击放大 |
从表 1可以看出铁矿粉品位较高,杂质元素硫磷含量少,符合直接还原炼铁工艺所要求的原料标准.
2 试验方案 2.1 试验仪器主要还原设备为1台12 kWh带称量系统的高温节能管式炉,额定温度1 200 ℃,称量精度0.1 g,使用PID可控温程序控制.其余设备包括耐高温钢制成的还原管,抽风式干燥箱,铂铑热电偶等.还原试验装置如图 2所示,采用此试验装置是基于:
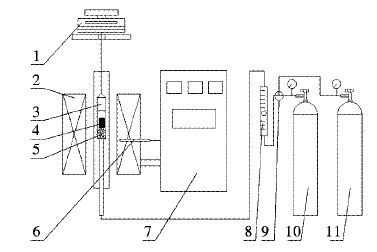 |
| 1.-电子天平;2-.电炉;3.-还原管;4.-试样;5.-氧化铝球;6.-热电偶;7.-温度控制仪;8.-流量计;9.-换向阀;10.-氢气;11.-氮气. 图 2 还原试验装置 Fig. 2 Experimental reduction device |
1) 电子天平与还原管相连接,可直接记录氢气还原磁铁矿时还原管质量变化,间接计算氢气还原磁铁矿的还原率.
2) 在还原管内部同样有一个热电偶,其作用是测量球团矿试样中心的温度,电炉热电偶的作用则是测量当前炉内温度.因为球团矿试样中心温度与炉内温度存在一定温差,所以在还原管中另设一支热电偶.
3) 还原管底部垫一层氧化铝球是为了防止球团矿堵塞还原管进气口,同时预热气体,使气体均匀的与球团矿接触.
2.2 试验步骤(1) 实验时先将矿粉在抽风干燥箱中105 ℃烘干2 h,去除矿粉中的水分,采用矿粉筛进行筛选,得到矿粉.
(2) 为了达到有效的黏结效果,选择配1.5 %膨润土与0.5 %有机黏粘结剂以及8 %水,使其充分混合均匀.
(3) 在手扳式压球机上进行压球,采用15MPa压力进行压球.
(4) 压完球团放入烘箱中烘干2 h,去除水分.
(5) 在室温下将烘干过后的球团放入高温电阻炉内进行焙烧,升温时间为90 min,升到950 ℃,保温30 min,继续升温至1 220 ℃,保温20 min,球团抗压强度达到350 N.
(6) 为了研究还原机理对此球团的影响,分别采用750 ℃,800 ℃,850 ℃,900 ℃,950 ℃的温度采用氢气对氧化球团进行直接还原.
(7) 将氧化铝刚玉球装入试验管中,刚玉球的作用是预热还原气体,放入带有孔隙的钢垫片,然后将焙烧后的球团装入,每次装入500 g,盖上试管的盖子,插入热电偶,将还原管放入管式炉内,首先通入N2,然后通还原气体H2,检查装置是否漏气,然后设置管式炉升温程序,启动加热至预定温度后保持恒定.
(8) 反应管温度到达还原温度时,以10 L/min的流量向反应管内通入H2进行还原,记录随时间进行球团质量减少的量以及热电偶所显示的炉内温度,还原时间设定为50 min.
(9) 还原结束后,使用N2保护.温度降到700 ℃时,将还原管从管式炉中迅速取出以缩短降温时间.使用N2保护直至温度降至80 ℃,防止还原后球团再次氧化.
2.3 试验数据处理方法 2.3.1 质量变化的数据处理使用带称量系统的高温节能管式炉加还原管可测量球团质量变化.试验目的是用球团矿还原前后质量变化测定铁氧化物的失氧量,即进行球团还原率的测定.
数据采集由人工每分钟读取电子天平的显示数值,将天平的读数按时间绘制在图 3中,绘图采用每5分钟间隔的数据,取0 min,5 min,10 min,15 min,20 min,25 min,30 min,35 min,40 min,45 min,50 min,图 3为不同温度条件下球团质量随时间的变化曲线.
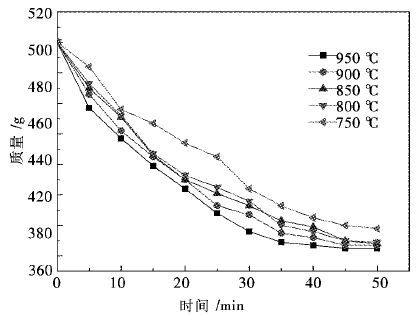 |
| 图 3 不同温度条件下球团质量随时间的变化曲线 Fig. 3 The relationship of quality and reaction time at different temperature |
随着时间的进行,球团的质量逐渐减少.从0~5 min这5 min内,950 ℃的条件下还原进行的最快,球团质量减少了43 g,900 ℃,850 ℃,800 ℃分别减少了34 g,30 g,30 g,750 ℃下球团质量减少了17 g.
整个趋势来看,950 ℃时,球团质量减少的最快,当反应进行到35 min 时,已经减少到373 g,接近完全反应.
2.3.2 反应分数的数据处理表 1显示试验用磁铁矿全铁含量为65.76%,根据磁铁矿全铁含量计算其中总氧含量,即ΣO.定义反应物参加还原反应减少的量与其理论计算减少的量之比为反应分数,以R表示,可以得出:
| $R = \frac{{\Delta O}}{{\sum O }} = \frac{{{m_0} - {m_i}}}{{{m_r} \cdot O\% }}$ | (1) |
因此,铁氧化物在还原过程中t时刻的反应分数可按式(1) 求解.
式(1) 中:R为反应分数或还原率;ΔO为铁氧化物失去氧的量; ΣO为铁氧化物还原前总氧量;m0为还原前球团矿的质量; mt为还原t时刻后球团矿质量;mr为还原前球团矿质量;O%为由全铁量计算后铁氧化物的氧含量.
将每一分钟的反应分数计算出来,标在图 4中.
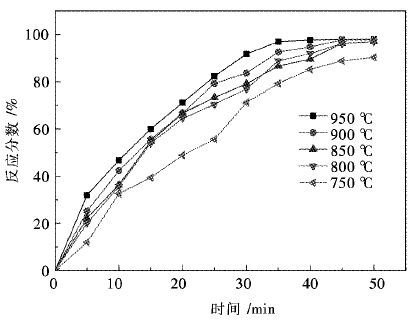 |
| 图 4 不同温度条件下反应分数随时间的变化曲线 Fig. 4 The relationship of quality and reaction time at different temperature |
3 试验结果与讨论 3.1 温度对反应分数的影响
图 4为不同温度条件下反应分数随时间的变化曲线,可以看出: 950 ℃各点的反应分数明显大于其他温度下各点的反应分数,当反应进行到35 min时反应基本完成,此时反应分数为97.7 %(50 min时,反应分数为98 %);900 ℃,850 ℃,800 ℃在反应进行到45 min时,反应基本结束,最终得到这3个温度下反应分数分别为97.8 %,97 %,97 %.
在0~20 min内,900 ℃与850 ℃2个反应条件下,反应的反应分数基本相当,20 min后,各个时间段900 ℃的反应条件下的反应分数比850 ℃的反应分数要大.
从图 4中可以明显看出,还原温度越高,越有利于还原反应的快速进行,950 ℃与900 ℃的还原进行程度明显优于其他温度下反应所能进行的程度.这与采用H2还原有关,氢气(H2)还原铁氧化物反应如式(2) ,式(3) 所示[15].
| ${\rm{3F}}{{\rm{e}}_{\rm{2}}}{{\rm{O}}_{\rm{3}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{ = 2F}}{{\rm{e}}_{\rm{3}}}{{\rm{O}}_{\rm{4}}}{\rm{ + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}$ | (2) |
| $\Delta {G^\theta } = - 15547 - 74.40T{\rm{J/mol}}$ | (3) |
H2还原Fe2O3是一个吸热反应,温度的升高对还原有利,而且,温度越高,H2气体的分子越活波,扩散速度加快,△G的绝对值越大(<0) ,反应更加容易生成还原产物的方向进行.因此,温度升高有利于还原反应进行.当然还原温度也不能过高,温度过高会发生球团黏结现象[16].
3.2 温度对金属化率的影响采用H2不同温度下还原50 min,可以发现还原50 min后金属化率与温度的的关系如图 5所示.
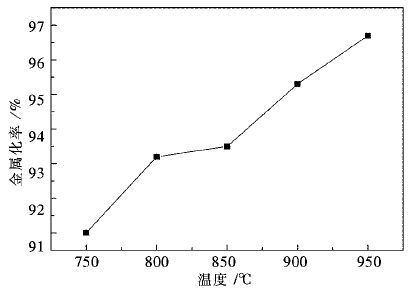 |
| 图 5 温度与金属化率的关系 Fig. 5 The relationship of reduction rate and temperature |
还原50 min后,金属化率都在90 %以上,而且还原温度越高,金属化率越大,说明反应进行的更加完全,其中800 ℃,850 ℃,900 ℃,950 ℃的金属化率较高,在93 %以上,且随温度增大而增大,在950 ℃时,金属化率达到了96.7 %.
相比较而言,750 ℃的金属化率略低,这与还原温度在750 ℃下,还原尚未完全进行完有关,球团中存在一定的铁相化合物,故金属化率稍低.
3.3 还原时间对金属化率的影响为了研究还原时间对球团金属化率的影响,在950 ℃,900 ℃的反应条件下分别取还原10 min,20 min,30 min,40 min,50 min的球团,进行金属化率的测定,结果如图 6所示,图 6为不同温度条件下时间与金属化率的关系.
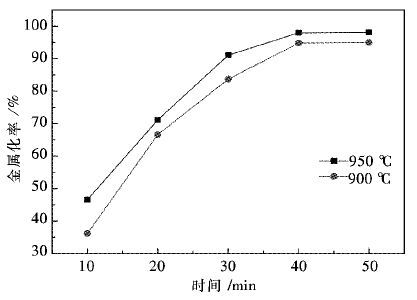 |
| 图 6 不同温度条件下时间与金属化率的关系 Fig. 6 The relationship of reduction rate and temperature at different time |
从图 6中可以得知:在950 ℃的反应条件下,随着反应时间的向后推移,球团的金属化率升高,前30 min内,球团的金属化率升高的很快,在30 min过后达到了91.8 %,表明前30 min内,反应进行的很快,大部分铁相化合物被还原成金属铁.
后20 min内,金属化率进一步提高,达到了96.7 %.在900 ℃的反应条件下,前40 min内,金属化率迅速升高,在40 min时达到94.8 %,后10 min内,金属化率基本不再变化.
观察2条曲线,可以发现每个10 min间隔内金属化率都在提高,但是曲线的斜率逐渐变小,表明随时间的进行,还原反应速率逐渐降低.
同时,对比2条曲线,可以发现每个时间段内950 ℃的反应条件下的金属化率比900 ℃时的金属化率要大.
3.4 温度对抗压强度的影响研究不同温度对海绵铁抗压强度的影响,随机选取氢气还原不同温度下的球团20个,对其进行抗压强度的检测,计算平均值,将数值标在图 7中,图 7为温度与抗压强度的关系.
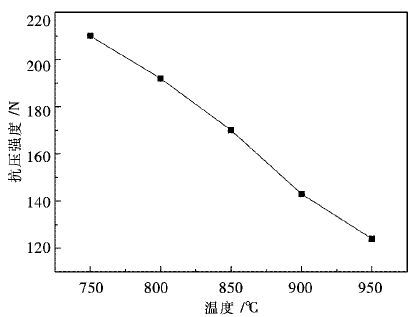 |
| 图 7 温度与抗压强度的关系 Fig. 7 T The relationship of compressive strength and temperature |
从图 7中可以看出,随着反应温度的升高,还原产品海绵铁的抗压强度逐渐降低,在950 ℃达到最小值124 N,图 7中纵坐标抗压强度与横坐标反应温度基本成线性关系,斜率k=-0.43.
在此反应中,随着温度的升高,有利于还原反应的进行,还原速度增大,结合未反应核理论模型可以得知[16],还原反应的快速进行导致生成的还原产物层向外扩张,造成了球团疏松多孔;同时,还原速度越快,球团也容易产生裂纹,所以随着温度的升高,球团的抗压强度有所降低.
3.5 反应温度变化规律将焙烧过后的球团放入还原管中,通入N2保护至反应温度,当炉温到达反应的温度后,停止通入N2,通入H2还原,通过铂铑热电偶测量还原管管内反应温度,将每分钟的温度记录下,标在图 9中,图 8为还原过程中球团温度的变化曲线,可以发现:
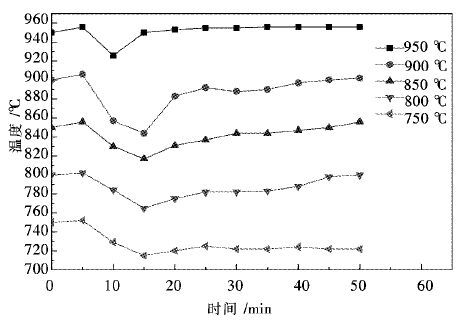 |
| 图 8 还原过程中球团温度的变化曲线 Fig. 8 The change rule of reaction temperature |
通入H2的5 min之内,还原管管内温度随时间的增加而增加,在5 min末温度能比预设的反应温度高出7-~8 ℃.随后,反应继续进行,温度明显下降,在800 ℃,850 ℃,900 ℃,950 ℃4个反应条件下当反应进行到10 min时,温度降到最低,比预设的还原温度约低30 ℃.750 ℃条件下,反应进行到15 min时,管内温度达到最低为711 ℃.
随后,温度开始反弹,950 ℃条件下的管内温度在5 min后,即反应进行到15 min时,达到950 ℃;900 ℃,850 ℃,800 ℃条件下的管内温度分别在40min,45min,45min时达到各自的预设反应温度,750 ℃条件下进行的反应直到反应结束(此实验为50 min)也未达到预设温度75 ℃(此时热电偶显示炉内温度为722 ℃).
反应前5 min内管内温度升高是因为反应刚开始进行,H2还原球团矿的反应尚不剧烈,同时还原管底部有气体吹入,带着反应管底部的热量向上扩散,所以铂铑热电偶显示的温度有所升高.
当还原反应进行到5 min后,此时反应剧烈进行,H2还原Fe2O3为吸热反应,此时反应吸收管内的热量大于高温电阻炉向还原管内传输的热量,所以管内的温度会大幅降低.当温度上升至预设的还原温度时,此时还原反应基本结束,温度也不再有大的变化,会在小范围内波动.
4 结论1) 采用H2还原此球团矿,在800 ℃,850 ℃,900 ℃,950 ℃条件下各自还原50 min,可以使反应分数达到97 %以上,并且温度越高,反应分数越大.750 ℃还原50 min,其还原率可达90.4 %.
2) 随着温度的升高,所得还原产品海绵铁的金属化率也逐渐升高,750 ℃条件下金属化率可达91 %,800 ℃,850 ℃,900 ℃,950 ℃的条件下,金属化率都在93 %以上,950 ℃达到最高,为96.7 %.
3) 对于同一温度的不同时间内,前30 min内金属化率增加的速度快,后20 min金属化率增加的速度慢,并且温度越高,对应的相同时间内,金属化率越大.
4) 当还原反应开始进行,还原管内的温度对应的趋势是先增高,后降低,之后逐步趋近于反应的预设温度,这是因为H2还原是吸热反应.
| [1] | 王胜春, 张德祥, 陆鑫, 等. 中国炼焦煤资源与焦炭质量的现状与展望[J]. 煤炭转化, 2011(3): 92–96. |
| [2] | 齐渊洪, 钱晖, 周渝生, 等. 中国直接还原铁技术发展的现状及方向[J]. 中国冶金, 2013, 23(1): 10–13. |
| [3] | Peter Diemer, Hans Bodo Lungen,Martin Reinke, Utilization of Coke Oven Gas for the Production of DRI[C]// 6th Europe coking and Ironmaking Conference Proceedings (ECIC),Dusseldorf:2011. |
| [4] | Martinis A, Partrizio D,Volptti A. Energiron Direct Reduction Technology Intergration with Electric Steel Making and Blast Furnace Technology[C]// 7th China International Steel Congress Proceedings,Beijing:2012. |
| [5] | Thomas W.Hoffman,肖南. MIDREX直接还原炼铁—无损环境之途径[J]. 世界环境1985(4):39-42. |
| [6] | George Tsvik. Impact of H2/CO Ratio on Syngas-based Direct Reduction Shaft Furnace[C]//6th Europe coking and Ironmaking Conference Proceedings (ECIC),Dusseldorf:2011. |
| [7] | 张福明, 曹朝真, 徐辉. 气基竖炉直接还原技术的发展现状与展望[J]. 钢铁, 2014(3): 1–10. |
| [8] | 方觉. 非高炉炼铁工艺与理论[M]. 北京: 冶金工业出版社 , 2010. |
| [9] | 雷华. 氢气竖炉直接还原技术的应用[J]. 现代冶金, 2015(1): 29–31. |
| [10] |
YI L Y, HUANG Z C, PENG H. Experimental Research on the Novel Process of Iron Ore Direct Reduction by Coal Gas[J].
Advanced Materials Research, 2011, 311/312/313: 891. |
| [11] |
Bonalde A, Henriquez A, Manrique M. Kinetic Analysis of the Iron Oxide Reduction Using Hydrogen-Carbon Monoxide Mixture as Reducing Agent[J].
ISIJ International, 2005, 45(9): 1255. DOI: 10.2355/isijinternational.45.1255. |
| [12] | Cheeley R. Gasification and the Midrex Direct Reduction Process [A]. 1999 gasification technologies conference[C]. San Francisco,California, USA. 1999:1-5. |
| [13] | 易凌云.铁矿球团CO-H2混合气体气基直接还原基础研究[D].长沙:中南大学,2013. |
| [14] |
Zuo H B, Hu Z W, Zhang J. Direct reduction of iron ore by biomass char[J].
International Journal of Minerals Metallurgy and Materials, 2013(6): 514–521. |
| [15] | 王筱留. 钢铁冶金学炼铁部分[M]. 北京: 冶金工业出版社 , 2000. |
| [16] | 郭汉杰. 冶金物理化学教程[M]. 北京: 冶金工业出版社 , 2006. |
 2016, Vol. 6
2016, Vol. 6


