| 氨法从氯化铜锰锌钴废液中选择性分离锰 |
某公司提取金属钴的原料有碳酸钴、氢氧化钴及水钴矿.这些原料除含钴外,还富含铜、锰、锌等有价金属元素.在盐酸溶解上述原料提取钴的过程中,铜、锰和锌等也随之转移到浸出液中.浸出液经P204萃取过程,实现钴与铜、锰、锌的分离,采用盐酸反萃有机相中的铜、锰和锌等,得到富含铜、锰和锌的废液,称之为氯化铜锰锌钴废液.该废液的主要特点是废液中铜、锰、锌和钴等有价金属含量高,资源化利用价值大,且铜、锌和钴等均能与氨形成稳定的配合物.检索国内外文献,尚未见铜、锰、锌和钴的氯化物体系中锰与铜、锌、钴相互分离的研究报道.
文献报道的锰和钴分离方法有萃取法[1-5]、氧化法[6-7]、硫化法[8]和氨法[9-10]等.氧化法是通过加氧化剂使Mn2+以氧化物的形式(主要是MnO2)沉淀可以将其与其他离子分离,常用的氧化剂主要有臭氧、氯酸、SO2/O2混合物、过硫酸盐[8]等,但是氧化完全所需的时间比较长.硫化法的一个不足是硫化沉淀渣不能被硫酸或盐酸直接浸出,需在氧化条件下浸出.对于铜、钴、镍、锌和镉等多种相近的金属离子的分离,主要采用协同萃取[11],但是理想的协萃剂的筛选是其难点.氨法沉淀过程中,通过NH3 ·H2O与Mn2+的沉淀,以及NH3与Cu2+、Zn2+、Co2+的配合作用,实现Mn2+与Cu2+、Zn2+、Co2+的有效分离.该方法具有操作简单,条件较好控制,且氨还能循环利用等特点.本文采用氨法处理氯化铜锰锌钴废液,考察了pH值、反应时间、氨浓度等因素对分离效果的影响.
1 原理与热力学计算 1.1 原理向氯化铜锰锌钴废液中加入NH3·H2O的过程中,Mn2+、Cu2+、Zn2+和Co2+均能和NH3 ·H2O形成沉淀,当加入氨水过量,Cu(OH)2、Zn(OH)2和Co(OH)2的沉淀与NH3形成配合离子[12],重新转移到溶液中,实现Mn2+与Cu2+、Zn2+、Co2+的有效分离.
从化学平衡观点来看,温度对配位数影响较大,温度升高有利于低配位数离子的形成[13].而钴、铜、锌与氨形成配合离子的配位数分别是6、4、4,属于高配位数的离子,不需升高温度,而且考虑到在以后的工程实际应用中操作的简便性和降低成本的原则,故实验选择在常温25 ℃下进行.
1.2 热力学计算Mn2+/Cu2+/Zn2+/Co2+-Cl--NH3-H2O体系中存在的化学反应及其平衡常数[14](25 ℃)列于表 1.
| 表1 化学反应及其平衡常数(25 ℃) Table 1 Reactions and equilibrium constants at 25 ℃ |
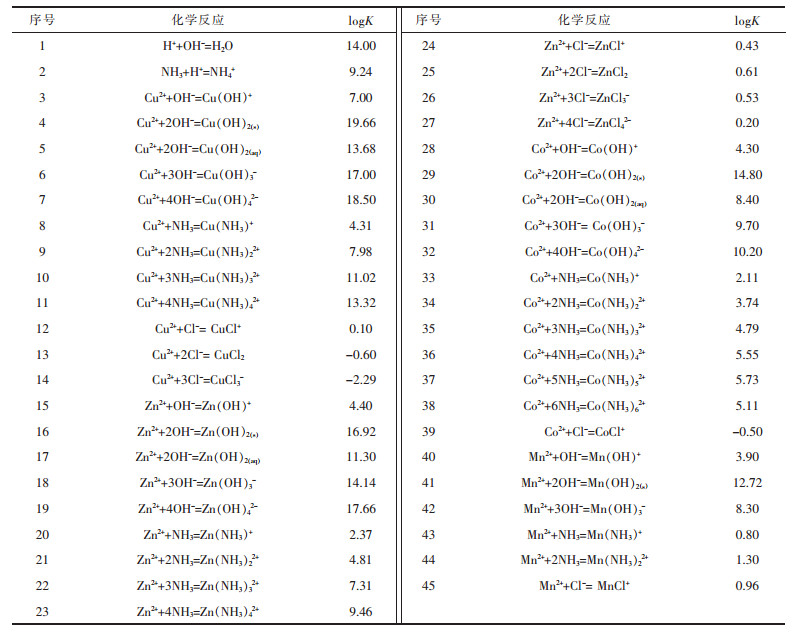 |
| 点击放大 |
以Mn2+-Cl--NH3-H2O体系为例,设溶液中总氨浓度为[NH3]T,游离的氨浓度为[NH3],游离的锰离子浓度为[Mn2+],游离的氯离子浓度为[Cl-],溶液中锰的总浓度为[Mn2+]T,氯的总浓度为[Cl-]T,根据同时平衡和质量守恒原理,溶液中各种离子浓度关系如下:
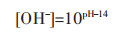
|
(1) |
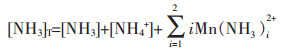
|
(2) |
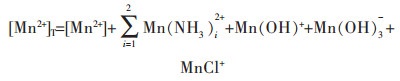
|
(3) |
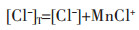
|
(4) |
由于实验在实际操作过程中,总氨浓度[NH3]T、[Cl-]T是可控的已知量,故根据上述平衡方程式(1)~式(4)和表 1,参照参考文献[15]的计算方法,在给定的pH值条件下,即可得到游离的金属离子浓度[Mn2+],游离的氨浓度[NH3]和游离的氯离子浓度[Cl-],溶液中锰离子的总浓度[Mn2+]T.
根据上述模型与算法可计算出不同总氨浓度[NH3]T时,锰离子总浓度对数lg[Mn2+]T与pH值的关系并可画出曲线图.同理,可以分别得到不同总氨浓度时lg[Cu2+]T、lg[Zn2+]T、lg[Co2+]T与pH值的关系曲线图,见图 1.
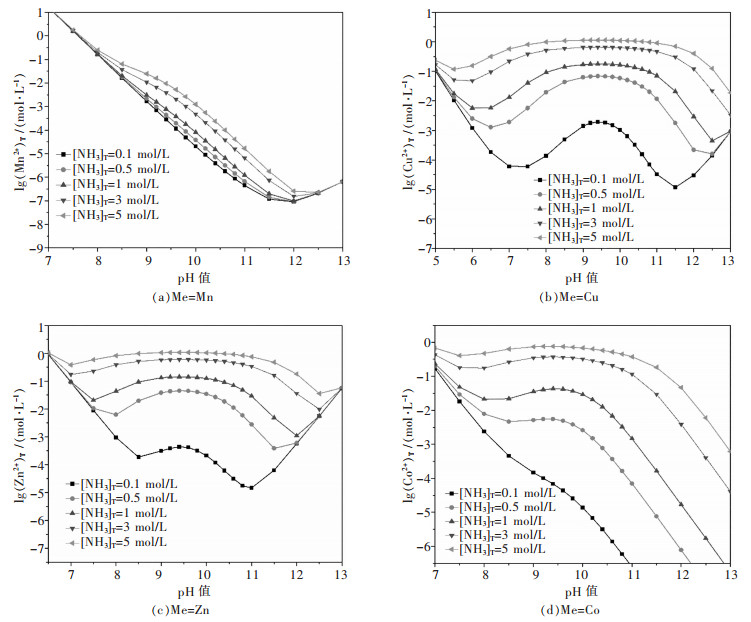 |
| 图 1 不同[NH3]T时lg(Me2+)(Me=Mn,Cu,Zn,Co)T-pH图 Fig. 1 Diagrams of lg (Me2+)(Me=Mn, Cu, Zn, Co)T-pH at differdent [NH3]T |
由图 1(a)可知,当pH值小于12的范围内时,Mn2+浓度随pH增大逐渐减小;总氨浓度增加时,Mn2+浓度增加.由图 1(b)、图 1(c)和图 1(d)可知,对于pH值范围在8~11之间时,金属离子的浓度随pH值先增大后减小,而且在pH值为9~10的范围可以达到最大值.故以此作为实验操作时的pH值考察范围.总氨浓度取0.1~5 mol/L时,随着总氨浓度的升高,各个金属离子浓度均增加.但是,当总氨浓度在0.1 mol/L时,Co2+的浓度随着pH值增大一直减少,不利于锰钴离子分离,所以在一定范围内增加总氨的浓度可以使Mn2+与Cu2+、Zn2+、Co2+有效分离.因此,本体系的热力学计算分析为实验提供了理论指导.
2 实验 2.1 材料、试剂与仪器设备实验材料:取某公司碳酸盐污泥用盐酸溶解得到本研究用的氯化铜锰锌钴废液,其主要化学成分见表 2所示.
| 表2 氯化铜锰锌钴废液的主要化学成分/(g·L-1) Table 2 Major components of the cobalt copper manganese zinc chloride waste liquid |
 |
| 点击放大 |
主要化学试剂:浓盐酸(HCl)和浓氨水(NH3· H2O),均为分析纯试剂.
实验所用仪器主要有:320型pH计(METTLER TOLEDO)、1200RT搅拌器(Type Heidon)、TAS型原子吸收分光光度计(北京普析通用公司)、AL204型电子天平(梅特勒-托利多仪器(上海)有限公司)、TP-3000E型电子天平(湘仪天平仪器有限公司)、DZF-6050型真空干燥箱(上海精宏实验设备有限公司)、RAT-1水浴恒温反应釜(上海顺义生物仪器有限公司)、SHZ-82A水浴恒温振荡器(金坛市医疗仪器厂).
2.2 实验步骤在25 ℃条件下,取一定体积的氯化铜锰锌钴废液加入到反应釜中,插入pH计,启动搅拌,滴加一定量的NH3 ·H2O,控制反应终点的pH值和反应时间,反应完成后,真空抽滤和洗涤,滤液和洗液合并计量体积,并测定Mn2+、Cu2+、Zn2+和Co2+含量,计算各金属的沉淀率.根据金属沉淀率的大小,评价Mn2+与Cu2+、Zn2+、Co2+的分离效果.Mn2+沉淀率越高,Cu2+、Zn2+、Co2+的沉淀率越低,表示Mn2+与Cu2+、Zn2+、CO2的分离效果越好.
2.3 分析与计算pH值采用便携式pH计法[16]测定,Mn2+、Cu2+、Zn2+、Co2+浓度采用滴定法[17]测定.重金属沉淀率M(%)的计算公式如下:
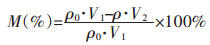
|
(5) |
式(5)中:ρ0为反应前实验溶液中重金属的质量浓度,g/L;ρ为反应后实验溶液中重金属的质量浓度,g/L;V1为反应前实验溶液的体积,L;V2为反应后实验溶液的体积,L.
3 结果与讨论 3.1 pH值对金属沉淀率的影响25 ℃条件下,固定实验反应时间为1 h和加入的氨浓度为7 mol/L,考察了溶液终点pH值对氯化铜锰锌钴废液中金属沉淀情况的影响,结果见图 2.
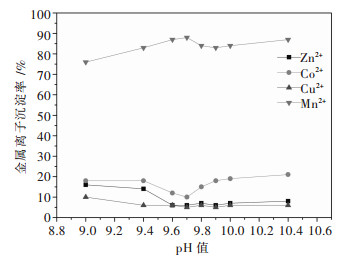 |
| 图 2 pH值与溶液中金属离子沉淀率的关系 Fig. 2 Relationship between pH value and precipitation rates of metal ions in the solution |
由图 2可知,当pH值在9.0~9.6之间时,Mn2+的沉淀率随着pH值增大而增大,Cu2+、Zn2+、Co2+的沉淀率随着pH值增大而减小.当溶液的pH值增大至9.6~9.7之间时,Mn2+的沉淀率为90 %左右,Cu2+、Zn2+、Co2+的沉淀率均小于10 %.此后,随着pH值增大,Mn2+的沉淀率减小,当溶液pH=10.4时,根据Mn(OH)2在水中的溶度积常数Ksp=1.9×10 -13[18]计算,得[Mn2+]=0.166 mg / L,Mn2+理论上基本可以沉淀完全,但是实际上Mn2+沉淀率只有87 %,说明Mn2+在氨性介质中很难沉淀完全,造成该结果的主要原因是NH3对Mn2+有配合作用,有一部分Mn2+以Mn(NH3)x2+形态存在[19].当溶液pH值大于9.7时,Cu2+、Zn2+的沉淀率均可稳定在6 %左右,Co2+的沉淀率会随着pH值的增加而增大,根据图 1的热力学计算可以解释:说明此时溶液中碱性过高促进Co(OH)2沉淀生成作用强于钴氨配合离子的生成作用.因此,当溶液pH值为9.6~9.7时,Mn2+与Cu2+、Zn2+、Co2+分离效果较好.
3.2 反应时间对金属沉淀率的影响25 ℃条件下,固定实验反应的终点pH值为9.6~9.7和加入的氨浓度为7 mol/L,考察了反应时间对氯化铜锰锌钴废液中金属沉淀情况的影响,结果见图 3.
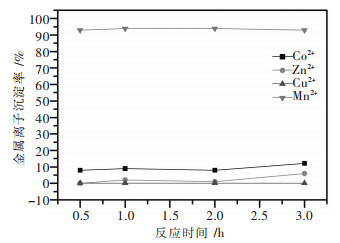 |
| 图 3 反应时间与溶液中金属离子沉淀率的关系 Fig. 3 Relationship between reaction time and precipitation rates of metal ions in the solution |
由图 3可知:当反应时间为0.5~2 h时,Mn2+的沉淀率在94 %左右,Cu2+、Zn2+、Co2+的沉淀率均小于10 %,且变化很小;当反应2~3 h时,Zn2+、Co2+的沉淀率增加.究其原因是,随着反应时间的延长,体系中NH3的量会伴随着搅拌而减少,不利于反应向着配合离子生成的方向进行,使得Zn2+、Co2+的沉淀率增加.为了既使实验可以充分反应,又使溶液中游离NH3的损失尽可能少,故选择实验的反应时间1 h.
3.3 氨浓度对金属沉淀率的影响25 ℃条件下,固定实验反应的终点pH值为9.6~9.7和反应时间为1 h,考察了加入的氨浓度对氯化铜锰锌钴废液中金属沉淀情况的影响,结果见图 4.
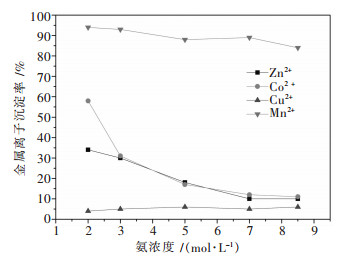 |
| 图 4 氨浓度与溶液中金属离子沉淀率的关系 Fig. 4 Relationship between ammonia concentration and precipitation rates of metal ions in the solution |
根据化学平衡的观点可知,增加氨浓度有利于高配位数离子的形成[13].故增加氨浓度可以促进钴、铜、锌配合离子的生成.由图 4可知,Mn2+的沉淀率随着氨浓度增大而逐渐减小,这与热力学计算情况一致,进一步说明氨浓度过高不利于Mn2+的沉淀.此外,Zn2+、Co2+的沉淀率随氨浓度的增加而减小直至稳定在10 %左右,Cu2+的沉淀率一直在5 %左右.当溶液中氨浓度高于7 mol/L时,虽然对铜、锌、钴配合物的生成影响不大,但是会使Mn2+的沉淀减少.因此,确定氨浓度为7 mol/L为最佳条件.
4 结论1) 通过研究,确定本实验的最佳工艺为:25 ℃条件下,溶液终点pH值为9.6~9.7,加入的氨浓度为7 mol/L,反应时间为1 h.
2) 上述优化工艺条件下,Mn2+沉淀率达到90 %,而Cu2+、Zn2+和Co2+沉淀率小于10 %,基本上达到金属离子初步分离的目的.
3) 用氨法分离氯化铜锰锌钴废液中的Mn2+与Cu2+、Zn2+、Co2+,实验操作简便,实验条件易控制,实验设备简单,分离效果较理想,经济效益可观,适合工业应用.
| [1] |
Wang F, He F, Zhao J, et al. Extraction and separation of cobalt (Ⅱ), copper (Ⅱ) and manganese (Ⅱ) by Cyanex272, PC-88A and their mixtures[J].
Separation and Purification Technology, 2012, 93: 8–14. DOI: 10.1016/j.seppur.2012.03.018. |
| [2] |
Sridhar V, Verma J K. Extraction of copper, nickel and cobalt from the leach liquor of manganese -bearing sea nodules using LIX 984N and ACORGA M5640[J].
Minerals Engineering, 2011, 24(8): 959–962. DOI: 10.1016/j.mineng.2011.02.015. |
| [3] |
Shen Y, Xue W, Li W, et al. Recovery of Mn2+, Co2+ and Ni2+ from manganese nodules by redox leaching and solvent extraction[J].
Transactions of Nonferrous Metals Society of China, 2007, 17(5): 1105–1111. DOI: 10.1016/S1003-6326(07)60233-7. |
| [4] |
Chung N H, Tabata M. Salting-out phase separation of the mixture of 2-propanol and water for selective extraction of cobalt (Ⅱ) in the presence of manganese (Ⅱ), nickel (Ⅱ), and copper (Ⅱ)[J].
Hydrometallurgy, 2004, 73(1/2): 81–89. |
| [5] |
Zhu Z, Zhang W, Pranolo Y, et al. Separation and recovery of copper, nickel, cobalt and zinc in chloride solutions by synergistic solvent extraction[J].
Hydrometallurgy, 2012, 127/128: 1–7. DOI: 10.1016/j.hydromet.2012.07.001. |
| [6] | 洪涛.氧化沉淀法分离炼锌除钴渣中锌钴的研究[D].西安:西安建筑科技大学, 2003. http://cdmd.cnki.com.cn/Article/CDMD-10703-2003090939.htm |
| [7] |
Zhang W, Singh P, Muir D. Oxidative precipitation of manganese with SO2/O2 and separation from cobalt and nickel[J].
Hydrometallurgy, 2002, 63(2): 127–135. DOI: 10.1016/S0304-386X(01)00205-5. |
| [8] | 徐艳娥, 谢克强, 邢鹏. 湿法冶金中钴锰分离方法综评[J]. 矿冶, 2014(1): 55–60. |
| [9] | 何家成. 氨法回收人造金刚石酸洗废液中的镍、钴、锰[J]. 中国物资再生, 1997(6): 10–12. |
| [10] |
Katsiapi A, Tsakiridis P E, Oustadakis P, et al. Cobalt recovery from mixed Co-Mn hydroxide precipitates by ammonia-ammonium carbonate leaching[J].
Minerals Engineering, 2010, 23(8): 643–651. DOI: 10.1016/j.mineng.2010.03.006. |
| [11] | 邱胤轩. Versatic10/Mextra1984H萃取分离废水中的铜镍钴锌镉的研究[D].北京:北京有色金属研究总院, 2014. http://cdmd.cnki.com.cn/Article/CDMD-86403-1014268681.htm |
| [12] | 张祥麟. 配合物化学[M]. 北京: 高等教育出版社 , 1991. |
| [13] | 汪明礼. 碳酸氢铵加氨水处理菱锌矿的研究[J]. 适用技术市场, 1997(11): 8–10. |
| [14] | DEAN J A.兰氏化学手册[M].尚久方, 译.北京:科学出版社, 1991. |
| [15] | 赵中伟, 胡宇杰, 李洪桂. 一种用EXCEL进行冶金热力学平衡计算的新方法[J]. 稀有金属与硬质合金, 2005, 33(1): 48–51. |
| [16] | 国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社 , 2002. |
| [17] | 胡琴, 黄庆华. 分析化学[M]. 北京: 科学出版社 , 2009. |
| [18] | 朱元保, 沈子琛, 张传福, 等. 电化学数据手册[M]. 长沙: 湖南科学技术出版社 , 1985. |
| [19] | 邹兴, 朱鸿民. 硫酸锰在氨性介质中制备四氧化三锰的研究[J]. 中国锰业, 2009(4): 4–6. |
 2015, Vol. 6
2015, Vol. 6


