| 芽孢杆菌芽孢内膜脂质的分离及图谱分析 |
2. 江西省矿冶环境污染控制重点实验室, 江西 赣州 341000;
3. 香港城市大学生物与医学系,香港 999077
2. Jiangxi Key Laboratory of Mining & Metallurgy Environmental Pollution Control,Ganzhou 341000,China;
3. Department of Biomedical Sciences, City University of Hong Kong, Hong Kong 999077,China
芽孢杆菌( Bacillaceae )是一类能够通过形成芽孢而度过极端恶劣环境条件的细菌.细菌芽孢为内生芽孢,是一种营养细胞的休眠体,其结构不同于营养细胞,由外至内通常由芽孢衣、外膜、肽聚糖皮层、芽孢壁、内膜及核芯组成[1-2].芽孢复杂而精密的结构为其能够度过不利的营养条件提供了保障,在休眠状态甚至能存活数百万年,而当外界营养条件转好时又能重新萌发成营养细胞进行繁殖[3-5].
芽孢内膜在芽孢萌发过程中发挥重要作用.国内外研究表明,多数萌发相关的蛋白在芽孢内膜上,譬如枯草芽孢杆菌( B.subtilis )的萌发受体蛋白GerA等[6-9].除此之外,脂质也是膜的重要组成部分,在调控生物过程,包括能量储藏、信号转导、抗病毒保护等发挥重要作用[10].研究发现芽孢内膜磷脂,特别是心磷脂,也参与芽孢萌发过程.心磷脂合成基因clsA 突变体芽孢不能够被AGFK 激活而重新萌发[11],表明心磷脂参与芽孢早期的萌发过程.另外,心磷脂的错误修饰被认为是某些萌发蛋白缺陷的原因.因此,心磷脂是通过影响萌发蛋白而决定芽孢萌发速率的因素[12-13].然而,关于芽孢内膜脂质的研究报道很少: 传统的Bligh & Dyer (B & D)法已被广泛应用于细胞脂质的提取[10],却不能直接提取芽孢中的脂质;Kawai 等人在传统提取方法基础上,改进了枯草芽孢杆菌芽孢脂质的提取方法,指出心磷脂在芽孢内膜上并参与芽孢萌发过程,但没有对内膜脂质的种类进行分析[11].
本文选取嗜热脂肪芽孢杆菌为试验菌株,结合芽孢的结构特点,利用碱性蛋白变性剂及溶菌酶分别去除芽孢的蛋白成分及肽聚糖皮层组分,使含有脂质的内膜裸露,通过烷化吖啶橙(NAO)荧光染色示踪剥除芽孢外层的效果.并利用传统的B & D 法提取芽孢内膜脂质,进而采用MALDI-TOF-MS 技术分析了芽孢脂质的指纹图谱,鉴定出芽孢内膜脂质的种类.本文探讨嗜热脂肪芽孢杆菌的芽孢结构,特别是内膜的脂质组学,对搞清芽孢在周围环境因子刺激下作出的应答机制具有重要意义.
1 材料与方法 1.1 试剂与仪器制备芽孢培养基的试剂及芽孢预处理试剂均为分析纯,购自Sigma 公司.用于脂质提取的试剂包括氯仿、甲醇等,为高效液相级试剂,购自Fisher Scientific公司,荧光染色剂10-壬基吖啶橙(NAO)购自Enzo公司,试验所用超纯水均由Milli-Q 纯水系统制备.
主要实验仪器有:水平摇床(Lab-line),高速冷冻离心机(Eppendorf),透射电子显微镜(TEM,PhilipsElecronics),相差显微镜及荧光显微镜(Olympus),4800 MALDI-TOF/TOF 质谱仪(AB Sciex)等.
1.2 芽孢的制备及预处理嗜热脂肪芽孢杆菌菌株( Geobacillus stearothermophilus NCTC 10003)由香港城市大学张汉扬教授保藏.芽孢的制备过程如下[10]:菌种活化并制备种子液后,按接种量0.1 %转入装有液体培养基(100 mL/500 mL)的三角瓶,60 ℃摇床发酵48 h.液体培养基(1 L)含有KH2PO4 0.99 g, Na2HPO4 6.30 g, NH4Cl 0.5 g, 葡萄糖1.35 g, 谷氨酸钠0.41 g, MgSO4·7H2O 24.65 mg, MnCl2·4H2O 1.97 mg, CaCl2·6H2O 2.19 mg.收集发酵液,6 000 r/min 下离心10 min 后去上清,反复用超纯水吹打菌体,去除沉淀上层营养细胞及孢子囊等非芽孢结构,在离心管底部形成乳白色沉淀,经相差显微镜确认95 %以上亮色菌体为芽孢后保存备用.
用于脂质提取的芽孢预处理过程如图 1 所示:添加1 mL 十二烷基磺酸钠(1.0 %)跟二硫苏糖醇(0.1 mol/L)(SDS-DTT,0.1 mol/L NaOH 调至pH 8.0) 的碱性蛋白变性剂到含有芽孢(约1010 个)的离心管内,60 ℃处理1 h 后转速6 000 r/min 下离心10 min 去除上清液,用超纯水洗5~10 次.经上述处理后的芽孢一部分备用,另一部分进一步经200 μg/mL 溶菌酶37 ℃处理0.5 h 后,洗净备用.
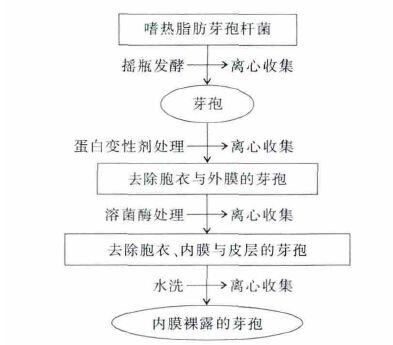 |
| 图 1 嗜热脂肪芽孢杆菌芽孢的制备及预处理过程 |
1.3 荧光染色及观察
荧光染色过程如下所述[14]:不同预处理过的芽孢与荧光染色剂NAO(200 nmol/L)在室温下分别孵育1 h 后,离心(转速10 000 r/min)10 min 去上清,沉淀用磷酸缓冲液(pH 值为7.2)进行清洗至去掉染色剂,然后在激发波长490 nm, 发射波长528 nm (绿色)及617 nm (红色)下进行荧光显微镜观察.
1.4 脂质的提取及MALDI-TOF-MS脂质的提取参照修改过的B & D 法[10]:碱性蛋白变性剂及溶菌酶处理过的芽孢加入1.2 mL 氯仿/甲醇(2/1,V/V)溶液,超声5 min(工作15 s, 间歇30 s),然后加入0.4 mL 超纯水进行分离.16 000 r/min 下离心10 min 后抽取下部的有机相转移到新的离心管内,上层液相用0.8 mL 氯仿重新提取,重复上述实验.最后收集到的有机相经氮吹法干燥,得到的脂质-80 ℃保存备用.
基质辅助激光解吸电离飞行时间质谱(MALDITOF-MS)分析[10]:1,5-二氨基萘酚(DAN,5 mg/mL)溶于50 %的乙腈(V/V)作为基质,与等量脂质样品混合后点到MALDI 板上.由于脂质种类的丰度不同,选取质荷比( m/z 为400~1 200)作为磷脂种类检测范围,质荷比(1 200~1 800)作为心磷脂种类检测范围.在负离子模式下,样品经MALDI-TOF 质谱仪检测后,收集的质谱数据由4000 Series Explorer program(version 3.5.2)收集,并利用Savitzky-Golay smoothingalgorithm 算法通过软件Data Explorer v.4.9 对数据进行分析.在LIPID MAPS 及MS 预测工具(http://www.lipidmaps.org/tools/index.html)辅助下确定磷脂的种类.
2 结果与讨论 2.1 芽孢的结构及芽孢性质透射电子显微镜图片显示,嗜热脂肪芽孢杆菌芽孢由多层结构组成.根据电子密度及参考文献表述[1],如图 2 所示,外层电子密较低的为孢外衣,密度较高的为芽孢衣,其它结构依次为肽聚糖、内膜、核芯等.孢外衣为空心囊状结构,芽孢衣又分为内衣与外衣,分别由几条电子密度不同薄层组成.皮层的成分为肽聚糖,内膜由脂质及蛋白质组成,核芯为核酸及吡啶羧酸钙组成.
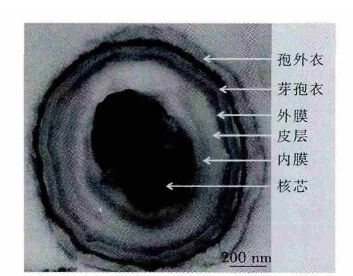 |
| 图 2 嗜热脂肪芽孢杆菌芽孢的透射电子显微镜图 |
结果表明,嗜热脂肪芽孢杆菌与枯草芽孢杆菌等菌属的芽孢结构类似.试验菌株孢外衣的结构与所报道同属菌种ATCC 7953 结果一致[15],却与其它菌属菌株的芽孢结构不同[16].虽然芽孢的结构具有菌属或菌种独特性,但是芽孢耐热的普遍性与孢衣蛋白以及核芯的吡啶羧酸钙相关;而芽孢内膜类似于营养细胞的质膜,由蛋白质及脂质组成,作为渗透屏障发挥作用,防止化学物质进入核心区破坏核酸等遗传物质[17].
2.2 芽孢外层剥离效果孢外衣及芽孢衣由60 多种蛋白分子构成,作为芽孢结构的第一道屏障,各种蛋白的生化性质保证了芽孢对大分子物质及酶类的抗性,因此很难用常规方法破壁[18-19].由于外层结构由蛋白质分子组成,因此将碱性蛋白变性剂应用于破除芽孢衣及其它蛋白构成的结构,如外膜等;皮层是位于芽孢衣及外膜下层的结构,由肽聚糖构成,能够被溶菌酶所降解[1-2].因此,实验设计如图 1 所示,对芽孢进行层层剥离以获得富含脂质的内膜结构.
根据NAO 与内膜心磷脂分子结合的原理,芽孢结构层层剥离的有效性通过荧光染色试验验证.如图 3所示,图 3(a)和图 3(b)分别为未处理的芽孢和只用蛋白变性剂处理过的芽孢,孢内NAO 着色不甚明显,而图 3(c)为经蛋白变性剂处理后又经溶菌酶处理过的芽孢,NAO 着色明显,表明芽孢外层剥离效果较好,能够得到含有心磷脂内膜外露的芽孢.虽然由于实验中漂洗程度不够导致图 3(a)和图 3(b)内的芽孢周围有荧光痕迹,但是前两种方法处理的芽孢内着色程度明显弱于后者,因此蛋白变性剂处理后经溶菌酶处理的方法,能有效除去芽孢外壳而获得裸露内膜的芽孢.
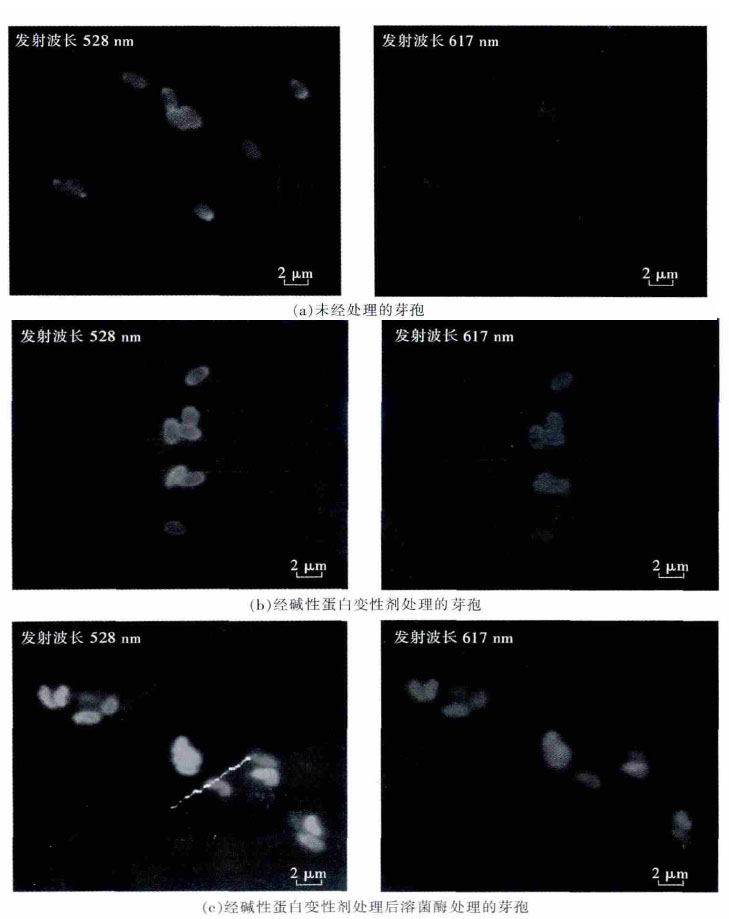 |
| 图 3 嗜热脂肪芽孢杆菌芽孢预处理荧光染色 |
2.3 芽孢脂质图谱分析
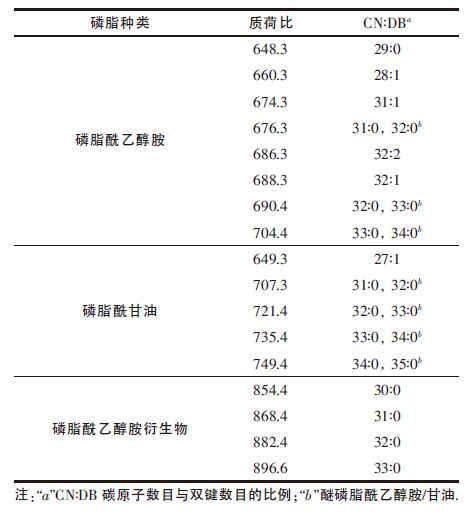
液相色谱与电喷雾电离串联质谱仪偶联(LC/ESI MS)等技术常用于脂质组学研究,但MALDIMS更加敏锐,对含盐及不纯的样品能够进行高通量分析[20-21].本文采用MALDI-TOF-MS 方法对芽孢内膜脂质进行脂质分析,通过比较相对强度得到优势离子,质荷比分布在范围600~900 之间(图 4),其中相对强度为100 %的波谱质荷比为676,结果与菌株细菌脂质一级质谱一致[10],所以推断脂肪链中碳原子数目及双键数目为31∶0 和32∶0,分别为磷脂酰乙醇胺和醚磷脂酰乙醇胺;同样地,质荷比为648,660,674,686,688,690,704 等离子也属于磷脂酰乙醇胺.而649,707,721,735,749 为磷脂酰甘油;质荷比为854,868,882,896 的母离子推断为磷脂酰乙醇胺衍生物(见表 1).因此,芽孢内膜磷脂的种类主要包括磷脂酰甘油、磷脂酰乙醇胺及其衍生物.
| 表1 图 4(a)中质谱中优势离子的属性 |
 |
| 点击放大 |
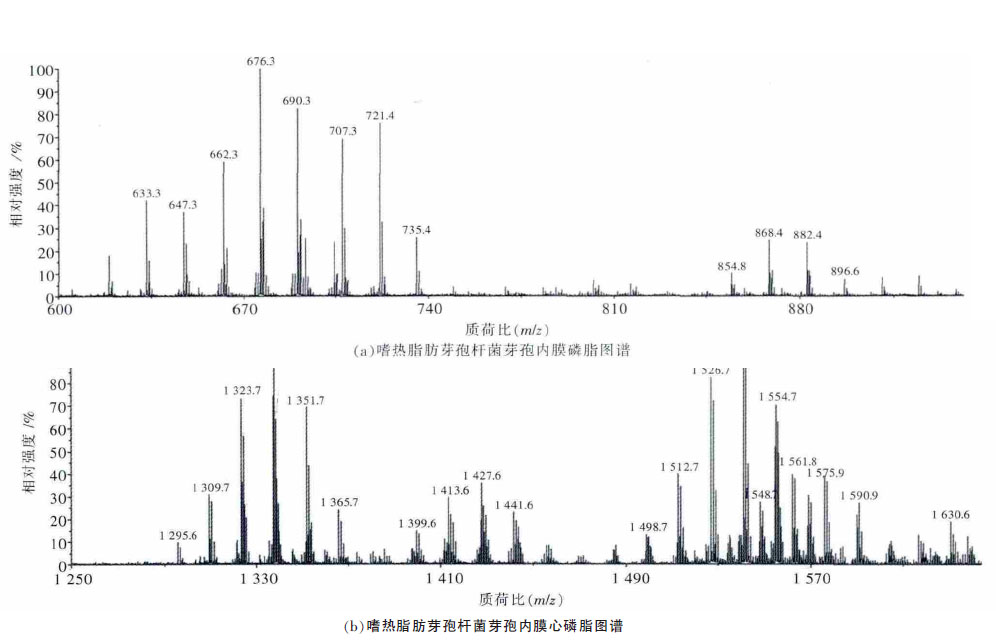 |
| 图 4 嗜热脂肪芽孢杆菌芽孢内膜脂质图谱 |
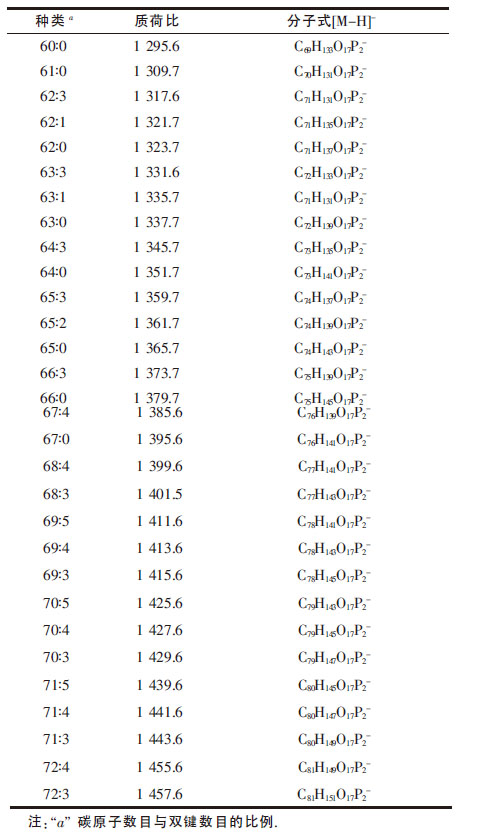
而由于心磷脂相对其它磷脂强度较低的原因,本文单独选取质荷比1 200~1 800 范围内进行检测,如图 4(b)所示,获得30 种相对强度较高的心磷脂,其分子式如表 2 所示.例如,质荷比为1 295.6 的波谱碳原子数目及双键数目为60︰0,分子式推断为C69H133O17P2-.其中相对强度最高的种类为63∶0,其次为62∶0.本文所获得的心磷脂种类与已报道的种类类似[22],除此之外还发现荷质比1 498.7 以上的分子为糖心磷脂,如1 512.7,1 526.7,1 540.7 等.
| 表2 嗜热脂肪芽孢杆菌芽孢心磷脂的种类 |
 |
| 点击放大 |
3 结论
1) 嗜热脂肪芽孢杆菌芽孢的结构类似于枯草芽孢杆菌芽孢的结构,此菌株芽孢最外层有孢外衣包被,其它结构由外至内分别是芽孢衣、外膜、皮层、内膜、核芯等.
2) 碱性蛋白变性剂SDS-DTT 能够有效除去芽孢外层由蛋白组成的结构,如孢外衣、芽孢衣及外膜等结构,溶菌酶能够进一步除去肽聚糖皮层结构,使内膜裸露于芽孢表面,易于传统B & D 法提取脂质.
3) MALDI-TOF-MS 是一种快速检测芽孢脂质组学的手段,通过分析,嗜热脂肪芽孢杆菌芽孢内膜脂质由磷脂酰甘油、磷脂酰乙醇胺及其衍生物、心磷脂组成.
| [1] |
Qin H, Driks A. Contrasting evolutionary patterns of spore coat proteins in two Bacillus species groups are linked to a difference in cellular structure[J].
BMC Evolutionary Biology, 2013, 13: 261–272. DOI: 10.1186/1471-2148-13-261. |
| [2] |
Li Y, Jin K, Setlow B, et al. Crystal structure of the catalytic domain of the Bacillus cereus SleB protein, important in cortex peptidoglycan degradation during spore germination[J].
Journal of Bacteriology, 2012, 194(17): 4537–4545. DOI: 10.1128/JB.00877-12. |
| [3] |
Troiano A J Jr, Zhang J, Cowan A E. Analysis of the dynamics of a Bacillus subtilis spore germination protein complex during spore germination and outgrowth[J].
Journal of Bacteriology, 2015, 197(2): 252–261. DOI: 10.1128/JB.02274-14. |
| [4] |
Setlow P. Dormant spores receive an unexpected wake-up call[J].
Cell, 2008, 135: 410–412. DOI: 10.1016/j.cell.2008.10.006. |
| [5] | 程琴, 黄庶识, 陈丽梅. 芽孢杆菌孢子萌发机理的研究进展[J]. 生 命科学, 2010, 22(9): 878–885. |
| [6] |
Alzahrani O M, Moir A. Spore germination and germinant receptor genes in wild strains of Bacillus subtilis[J].
Journal of Applied Microbiology, 2014, 117(3): 741–749. DOI: 10.1111/jam.2014.117.issue-3. |
| [7] |
Ross C, Abel-Santos E. The Ger receptor family from sporulating bacteria[J].
Current Issues in Molecular Biology, 2011, 12: 147–158. |
| [8] |
Paredes-Sabja D, Setlow P, Sarker M R. Germination of spores of Bacillales and Clostridiales species: Mechanisms and proteins involved[J].
Trends in Microbiology, 2011, 19(2): 85–94. DOI: 10.1016/j.tim.2010.10.004. |
| [9] |
Wilson M J, Carlson P E, Janes B K, et al. Membrane topology of the Bacillus anthracis gerH germinant receptor proteins[J].
Journal of Bacteriology, 2012, 194(6): 1369–1377. DOI: 10.1128/JB.06538-11. |
| [10] |
Dong W, Shen Q, Baibado J, et al. Phospholipid analyses by MALDI TOF/TOF mass spectrometry using 1,5 -diaminonaphthalene as matrix[J].
International Journal of Mass Spectrometry, 2013, 343-344: 15–22. DOI: 10.1016/j.ijms.2013.04.004. |
| [11] |
Kawai F, Hara H, Takamatsu H, et al. Cardiolipin enrichment in spore membranes and its involvement in germination of Bacillus subtilis Marburg[J].
Genes & Genetic Systems, 2006, 81(2): 69–76. |
| [12] |
Igarashi T, Setlow B, Paidhungat M, et al. Analysis of the effects of a gerF (lgt) mutation on the germination of spores of Bacillus subtilis[J].
Journal of Bacteriology, 2004, 186(10): 2984–2991. DOI: 10.1128/JB.186.10.2984-2991.2004. |
| [13] |
Okugawa S, Moayeri M, Pomerantsev A P, et al. Lipoprotein biosynthesis by prolipoprotein diacylglyceryl transferase is required for efficient spore germination and full virulence of Bacillus anthracis[J].
Molecular Microbiology, 2012, 83(1): 96–109. DOI: 10.1111/j.1365-2958.2011.07915.x. |
| [14] |
Petit J M, Maftah A, Ratinaud M H, et al. 10N-Nonyl acridine orange interacts with cardiolipin and allows the quantification of this phospholipid in isolated mitochondria[J].
European Journal of Biochemistry, 1992, 209: 267–273. DOI: 10.1111/ejb.1992.209.issue-1. |
| [15] |
Panessa-Warren B J, Tortora G T, Warren J B. High resolution FESEM and TEM reveal bacterial spore attachment[J].
Microscopy and Microanalysis, 2007, 13: 251–266. DOI: 10.1017/S1431927607070651. |
| [16] |
Permpoonpattana P, Phetcharaburanin J, Mikelsone A, et al. Functional characterization of Clostridium difficile spore coat proteins[J].
Journal of Bacteriology, 2013, 195: 1492–1503. DOI: 10.1128/JB.02104-12. |
| [17] |
Plomp M, Carroll A M, Setlow P, et al. Architecture and assembly of the Bacillus subtilis spore coat[J].
PLoS One, 2014, 9(9): e108560. DOI: 10.1371/journal.pone.0108560. |
| [18] |
Mundra R V, Mehta K K, Wu X, et al. Enzyme-driven Bacillus spore coat degradation leading to spore killing[J].
Biotechnology and Bioengineering, 2014, 111(4): 654–663. DOI: 10.1002/bit.25132. |
| [19] |
Permpoonpattana P, Phetcharaburanin J, Mikelsone A, et al. Functional characterization of Clostridium difficile spore coat proteins[J].
Journal of Bacteriology, 2013, 195: 1492–1503. DOI: 10.1128/JB.02104-12. |
| [20] | 蔡潭溪, 刘平生, 杨福全, 等. 脂质组学研究进展[J]. 生物化学与 生物物理进展, 2010, 37(2): 121–128. |
| [21] |
Garrett T A, O'Neill A C, Hopson M L. Quantification of cardiolipin molecular species in Escherichia coli lipid extracts using liquid chromatography/electrospray ionization mass spectrometry[J].
Rapid Communication inMass Spectrometry, 2012, 26(19): 2267–2274. DOI: 10.1002/rcm.6350. |
| [22] |
Sch覿ffer C, Beckedorf A I, Scheberl A, et al. Isolation of glucocardiolipins from Geobacillus stearothermophilus NRS 2004/3a[J].
Journal of Bacteriology, 2002, 184(23): 6709–6713. DOI: 10.1128/JB.184.23.6709-6713.2002. |
 2015, Vol.
2015, Vol. 

