| 硫化沉淀法回收镍镁液中的镍 |
在钴湿法冶金系统中,存在大量镍镁液.从镍镁液中回收有价金属镍不仅有较高的经济价值,且能大大降低污水处理的负担.目前,从镍镁液中回收镍的方法主要有溶剂萃取法、氢氧化物沉淀法和硫化物沉淀法.由于镍镁液中的镍浓度不高(约0.5 g/L),采用溶剂萃取法不仅一次性投入大,且运行成本高,回报不高,不宜实施. 与氢氧化物沉淀相比,硫化物沉淀法具有诸多优点,如:硫化物沉淀性能更好,反应速率快,对金属的选择性沉淀效果好,金属硫化物的溶解度更低等[1-2]. 硫化物沉淀法在金属的分离和富集[3-9]及废水处理方面[10-12]有着广泛的应用,相关报道也较多.工业上常用的硫化剂有H2S、Na2S、NaHS、Na2S2O3等含硫化合物[13].
本文以Na2S为沉淀剂,对镍镁液的沉淀工艺进行了研究.考察了Na2S用量、沉淀pH、反应温度、反应时间和陈化时间对Ni、Mg沉淀率和过滤性能的影响.
1 实 验 1.1 实验原料及设备实验原料:镍镁液,其主要成分为:Ni2+(0.58 g/L),Mg2+(0.33 g/L),pH=4.5、Na2S·9H2O(AR)、H2SO4溶液、NaOH溶液.
实验设备:恒温水浴锅,电动搅拌器,烧杯,分液漏斗,量筒,移液管,电位-pH计,温度计等.
1.2 实验与分析方法取一定体积的镍镁液于烧杯中,置于恒温水浴锅中升温并搅拌,取一定质量的Na2S•9H2O晶体并配置成质量分数为10 %的Na2S•9H2O溶液于分液漏斗中,在一定温度下将Na2S•9H2O溶液缓慢滴加至镍镁液中.反应一段时间后,停止搅拌,在一定温度下陈化一段时间.陈化一段时间后,抽滤,考察过滤性能,并用原子吸收法测定镍、镁的沉淀率.
2 结果与讨论查有关热力学数据文献[14]可知,硫化镍的溶度积(Ksp(α-NiS)=3.2×10-19)远大于硫化镁的溶度积(Ksp(MgS)=2.0×10-15).因此,采用硫化沉淀法沉淀镍镁液时,可通过控制Na2S的加入量,选择性沉镍,而大部分镁仍然留在溶液中,不仅能回收溶液中的大部分镍,还实现了镍镁的初步分离.
硫化物的沉淀率取决于溶液中S2-的浓度,而溶液中S2-的浓度主要由Na2S的投入量决定,因此,硫化物的沉淀率主要取决于Na2S的投入量.此外,溶液的pH值、反应温度、反应时间及陈化时间对沉淀率及过滤性能也有一定的影响.
2.1 Na2S用量为考察Na2S用量对Ni、Mg沉淀率的影响,其他实验条件固定为:反应过程pH值控制在4.0左右,反应温度60 ℃,反应时间2 h,陈化时间1 h.
Na2S沉镍镁液的目的是尽可能将镍沉淀完全,而少沉淀镁,以提高镍的回收率及沉淀中镍的品位.Na2S的用量是以将镍镁液中的镍沉淀完全,而镁不沉淀所需的理论用量为基准,分别用完全沉镍所需Na2S理论用量的1.0至1.5倍沉淀镍镁液,Na2S用量对Ni、Mg沉淀率影响的实验结果如图 1所示.
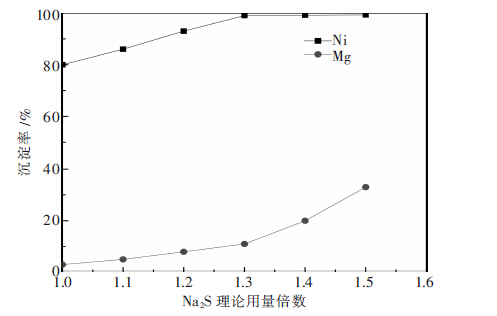 |
| 图 1 Na2S用量对Ni、Mg沉淀率的影响 |
由图 1可知,随着Na2S用量的增加,提供的S2-越多,Ni、Mg的沉淀率均有所升高.当Na2S用量为沉镍理论用量的1.0~1.3倍时,镍的沉淀率增加速度较快,而镁的沉淀率增加速度相对较慢;当Na2S用量为沉镍理论用量的1.3~1.5倍时,镍的沉淀率基本不变,而镁的沉淀率增加速度较快.其原因可能为,当Na2S用量为沉镍理论用量的1.0~1.3倍时,Na2S提供的S2-不足于沉下所有的镍,随着Na2S用量的增加,增加的S2-主要用于沉淀Ni,因此,镍的沉淀率增加速度较快,而镁的沉淀率增加速度较慢;当Na2S用量为沉镍理论用量的1.3倍时,镍基本沉淀完全, 随着Na2S用量的进一步增加,增加的S2-主要用于沉淀Mg,因此,镍的沉淀率变化不大,而镁的沉淀率迅速增加.当Na2S用量为沉镍理论用量的1.3倍时,镍基本沉淀完全,而镁的沉淀率较低,因此,Na2S的最佳用量为沉镍理论用量的1.3倍.
2.2 沉淀pH值为考察沉淀过程中pH值对Ni、Mg沉淀率的影响,其他实验条件固定为:Na2S用量为沉镍理论用量的1.3倍,反应温度60 ℃,反应时间2 h,陈化时间1 h.实验中,通过滴加稀H2SO4或者NaOH控制溶液的pH值,沉淀过程pH值对Ni、Mg沉淀率影响的实验结果如图 2所示.
由图 2可知,沉淀过程pH对Ni、Mg沉淀率的影响较大,在一定pH值范围内,随着pH值的升高,Ni、 Mg的沉淀率均有所提高.原因可能为,Na2S在沉淀过 程中有部分S2-水解[15],水解反应式为:
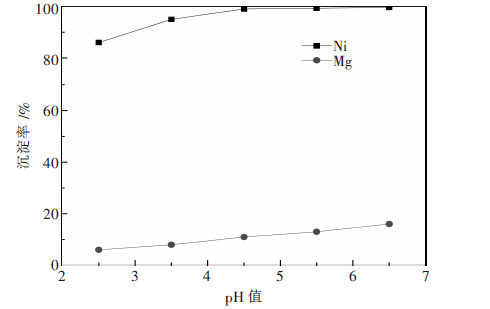 |
| 图 2 沉淀过程pH值对Ni、Mg沉淀率的影响 |
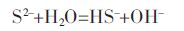
|
(1) |
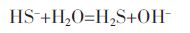
|
(2) |
沉淀pH值越高,平衡向左移动,不利于水解,有 利于沉淀,因此,沉淀率升高.从图 2中可知,当沉淀 pH=4.5时,镍基本沉淀完全,而镁的沉淀率较低,最优的沉淀pH值为4.5.
2.3 反应温度为考察反应温度对Ni、Mg沉淀率的影响,其他 实验条件固定为:Na2S用量为沉镍理论用量的1.3 倍,反应过程pH值控制在4.0左右,反应时间2 h,陈化时间1 h.反应温度对Ni、Mg沉淀率影响的实验 结果如图 3所示.
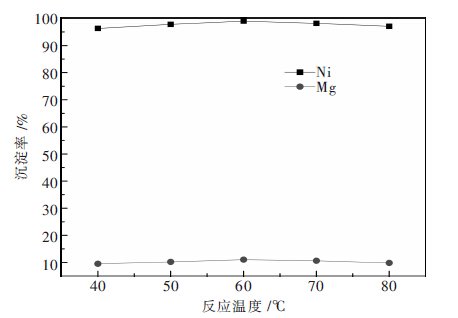 |
| 图 3 反应时间对Ni、Mg沉淀率的影响 |
由图 3可知,反应温度对Ni、Mg沉淀率影响不大.当温度小于60℃时,Ni、Mg的沉淀率随反应温 度的升高均略有升高,反应温度为60℃时,Ni、Mg的 沉淀率达最大,继续升高反应温度,Ni、Mg的沉淀率有所下降.原因可能是,随着温度的升高,S2-转化为S0的转化率越大,N2S的利用率低,导致Ni、Mg沉淀率下降.
此外,由结晶过程动力学[16]可知,升高温度可加快沉淀过程的核和生长速率,且生长速率比成核速率增加得更快,因此,升高温度有利于大颗粒沉淀的形成,有利于过滤.
当反应温度为60℃时,镍的沉淀率达到最大值,且过滤性能较好.因此,最优的沉淀温度为60℃.
2.4 反应时间为考察沉淀时间对Ni、Mg沉淀率的影响,其他实验条件固定为:N2S用量为沉镍理论用量的1.3 倍,反应过程pH值控制在4.0左右,反应温度60℃,陈化时间1 h.反应时间对Ni、Mg沉淀率影响的实验结果如图 4所示.
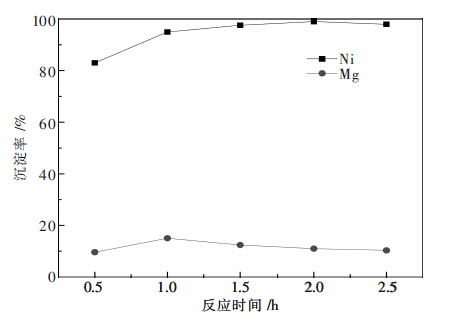 |
| 图 4 反应时间对Ni、Mg沉淀率的影响 |
由图 4可知,随着反应时间的延长,Ni沉淀率逐 升高,而Mg的沉淀率呈现现增加后降低的态势.原因可能为,当反应时间于1 h时,由于反应时间过短,S2-反应不完全,因此镍和镁的沉淀率均较低,随着反应时间的长,Ni、Mg沉淀率均有所提高;当反应时间为lh时,Mg的沉淀率达最大,原因可能是,在滴加Na2S过程中由于部S2-的度过高,Mg2+过沉淀;随着反应时间的进一;长,NiS、MgS沉淀 中的S2-于沉淀-解平衡 ,由于局部S2-度过高而过沉淀的MgS溶解,的S2-与Ni2+反应生成NiS,直至沉淀-解平衡于稳定.因此,当反应时间大于1 h时,继续延长反应时间,Ni的沉淀率升高,而Mg的沉淀率低. 当反应时间为2 h时,Ni的沉淀率达到最大值,而 Mg的沉淀率较低,最优的反应时间为2 h.
2.5 陈化时间为考察陈化时间对Ni、Mg沉淀率的影响,其他 实验条件固定为:Na2S用量为沉镍理论用量的1.3 倍,反应过程pH值控制在4.0左右,反应温度60℃,反应时间2 h.陈化时间对Ni、Mg沉淀率影响的实验 结果如图 5所示.
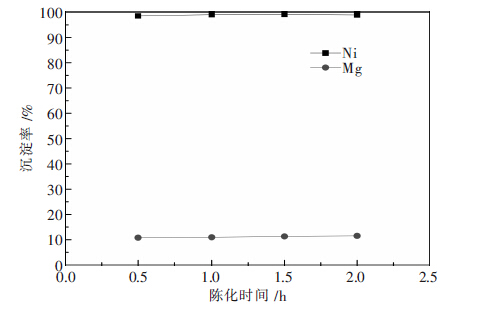 |
| 图 5 陈化时间对Ni、Mg沉淀率的影响 |
由图 5可知,陈化时间对Ni、Mg沉淀率的影响很小,但对过滤性能的影响较大.当陈化时间小于0.5 h时,过滤速度较慢,且有明显的穿滤现象;当陈化时间为1 h时,过滤性能较好,穿滤现象也基本消失,继续延长陈化时间,过滤速度基本不变.因此,最优的陈化时间为1 h.
2.6 综合性实验通过单因素实验确定最优的工艺条件为:Na2S用量为沉镍理论用量的1.3倍,反应过程pH值控制在4.5左右,反应温度60 ℃,反应时间2 h,陈化时间1 h.在最优工艺条件下重复实验3次,实验结果分别为:第1次实验Ni、Mg沉淀率分别为99.2 %、11.3 %;第2次实验Ni、Mg沉淀率分别为98.8 %、10.5 %;第3次实验Ni、Mg沉淀率分别为99.3 %、10.9 %,过滤性能均较好,无穿滤现象,实验的重复性很好.在最优工艺条件下沉淀镍镁液,Ni的回收率很高,而只有少量的Mg进入渣中.
3 结 论1)Ni、Mg沉淀率的主要影响因素为Na2S用量、反应过程pH和反应时间,而与反应温度和陈化时间关系不大;
2)沉淀过程的反应温度和陈化时间对过滤性能的影响很大,较高的反应温度和较长的陈化时间有利于得到大颗粒沉淀,有利于改善过滤性能和防止穿滤现象;
3)在最优工艺条件下沉淀镍镁液,Ni沉淀率可达99 %以上,而Mg沉淀率为11 %左右,过滤性能良好,无穿滤现象.Ni的回收率很高,且实现了Ni、Mg的初步分离.
| [1] |
Lewis A E. Review of metal sulphide precipitation[J].
Hydrometallurgy, 2010, 104(2): 222–234. DOI: 10.1016/j.hydromet.2010.06.010. |
| [2] | 苏平. 硫化物沉淀法及其对金属硫化物去除率的探讨[J]. 中国有色冶金, 2009(4): 6–10. |
| [3] | 李金辉, 周友元, 熊道陵, 等. 硫化法分离红土矿中镍铁的研究[J]. 矿冶工程, 2010, 30(1): 47–50. |
| [4] | 刘建华, 洪德恩, 潘勇, 等. 从溶液中沉淀钴的方法选择试验[J]. 湿法冶金, 2008, 27(3): 151–153. |
| [5] | 徐彦宾, 谢燕婷, 闫兰, 等. 硫化物沉淀法从氧化镍矿酸浸液中富集有价金属[J]. 有色金属(冶炼部分), 2006(3): 8–10. |
| [6] |
Xu Y B, Xie Y T, Liu J S, et al. Enrichment of valuable metals from the sulfuric acid leach liquors of nickeliferous oxide ores[J].
Hydrometallurgy, 2009, 95(1/2): 28–32. |
| [7] |
Henry H T, Richard S, John B. Advances in biotreatment of acid mine drainage and biorecovery of metals:metal precipitation for recovery and recycle[J].
Biodegradation, 2003, 14(3): 423–426. |
| [8] | 曾德文, 李作刚, 谭鹏夫, 等. 硫化沉镍条件的热力学分析[J]. 中国有色金属学报, 1996, 6(3): 38–41. |
| [9] |
Oktaybas C, Acma E, Arslan C, et al. Kinetics of copper precipitation by H2S from sulfate solutions[J].
Hydrometallurgy, 1994, 35(1): 129–137. DOI: 10.1016/0304-386X(94)90024-8. |
| [10] | 黄鸣荣, 高国玉, 何晓弟. 含汞废水处理方法的研究[J]. 化工设计, 2010, 20(2): 33–35. |
| [11] | 谭浩强, 吴维, 刘志滨, 等. 化学沉淀法去除水中镉的特性研究[J]. 供水技术, 2010, 4(4): 9–11. |
| [12] | 赵丛珏, 刘志滨, 马越, 等. 化学沉淀法去除水中镍的研究[J]. 城镇供水, 2011(2): 100–102. |
| [13] | 刘三平, 王海北, 蒋开喜, 等. 钴提取分离技术分析与应用[J]. 有色金属, 2004, 56(2): 73–76. |
| [14] | 梁英教. 无机物热力学数据手册[M]. 沈阳: 东北大学出版社 , 1993. |
| [15] | 王淀佐, 胡岳华. 浮选溶液化学[M]. 长沙: 湖南科学技术出版社 , 1988. |
| [16] | 王萍, 李国昌. 结晶学教程[M]. 北京: 国防工业出版社 , 2006. |
 2015, Vol. 6
2015, Vol. 6

