| CaO对钠铁硼磷玻璃体系结构及固砷效果影响 |
2. 国家重金属污染防治工程技术研究中心,长沙 410083
2. Chinese National Engineering Research Center for Control and Treatment of Heavy Metal Pollution, Changsha 410083, China
铁磷酸盐玻璃具有独特的化学稳定性,被广泛应用于高放射性核废料和其它危险废物的玻璃固定[1].与传统的硼硅酸盐玻璃材料相比,铁磷酸盐玻璃用于危险废物的固定时,融熔温度可以低至1 200 K,包容量多出40%[2],因此铁磷酸盐玻璃在危险废物玻璃固化领域应用受到了研究人员的极大关注.P.A.Bingham等[3]研究认为摩尔组成为40% Fe2O3-60% P2O5铁磷酸盐玻璃是所有铁磷二元体系中化学性质最稳定的基础玻璃.为了获得物理、化学性能更加优异的玻璃固化体,研究人员以40% Fe2O3-60% P2O5为基础玻璃材料,通过引入玻璃网络修饰体,如一价阳离子(Li,Na,K)或者二价阳离子(Mg,Ca,Ba,Pb)氧化物来改变其性质,使玻璃固化体中目标物浸出量降低.Andrea Mogus-Milankovic等[4]将B2O3以部分替换Fe2O3的形式加入铁磷酸盐玻璃体系中,形成摩尔组成为xB2O3-(40-x) Fe2O3-60P2O5(x=0~20%)铁硼磷酸盐玻璃体系,其热稳定性能得到了提高,对危险废物的固化效果得到了加强;B.C.Sales等[1],通过往铁磷酸盐基础玻璃体系中引入氧化铅,得到了组成为(40~66) PbO-(1~10) Fe2O3-(30~55) P2O5铁铅磷酸盐玻璃体系,与硼硅酸盐玻璃固化材料相比,其腐蚀速率减少了1 000倍,有效降低有害元素的浸出,同时处理工艺温度降低了100~250 ℃;黄文旵等[5]将Cr2O3以添加剂的形式引入铁磷酸盐玻璃体系中,考察了不同Cr2O3添加量对铁磷玻璃固化体的结构和性质的影响,与空白体系对比,Cr2O3的加入能够抑制各种离子从玻璃固化体中沥析出来,改善玻璃固化体的化学耐蚀性;Y.M.Lai等[6]将氧化铈以不同的添加方式加入铁磷玻璃体系中,形成了摩尔组成为I:xCeO2-(40-x) Fe2O3-60P2O5和II:xCeO2-(100-x)(40Fe2O3-60P2O5)(x=0~30%)铈铁磷玻璃体系,其中只有I形成了玻璃体系,通过红外和拉曼光谱分析,随着CeO2量的增加,体系中的P-O-P结构开始解体,同时桥氧结构由Q1转变为Q2,玻璃体系的热稳定性能增强.在考察铁磷玻璃体系对危险废物固定效果时,这些危险废物大都以氧化物的形式如Na2O,Cs2O,Cr2O3,UO2等[7]添加到40%Fe2O3-60%P2O5中,由于这些氧化物大都是网络外体,会破坏玻璃网络结构扩展,弱化玻璃网络,而一些含砷氧化物(如As2O3)是一种较强的网络形成体,在铁磷玻璃体系中能直接形成As-O-P、As-O-Fe等化学结构,强化玻璃网络结构,从而使砷在玻璃中得到固定.
通过对铁磷玻璃固砷的系统研究,得到了一种固砷效果较好的钠铁硼磷玻璃体系,其摩尔组成为30%Na2O-2.8%B2O3-25.2%Fe2O3-42%P2O5,为了优化固化体对含砷危险废物的固化性能,可以通过引入二价阳离子如Zn2+[8-9]、Ba2+[3]、Pb2+、Ca2+[2]来改善固化体的物理、化学性质,同时一些研究表明通过引入CaO可以明显提高铁磷玻璃对危险废物固化体的化学稳定性[2-10],而CaO对钠铁硼磷玻璃体系固砷性能的影响的研究尚未见报导,因此本文在此基础之上系统的研究了二价阳离子氧化物CaO对钠铁硼磷玻璃体系固砷效果的影响,通过采用XRD、FI-TR以及DTA等分析技术研究xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)(x=0、5%、10%、20%)玻璃体系对砷的固定效果,找出CaO影响钠铁硼磷玻璃固砷的机理.
1 实验材料和方法 1.1 实验材料实验所需要的Na3AsO4·12H2O,CaO,H3BO3,Fe2O3,NH4H2PO4,Na2CO3均为分析纯.按照摩尔组成xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)(x=0、5%、10%、20%)分别称取一定的药品(其中Na2O、B2O3、P2O5分别以Na2CO3,H3BO3,NH4H2PO4的形式加入),同时在各批次实验中加入Na3AsO4·12H2O,使As达到总固体6.2%,不同CaO摩尔含量的玻璃固砷体组成见表 1.将原料均匀混合后置于陶瓷坩埚中加热,升温速率为10 ℃/min,在220 ℃时保温2 h,让固体样品中的Na3AsO4·12H2O,NH4H2PO4充分分解,随后再以相同的升温速率加热至1 000 ℃,保温1 h后取出置于空气中冷却至室温.
| 表1 xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)玻璃摩尔分数组成/% |
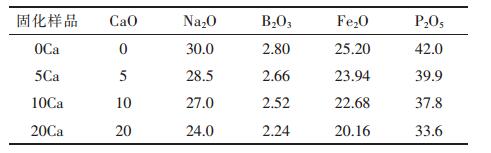 |
| 点击放大 |
1.2 分析方法
1)砷固化性能.玻璃固化体中砷的浸出特性采用TCLP法分析:对固化体进行破碎过筛使固体颗粒尺寸小于9.5 mm,采用pH值为2.88±0.05的醋酸浸提液,按照液固比为20:1进行浸出,浸提方式采用反转震荡法,转速为(30±2) r/min,浸提时间为(18±2) h,浸提结束后过滤分析.玻璃固化体消解液(固体颗粒震磨后采用王水消解)和浸出液采用电感耦合等离子体光谱法(ICP,iCAP6300)测定.
2)固化体结构分析.玻璃固化体中晶体采用X射线衍射(XRD,D/Max 2500 VB+X)法检测,采用Cu靶Ka射线,Ni滤波片,波长为0.154 06 nm,管压为40 kV,采用连续扫描2θ,扫描范围10°~80°,数据收集步长0.02°,扫描速度4°/min;玻璃固化体结构特征采用红外光谱法(FI-IR,Nicolet IS10)测定,扫描波数范围为400~4 000 cm-1;玻璃固化体稳定性能采用差热分析(DTA,STA449F3A-0488M),取玻璃固化体试样40~50 mg,在氮气条件下,从室温以10 ℃/min速率升温至1 000 ℃.
2 结果与讨论 2.1 CaO对玻璃固砷体物相影响不同CaO摩尔分数固砷体的XRD分析结果如图 1所示.
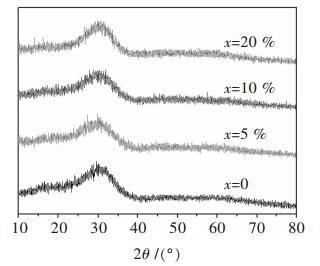 |
| 图 1 x CaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)X-射线衍射结果 |
由图 1可知,当CaO摩尔分数从0~20%时,XRD衍射峰形状基本一致,峰型较平缓没有检测到明显、尖锐的衍射峰,固化体中的物质呈现出明显的非晶状态.高温烧结后的玻璃固砷体呈现出均匀的黑色玻璃态,CaO的加入并没有明显改变钠铁硼磷玻璃体系的物相状态,砷在玻璃体系中的存在状态没有发生明显变化,这表明钠铁硼磷固砷体系对CaO有较好的包容性[11].
图 2为钠铁硼磷玻璃固砷后的透射电镜像,由图 2可知钠铁硼磷玻璃在固砷前后都呈现出均匀的一致性.当CaO摩尔分数从0~20%时,固砷体在微观上仍表现为单一相,这表明CaO加入钠铁硼磷玻璃体系之中后并没有产生相分离情况,CaO没有改变原来玻璃态结构的固砷体,表明CaO能够有效的溶解在钠铁硼磷玻璃固砷体中而不改变其原来的物相状态.
 |
| 图 2 xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)透射电镜像 |
2.2 CaO对玻璃固砷体浸出毒性和固砷率影响
图 3是钠铁硼磷玻璃固砷体系中加入不同CaO摩尔分数时,玻璃固砷体TCLP浸出毒性试验中砷浸出液浓度以及玻璃固化体中砷固化率.
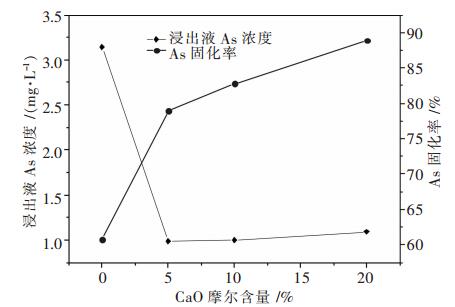 |
| 图 3 xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)砷浸出率及固化率 |
由图 3可知,CaO的加入使得钠铁硼磷玻璃固砷体对砷的固化效果得到显著增强--砷的浸出浓度显著降低,固化率明显增加.钠铁硼磷玻璃体中没有添加CaO时,砷的浸出浓度为3.14 mg/L,当添加5%CaO时,砷的浸出浓度显著下降,从3.14 mg/L降低至0.99 mg/L,随着CaO摩尔分数继续增加,砷的浸出浓度基本不变,在1 mg/L左右;同时由图 3可知,砷在玻璃固化体中的固化率随着CaO摩尔分数增加而明显提高.玻璃固砷体中没有添加CaO时,砷的固化率为60.78%,当CaO摩尔分数从5%增加到20%时,砷的固化率从78.92%增加到88.87%,这是因为As2O3作为一种比较强的网络形成体,在玻璃结构中是以AsO3结构单元通过共用顶角原子形成玻璃网络链,在钠铁硼磷玻璃体系中进行固砷时,由于As2O3的加入使得玻璃体系内的非桥氧数量减少,玻璃结构中的网络形成体链增长[12],而在此基础之上加入比较强的网络外体CaO,非桥氧以及Ca2+的加入使得玻璃结构中网络链解聚,形成化学稳定性较强的As-O-M (M=Fe、Ca)、P-O-M (M=Fe、Ca键)[11],从而使玻璃固化体的化学稳定性随着CaO摩尔分数增加而加强[3],使砷的浸出率显著降低,固化率明显提高.
2.3 CaO对玻璃固砷体结构影响为了研究CaO对钠铁硼磷玻璃固砷体结构的影响,采用傅里叶红外吸收光谱,分析波数在400~4 000 cm-1内,xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)(x=0、5%、10%、20%)红外吸收情况,主要特征峰分布在548 cm-1,668 cm-1,1 058 cm-1以及2 343 cm-1处,其中2 343 cm-1处峰是CO2吸收峰[12],由于这些分峰主要分布在低频区(400~1 400 cm-1),并且呈现出不对称的峰肩形状,因此有必要对这个区间的低频峰进行高斯分峰,通过低频区分峰可以得到一系列的分峰如图 4所示.
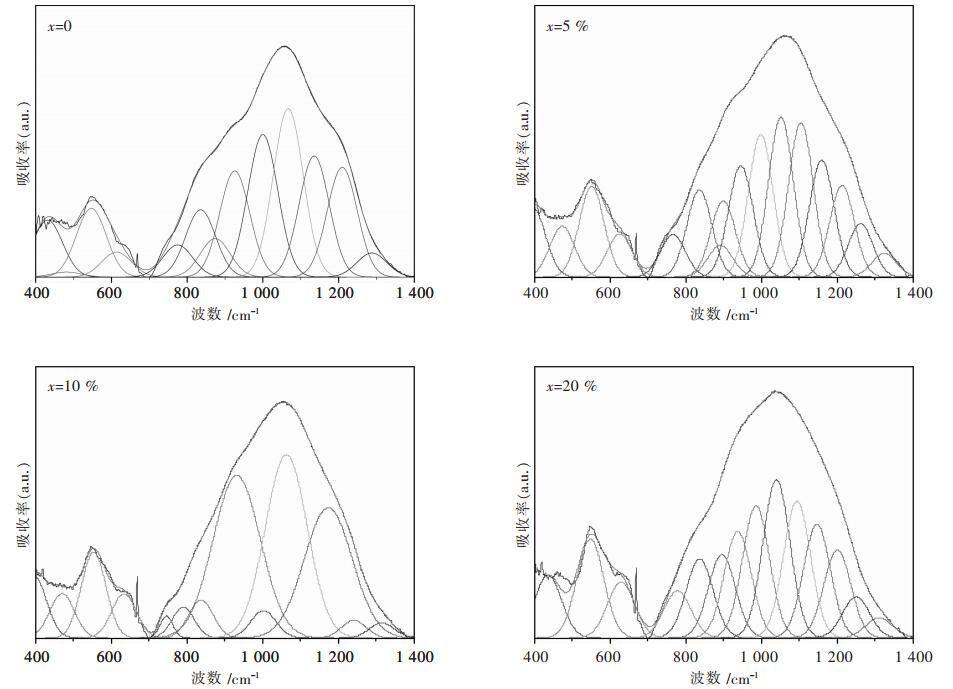 |
| 图 4 xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)红外分峰图 |
从图 4可知,钠铁硼磷固砷体系没有加入CaO,即x=0时,分峰后的主要特征峰位置在431.3 cm-1,481.0 cm-1,546.7 cm-1,613.8 cm-1,775.0 cm-1,835.4 cm-1,874.0 cm-1,925.5 cm-1,999.8 cm-1,1 066.9 cm-1,1 135.5 cm-1,1 209.5 cm-1,1 287.9 cm-1处.其中420~700 cm-1处可能包含P-O-对称伸缩振动和不对称伸缩振动[13],以及O-P-O和Fe-O的伸缩振动[13].481.0 cm-1处的振动可能是O-P-O的弯曲振动峰[14];546.7 cm-1处可能是Q1结构单元中的P-O-P弯曲振动结构[15];613.8 cm-1以及999.8 cm-1可能是P-O-Fe的伸缩峰[16];775.0 cm-1以及925.5 cm-1处可能是对称O-P-O桥氧峰[16];835.4 cm-1处可能是Q1结构单元中的P-O-P反对称振动[17];874.0 cm-1处可能是偏磷酸盐中的P-O-P反对称伸缩振动[18];1 066.9 cm-1处可能是Q0结构中的PO43-对称振动[19];1 135.5 cm-1处振动与Q2结构中的(PO2)-反对称结构有关;1 209.5 cm-1,1 287.9 cm-1处的振动是P=O反对称伸缩振动的特征峰[19],当加入不同摩尔分数CaO时,相应的结构单元以及相对含量如表 2所示.
| 表2 xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)分峰结果 |
 |
| 点击放大 |
钠铁硼磷固砷体系加入CaO后,对玻璃固砷体系中的Qn结构单元产生了一定的影响:没有加入CaO,即x=0时,玻璃固砷体系中Q1、Q2结构单元分别占17.3%、12.5%.当CaO摩尔分数由5%变化至20%时,Q1、Q2结构单元分由28.7%、8.7%变化至31.1%、3.3%,这表明钠铁硼磷固砷体中加入CaO对玻璃固砷体系的桥氧结构产生了解聚效应--随着CaO摩尔分数的增加,玻璃固砷体系中Q2结构开始解聚,Q1结构增加.Q2结构的减少,Q1结构的增加,直接反映了玻璃结构中的网络形成体链被破坏,被破坏的桥氧结构和玻璃中的金属氧化物形成P-O-M (M=Fe、Ca)等化学键,同时,由于同时Ca2+产生集聚作用,使玻璃结构得到加强.FI-IR分峰结果也显示出玻璃结构中P-O-M (M=Fe、Ca)结构的形成,玻璃体系的结构得到加强[20],从而使砷在玻璃中的固定效果得到加强.
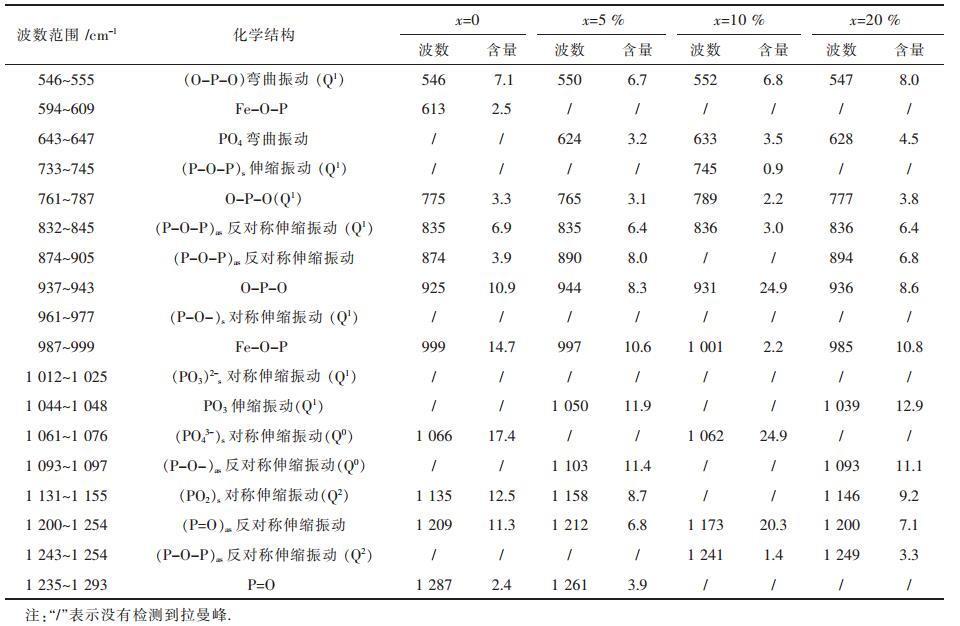
2.4 CaO对玻璃固砷体密度影响加入CaO后的玻璃固砷体的密度变化可以从侧面反映出玻璃固砷体的结构、交联度以及致密性变化情况[21].由图 5可知随着CaO摩尔分数从0增加至20%,玻璃固砷体的密度由2.80 g/cm3变化至3.12 g/cm3,玻璃固化体的密度随着CaO摩尔数增加,表明氧化钙可以有效溶解在钠铁硼磷玻璃体系中,同时溶解在玻璃体系中的氧化钙能够进入玻璃固砷体的网络结构中,使磷酸盐结构解聚,对非桥氧结构产生集聚作用并形成Ca-O-As、Ca-O-P等化学键,从而使玻璃体系的结构增强,玻璃致密度增加,这与红外分析结果相一致.
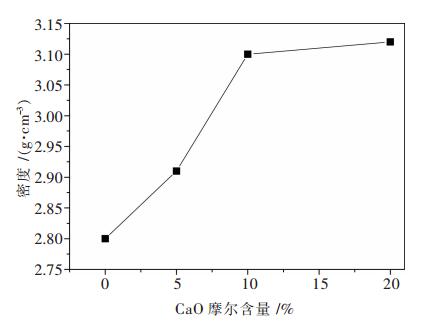 |
| 图 5 xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)密度变化图 |
2.5 CaO对玻璃固砷体稳定性能影响
Bin Qian等[22]研究表明玻璃转变温度(Tg)大小的变化可以反映出玻璃结构强弱变化情况,玻璃转变温度的增加表明玻璃结构得到增强.同时,史美清等[23]研究表明玻璃固砷体的转变温度和开始析晶温度(Tr)差与玻璃结构的热稳定性有关,即△T(△T=Tr -Tg)越大,玻璃结构越稳定.因此通过对钠铁硼磷玻璃固砷粉末进行差热分析可以得到与其结构相关的温度参数,从而可以判断CaO的加入对钠铁硼磷玻璃固砷体热稳定性的影响.
由图 6分析可知,当钠铁硼磷玻璃固砷体系中没有加入CaO,即x=0时,玻璃转化温度出现在517.2 ℃处,玻璃固砷体开始析晶温度出现在583 ℃处.研究表明Tg、Tr与玻璃结构稳定性能紧密相关,Tg越大,玻璃结构越稳定[24],同时△T越大,玻璃热稳定性能越好[11].由图 6可知,钠铁硼磷固砷体系Tg、△T均随着CaO摩尔分数的增加而呈现出增加趋势--CaO添加量为0时,Tg、△T分别为517.2 ℃、51.8 ℃,当CaO增加至20%时Tg、△T为547 ℃、71.6 ℃.钠铁硼磷固砷体系Tg、△T随着CaO摩尔添加量增加而增加的趋势反映出玻璃固砷体系在结构、热稳定性上得到加强,这表明CaO的加入有助于增强钠铁硼磷玻璃固砷体的结构以及提高玻璃固砷体系的热稳定性.CaO作为网络外体加入体系中后,破坏了玻璃固化体原有的网络结构,使得非桥氧数量增多,桥氧结构减弱,P-O-P等化学键被破坏,同时加入的CaO会形成化学稳定性较高的As-O-M (M=Fe、Ca)、P-O-M (M=Fe、Ca)[11]键,使得钠铁硼磷玻璃固砷体系的结构增强,热稳定性增加.此外,玻璃固砷体系中的Ca2+也会增加了非桥氧磷酸盐之间的交联[11],使得玻璃体系中的交联度增加,结构加强,这和红外分析中的结果一致.
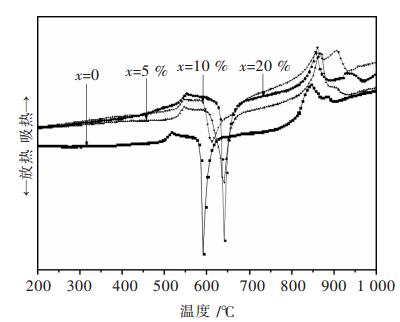 |
| 图 6 xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)DTA图 |
3 结论
采用浸出毒性实验(TCLP)、x-射线衍射(XRD)、傅里叶红外(FI-IR)以及差热分析(DTA)等分析手段研究了CaO对xCaO-(100-x)(30Na2O-2.8B2O3-25.2Fe2O3-42P2O5)(x=0、5%、10%、20%)玻璃体系结构及砷固定效果的影响,对钠铁硼磷玻璃体系固砷性能及结构性质进行表征.结果表明:
1) CaO的加入可以明显提升钠铁硼磷玻璃体系的固砷效果,与未加入CaO相比,加入20%CaO的固化体砷浸出浓度由3.14 mg/L降低至0.99 mg/L,固砷率从60.78%增加到88.87%.
2) FI-IR研究表明CaO的加入,会破坏钠铁硼磷玻璃固砷体系中Q2桥氧结构,玻璃网络化程度降低,结构加强;钠铁硼磷玻璃固砷体密度分析表明,加入体系中的CaO能够进入玻璃固砷体的网络结构中,使磷酸盐结构解聚,并对非桥氧结构产生集聚作用同时形成Ca-O-As、Ca-O-P等化学键,使玻璃体系的结构增强,玻璃致密度增加;
3) DTA分析表明随着CaO摩尔分数增加,Tg、△T呈现增大的趋势,玻璃结构得到增强,同时Ca2+对非桥氧磷酸盐之间的交联,对固砷效果也有较大的影响.
| [1] |
Sales B C, Boatner L A. Lead-iron phosphate glass: A stable storage medium for high-level nuclear waste[J].
Science, 1984, 226(4670): 45–48. DOI: 10.1126/science.226.4670.45. |
| [2] |
Moguš-Milanković A, Šantić A. Studies of lead-iron phosphate glasses by Raman, Mössbauer and Impedance spectroscopy[J].
Journal of Non-Crystalline Solids, 2005, 351(40/41/42): 3246–3258. |
| [3] |
Bingham P A, Hand R J. Effects of modifier additions on the thermal properties, chemical durability, oxidation state and structure of iron phosphate glasses[J].
Journal of Non-Crystalline Solids, 2009, 355(28/29/30): 1526–1538. |
| [4] |
Moguš-Milanković A, Pavić L. Polaronic mobility in boron doped iron phosphate glasses: Influence of structural disorder on summerfield scaling[J].
Journal of the American Ceramic Society, 2012, 95(6): 2007–2014. DOI: 10.1111/jace.2012.95.issue-6. |
| [5] | 黄文旵, 周萘. Cr2O3对高放核废料磷酸盐玻璃固化体的影响[J]. 无机材料学报, 2005, 20(4): 842–850. |
| [6] |
Lai Y, Liang X. Raman and FTIR spectra of iron phosphate glasses containing cerium[J].
Journal of Molecular Structure, 2011, 992(1): 84–88. |
| [7] |
Saudy H A, El Mosallamy S. Mechanical, thermal and chemical durability behaviors of CdO-Bi2O3 Boro-Phosphate glasses containing Fe2O3[J].
World Journal of Condensed Matter Physics, 2013(3): 9. |
| [8] |
Reis S, Karabulut M. Chemical durability and structure of zinc-iron phosphate glasses[J].
Journal of Non-Crystalline Solids, 2001, 292(1): 150–157. |
| [9] |
Reis S, Moguš-Milanković. An iron redox equilibrium, structure and properties of zinc iron phosphate glasses[J].
Journal of non-crystalline solids, 2007, 353(2): 151–158. DOI: 10.1016/j.jnoncrysol.2006.10.002. |
| [10] |
Kumar B, Lin S. Redox state of iron and its related effects in the CaO-P2O5-Fe2O3 glasses[J].
Journal of the American Ceramic Society, 1991, 74(1): 226–228. DOI: 10.1111/jace.1991.74.issue-1. |
| [11] |
Qian B, Liang X. Structure and properties of calcium iron phosphate glasses[J].
Journal of Nuclear Materials, 2013, 443(1): 140–144. |
| [12] |
Charpentier F, Bureau B. Infrared monitoring of underground CO2 storage using chalcogenide glass fibers[J].
Optical Materials, 2009, 31(3): 496–500. DOI: 10.1016/j.optmat.2007.10.014. |
| [13] |
Al-Hasni B M, Mountjoy G. A complete study of amorphous iron phosphate structure[J].
Journal of Non-Crystalline Solids, 2013, 380: 141–152. DOI: 10.1016/j.jnoncrysol.2013.08.031. |
| [14] |
Ivascu C, Timar Gabo A. FT-IR, Raman and thermoluminescence investigation of P2O5-BaO-Li2O glass system[J].
Journal of Molecular Structure, 2011, 993(1): 249–253. |
| [15] |
Pascuta P, Borodi G. Influence of iron ions on the structural and magnetic properties of some zinc-phosphate glasses[J].
Materials Chemistry and Physics, 2010, 123(2): 767–771. |
| [16] |
Magdas D, Cozar O. The structural dual role of Fe2O3 in some lead-phosphate glasses[J].
Vibrational Spectroscopy, 2008, 48(2): 251–254. DOI: 10.1016/j.vibspec.2008.02.016. |
| [17] |
Ilieva D, Jivov B. Infrared and Raman spectra of Ga2O3-P2O5 glasses[J].
Journal of Non-Crystalline Solids, 2001, 283(1): 195–202. |
| [18] |
Anantha P, Hariharan K. Structure and ionic transport studies of sodium borophosphate glassy system[J].
Materials Chemistry and Physics, 2005, 89(2): 428–437. |
| [19] |
El-Egili K, Doweidar H. Structure and some physical properties of PbO-P2O5 glasses[J].
Physica B: Condensed Matter, 2003, 339(4): 237–245. DOI: 10.1016/j.physb.2003.07.005. |
| [20] |
Bingham P, Hand R. Vitrified metal finishing wastes: II. Thermal and structural characterisation[J].
Journal of hazardous materials, 2005, 122(1): 129–138. |
| [21] |
Gayathri Devi A, Rajendran V. Ultrasonic investigation on nanocrystalline barium borate (BBO) glass ceramics[J].
Synthesis and Reactivity in Inorganic and Metal-Organic and Nano-Metal Chemistry, 2006, 36(2): 215–219. DOI: 10.1080/15533170500524736. |
| [22] |
Qian B, Liang X. Structure and properties of calcium iron phosphate glasses[J].
Journal of Nuclear Materials, 2013, 443(1): 140–144. |
| [23] |
Shi M Q, Liang Y. Raman and FTIR spectra of modified iron phosphate glasses containing arsenic[J].
Journal of Molecular Structure, 2015, 1081: 389–394. DOI: 10.1016/j.molstruc.2014.10.061. |
| [24] |
Šantić A, Moguš-Milanković A. Structural properties of Cr2O3-Fe2O3-P2O5 glasses, Part I[J].
Journal of Non-Crystalline Solids, 2007, 353(11): 1070–1077. |
 2015, Vol. 6
2015, Vol. 6


