| 电位调控-硫化沉淀联合技术沉淀锌的实验研究 |
矿山酸性废水中含有铜、锌、镍和钴等重金属离子,根据《铜、镍、钴工业污染物排放标准》(GB25467-2010)中对金属离子排放标准的规定,其浓度远远超出了排放标准,危害较大.重金属离子对水体的危害主要在于会与其中的矿物质相互作用生成的某些盐类,产生危害;含重金属废水流入农田时,会对农作物产生毒害,还会出现土壤盐碱化[1].矿山酸性废水已成为重要的工业污染之一[2].由于矿山酸性废水中的成分复杂,因而对矿山酸性废水的处理方法也不尽相同[3].目前,矿山酸性废水治理的较常用的方法主要有中和法、生物法、硫化沉淀法、离子交换法、覆盖法、电解法、膜分离法和电渗析等[4],但是大都因为投资、处理量、成本等原因,难以推广应用[5].而硫化沉淀法产生硫化沉淀物含水率低、溶解度小、不易造成二次污染,而且硫化沉淀物中的有价金属品位高,可直接作为产品进行使用或者当作提炼金属的原料[6].所以硫化物沉淀法常作为一种较理想的含重金属废水的处理方法来分离或富集其中的有价金属[7-10].
采用电位调控-硫化沉淀联合技术沉淀分离锌.研究pH值、硫化剂的种类和氧化还原电位(ORP)对硫化沉锌的影响,确定其最佳工艺参数.
1 实验原料和方法 1.1 实验原料实验所用的模拟废水是根据某铜矿矿山酸性废水的水质配制的,pH值为2.5.模拟废水组成及含量见表 1.
| 表1 模拟废水组分及含量/(mg·L-1) |
 |
| 点击放大 |
本实验所用药剂:硫酸亚铁、硫酸铜、硫酸铁、硫酸锌、硫酸镍、硫酸钴、硫酸铝、硫酸、盐酸、聚丙烯酰胺、硫化钠和硫氢化钠.实验药品均为分析纯.
1.2 实验测定方法废水中Zn2+、Fe2+和Fe3+的浓度:采用DGS-Ⅲ型单道扫描光谱仪测定;废水pH值和ORP值:采用pHS-3C数显pH计分别接上E-201-C型pH复合电极和501氧化还原电位复合电极测定.
金属离子的去除率R:
| $ R = \frac{{C1 - C2}}{{C1}} \times 100{\rm{ }}\% $ | (1) |
式(1)中:C1和C2分别代表反应前后废水中的金属离子浓度,单位为mg/L.
2 实验机理分析 2.1 硫化锌沉淀机理硫化物沉淀法是指在废水中加入硫化剂,使废水中某些元素与S2-生成硫化沉淀物,从而分离回收的方法.大多数的金属离子和S2-都可以反应生成溶度积极小的难溶硫化物沉淀.矿山酸性废水中含有Cu2+、Zn2+、Ni2+和Co2+等重金属离子,与S2-均能生成硫化物.硫化物溶度积越小,越容易形成硫化物沉淀而析出,各种金属硫化物的溶度积不同,硫化物沉淀回收锌就是根据这个原理[11].其反应公式为:
| $ {\rm{MS}} \Leftrightarrow {{\rm{M}}^{2 + }} + {{\rm{S}}^{2 - }} $ | (2) |
| $ {K_{{\rm{sp}}\left( {{\rm{MS}}} \right)}} = \left[ {{{\rm{M}}^{2 + }}} \right]\left[ {{{\rm{S}}^{2 - }}} \right] $ | (3) |
式(2)、式(3)中:M表示金属离子;MS表示金属硫化物沉淀;Ksp (MS)表示金属沉淀溶解反应的溶度积.
几种难溶金属硫化物在25 ℃时的溶度积可近似计算出沉淀Zn2+、Ni2+、Co2+、Fe2+等离子所需的S2-浓度的沉淀平衡图,见图 1.
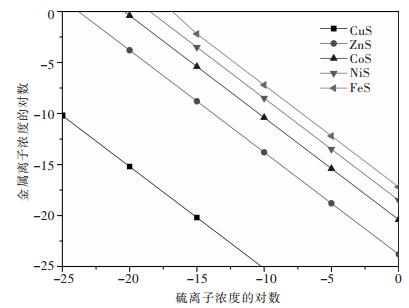 |
| 图 1 硫化沉淀溶解平衡图 |
由图 1可以看出,S2-浓度从低到高,Cu2+最先生成沉淀CuS,之后Zn2+会生成沉淀ZnS,而Zn2+刚生成沉淀,Fe2+、Ni2+、Co2+等都不会产生沉淀.将S2-控制在一定浓度,可以使Cu2+和Zn2+沉淀,而使Fe2+、Ni2+和Co2+等都不产生沉淀,由于矿山酸性废水中Cu2+含量很少,与之反应的S2-也很少,由此说明硫化沉淀回收锌是可行的.
2.2 氧化还原电位(ORP)原理氧化还原电位(ORP)可以反映水溶液中的氧化还原性.氧化还原电位越高,氧化性越强,电位越低,氧化性越弱.电位为正表示溶液具有出一定的氧化性,为负则说明溶液具有一定的还原性.氧化还原反应的本质是电子的转移.物质接收电子的能力越强,其氧化性就越强,该物质也称为强氧化剂,相反给出电子能力越强的物质就是强还原剂[12].
3 实验结果和分析 3.1 石灰中和除铁预处理试验在矿山酸性废水中含有大量的Fe3+,大量的Fe3+对硫化沉淀去除Zn2+的试验会产生影响,应排除Fe3+的干扰.本试验研究Fe3+的沉淀规律,确定Fe3+基本完全沉淀时所用石灰乳液用量及对应溶液pH值.
3.1.1 石灰用量试验取模拟废水200 mL 12份,将不同体积的10 %石灰乳液分别滴加到模拟废水中,在磁力搅拌器上搅拌10 min,然后加入0.2 mL的0.5 % PAM,静置5 min,观察溶液现象,测量废水上清液pH值,结果如表 2所示.
| 表2 石灰乳液用量与pH值的关系 |
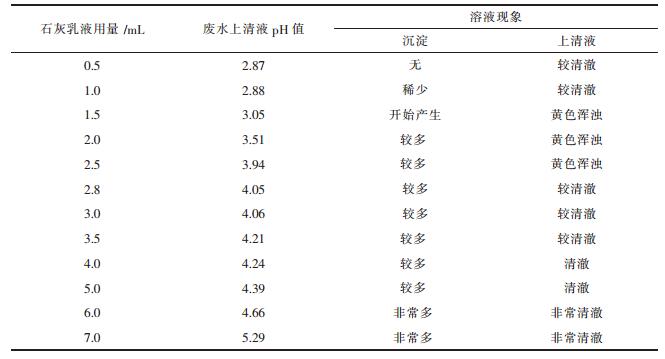 |
| 点击放大 |
由表 2可知,石灰乳液投加量与废水上清液pH值成正比关系.石灰乳液用量为1.5 mL时,沉淀开始产生,此时上清液pH值为3.05.石灰乳液用量为2 mL时,此时上清液pH值为3.51,溶液中出现较多沉淀,但上清液仍然呈现黄色浑浊,说明此时溶液中的Fe3+未沉淀完全.石灰乳液用量为2.8 mL时,经絮凝沉降后,上清液清澈,此时上清液pH值为4.05.从铁的氢氧化物的溶度积数值可知[13],此时溶液中Fe3+已经基本完全沉淀.所以石灰中和沉铁实验中10 %石灰乳液投加量应控制为7.5~14 mL/L,pH值控制在3.05~4.05之间.
3.1.2 沉铁时间试验为了更进一步研究石灰乳液对总铁离子(TFe)的去除效果,进行沉铁时间的试验.取200 mL模拟废水,在模拟废水中加入10 %石灰乳液2.8 mL,在磁力搅拌器上连续搅拌60 min.每隔5min取一次样,测TFe离子浓度,结果如图 2所示.
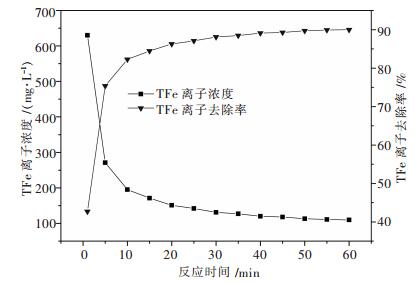 |
| 图 2 TFe离子浓度、去除率与时间的关系 |
由图 2可知,石灰乳液对TFe离子的去除效果非常明显,在反应30 min时,TFe离子去除率已超过85 %.30 min后,随着反应时间的增大,溶液中TFe离子逐渐减少,但减少趋势很平缓,趋于稳定,去除率维持在90%左右.TFe离子未能完全反应,这可能是因为废水中Fe2+较稳定所致.兼顾实验的高效性和节约实验成本,应将沉铁时间控制在30 min.
3.2 锌沉淀试验 3.2.1 pH值影响试验有资料表明,在pH=2时,Zn2+就会开始产生ZnS沉淀[14],取絮凝沉铁后的上清液200 mL 6份,将上清液pH值分别调节为3.0、3.2、3.4、3.6、3.8和4.0,加入1 % NaHS溶液1.7 mL(与Zn2+的当量比为1的硫化剂用量),用磁力搅拌器搅拌50 min后,静置5 min,过滤,测量滤液中Zn2+的浓度,计算其去除率,结果如图 3所示.
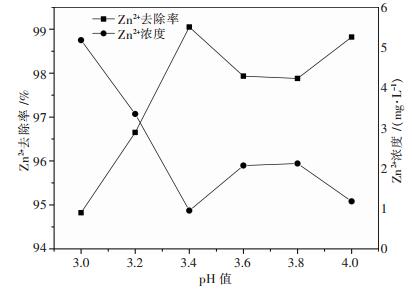 |
| 图 3 pH值对Zn2+去除率的影响 |
由图 3可知,pH值为3~4时,随着pH值逐渐增大,Zn2+的去除率先迅速增大,当pH值为3.4时,Zn2+的去除率达到最大值,去除率为99.05 %,随后Zn2+的去除率稍有降低,本试验硫化沉锌pH值确定为3.4.
3.2.2 硫化剂的种类试验目前,硫化沉锌常用的硫化剂有NaHS、Na2S和H2S等.H2S是有毒气体,容易对空气造成二次污染,而且作为硫化沉淀剂,操作条件苛刻[15].所以本实验选择NaHS和Na2S 2种硫化剂进行比较.
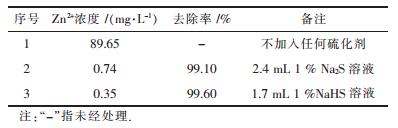
取沉铁后的上清液200 mL 3份,将pH值调节至3.4,1份不加硫化剂,作为对照,另2份分别加入与Zn2+的当量比为1的2种硫化剂,即分别加入2.4 mL 1%Na2S溶液和1.7 mL 1% NaHS溶液.用磁力搅拌器搅拌50 min后,静置5 min,过滤,测量滤液中Zn2+的浓度,计算其去除率,结果如表 3所示.
| 表3 Na2S、NaHS的去除效果比较 |
 |
| 点击放大 |
由表 3可以得出,在上清液中添加硫化剂后,上清液中的Zn2+基本沉淀,NaHS和Na2S的沉淀锌的效果差不多,Zn2+去除率均达到了99 %以上.但从两者的S2-浓度、还原性和使用性能等方面进行比较(表 4)后发现:从价格上比较,Na2S比NaHS价格昂贵;从贮存要求上比较,Na2S贮存更严格,存储不方便;从与Zn2+的当量比为1的硫化剂用量比较,1 %Na2S溶液用量大于1 %NaHS溶液用量.所以采用1 %的NaHS溶液作为本实验硫化沉锌的硫化剂.
| 表4 aHS和Na2S的比较 |
 |
| 点击放大 |
3.2.3 ORP与硫化沉锌反应的规律
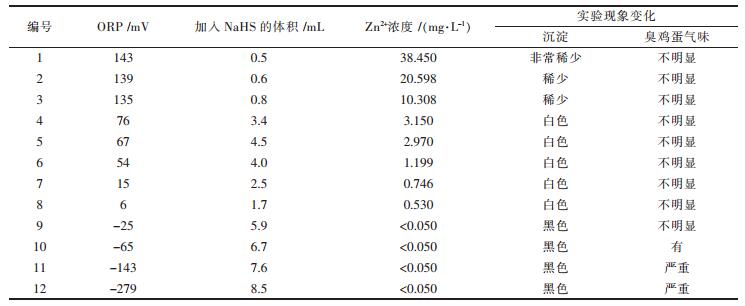
为了验证硫化沉锌反应与ORP之间的关系,考察在不同的ORP下,硫化沉锌后上清液中Zn2+浓度的变化.取絮凝沉铁后的上清液200 mL12份,分别加入不同体积的1 % NaHS,用磁力搅拌器搅拌50 min,读数稳定后,记录溶液中的ORP变化.静置5 min,过滤,测量滤液中Zn2+的浓度,即硫化沉锌后上清液Zn2+的浓度.结果如表 5所示.
| 表5 不同ORP下硫化沉锌后上清液Zn2+的浓度 |
 |
| 点击放大 |
从ORP值可以看出溶液的氧化还原性,当ORP为正时,说明溶液表现出一定的氧化性,表示溶液中的阳离子较多,即重金属离子较多;当ORP为负时,则说明溶液表现出还原性,表示溶液中的阴离子较多,即加入的HS-过量.由表 5可知,当ORP为负值时,溶液中残留的Zn2+浓度小于0.05 mg/L,其去除效果很好.当ORP为负值时,反应后产生较多的黑色沉淀物,说明此时溶液中的Ni2+、Co2+和Fe2+等也基本沉淀完全,不利于锌的回收.当ORP为6~76 mV时,反应后产生较多的白色沉淀物,说明溶液中大部分的Zn2+反应生成了沉淀物ZnS.Zn2+的去除率达到96.85 %以上,且溶液中剩余的Zn2+≤3.150,达到了Zn2+的排放标准:间接排放≤4 mg/L.综上可知,电位调控-硫化沉淀联合技术回收锌时,将ORP控制在6~76 mV时,可达到很好的硫化沉锌效果.
为了考察传统硫化沉淀和电位调控-硫化沉淀联合技术对锌去除的对比效果.对传统硫化沉淀回收锌进行研究.取沉铁后的上清液200 mL2份,投加与废水中Zn2+不同当量比的1 % NaHS溶液,用磁力搅拌器搅拌50 min,静置5 min,过滤,测量滤液中Zn2+的浓度,结果如图 4所示.
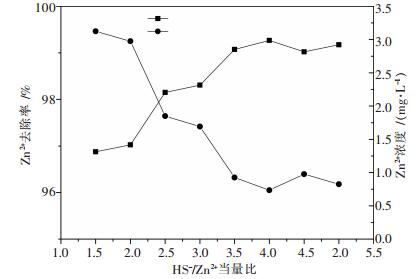 |
| 图 4 HS-/Zn2+当量比对Zn2+去除率的影响 |
由图 4可以看出,Zn2+浓度去除率与NaHS-/Zn2+当量比呈正比关系.当NaHS-/Zn2+的当量比为4.0时,去除率达到最大,去除率达99 %以上,效果最好,此时废水中Zn2+剩余浓度为0.734 mg/L.而与之对比的电位调控-硫化沉锌试验中,此时废水中Zn2+剩余浓度小于0.05.相比较于传统的硫化沉淀法,电位调控-硫化沉锌法具有药剂添加量少、添加用量易于控制和硫化沉淀物中金属易回收等优点.
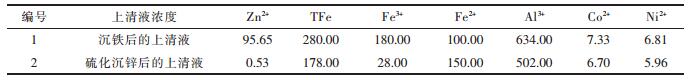
3.3 最佳条件下的实验取模拟废水1 L,缓慢加入10 %的石灰乳液,调节pH值至3.4,然后加入0.5 %的PAM 1 mL后,用磁力搅拌器搅拌30 min,静置5 min,测定沉铁后上清液中各金属离子浓度;另取絮凝沉铁后的上清液200 mL,加入1 %NaHS溶液,控制溶液的ORP为15 mV,此时1 %NaHS溶液加入量为2.5 mL,用磁力搅拌器搅拌50 min,静置5min,过滤,测定硫化沉锌后上清液中各金属离子的浓度,并将滤渣烘干称重,检测其中Zn等元素的含量.其结果如表 6所示.
| 表6 各金属离子的浓度/(mg·L-1) |
 |
| 点击放大 |
由表 6可知,经石灰中和除铁后的上清液中,Fe3+去除率为82 %,而Fe2+硫化沉锌后,比硫化沉锌的浓度更高,原因是S2-将Fe3+还原成了Fe2+.经中和沉铁后的上清液中的Zn2+浓度为95.65 %,与原液相比,Zn2+的损失率为4.35 %,说明石灰中和沉铁对Zn2+影响很小,进一步证明了将pH值控制在3~4的范围之内时,Fe3+比Zn2+优先与OH-反应.经电位调控-硫化沉淀处理后的上清液,其Zn2+浓度为0.53 mg/L,去除率为99.47 %,且沉渣中锌的含量达56.5 %,具有很高的回收价值.
4 结论本实验通过研究pH值、不同硫化剂及ORP对Zn2+去除效果的影响,进行了电位调控-硫化沉淀去除锌的规律研究.通过上述的实验可得:
1)针对废水中含Fe3+高的特点,对废水预处理,采用石灰中和沉铁实验来减少Fe3+对硫化锌沉淀实验的影响,当10%的石灰乳液滴加量为7.5~14 mL/L、沉铁反应时间控制在30 min左右、pH值控制在3.05~4.06时,总Fe离子的去除率可以达到80 %以上.
2)硫化沉锌的pH值的控制在3~4时,废水中Zn2+的去除率达到90 %以上.pH值为3.4时,废水中Zn2+的去除率为99.05 %.
3)兼顾实验去除效果和经济可行性对比分析可知,选择NaHS作为沉淀Zn2+的硫化剂.
4)使用硫化剂NaHS调节ORP,当ORP控制在6~76 mV时,矿山酸性废水中的Zn2+去除率达到96.85 %以上,处理后的废水中的Zn2+可以达标排放.
5)采用最佳条件下进行沉锌实验,反应后沉渣中锌的含量达56.5 %,具有很高的回收利用.
| [1] | 杨根祥, 沙日娜, 乌云高娃. 酸性矿山废水的污染与治理技术研究[J]. 西部探矿工程, 2000(6): 50–52. |
| [2] | 庄明龙. 硫化沉淀-石灰中和工艺处理矿山酸性废水[J]. 环工环保, 2011, 31(1): 53–56. |
| [3] | 张骞.羟肟酸树脂的合成及其对矿山酸性废水的吸附特性研究[D].长沙:中南大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10533-2010189679.htm |
| [4] | 陶有胜, 朱联锡, 张克仁. 沉淀浮选法处理矿山含重金属废水初探[J]. 四川环境, 1993, 12(2): 36–39. |
| [5] | 杨振全, 李晓丹, 高波. 矿山废水污染与防治[J]. 辽宁工程技术大学学报, 2001(4): 30–34. |
| [6] | 焦萍, 赵碧琳. 含锌废渣中锌的回收试验[J]. 甘肃冶金, 2011, 33(6): 49–52. |
| [7] |
Foucher S, Battaglia F, Ignatiadis I, et al. Treatment by sulfate-reducing bacteria of chessy acid mine drainage and metals recovery[J].
Chemical Engineering Science, 2001, 56: 1639–1645. DOI: 10.1016/S0009-2509(00)00392-4. |
| [8] |
Tony J, David L P. Removal of sulfate and heavy metals by sulfate reducing bacteria in short-term bench scale upflow anaerobic packed bed reactor runs[J].
Wat.Res, 2003(37): 3379–3389. |
| [9] | 唐庚年. 从废合金棒中回收钴镍的研究[J]. 湖南冶金职业技术学院报, 2004, 4(3): 195–196. |
| [10] | 张从良, 彭国胜, 王岩. 废金刚石刀具中铜钴镍的回收工艺研究[J]. 无机盐工业, 2006, 38(9): 54–60. |
| [11] | 庄明龙. 硫化沉淀-石灰中和工艺处理矿山酸性废水[J]. 环工环保, 2011, 31(1): 53–56. |
| [12] | 洪妍, 郭秋梅, 董铁有, 等. ORP的测量过及数显ORP标定的原理[J]. 河南科技大学学报, 2006, 27(1): 18–20. |
| [13] | 戴树佳. 环境化学[M]. 北京: 高等教育出版社 , 2006: 184-186. |
| [14] | 彭映林.酸性矿山废水中Zn2+, Fe2+, Mn2+的分离及处理新工艺研究[D].长沙:中南大学, 2010. |
| [15] | 杨群, 宁平, 陈芳媛, 等. 矿山酸性废水治理技术现状及进展[J]. 金属矿山, 2009(1): 132–134. |
 2014, Vol. 5
2014, Vol. 5

