| 铋钼混合矿低温熔炼新工艺研究 |
2. 湖南辰州矿业股份有限公司,湖南 沅陵县 419607;
3. 江西环境工程职业学院,江西 赣州 341002
2. Hunan Chenzhou Mining CorporationLimited, Ruanling 419607, China;
3. Jiangxi Environmental Engineering Vocational College, Ganzhou 341002, China
铋属于重要的战略金属,广泛用于电子、医药、化工等领域[1].我国是铋储量最大的国家,铋资源主要集中在郴州,郴州铋资源又主要集中在柿竹园.但是,柿竹园公司铋、钼资源属于多金属硫化矿,钼、铋主要以辉钼矿和辉铋矿形式存在,由于辉钼矿和辉铋矿可浮性相近,依靠现有浮选工艺,难于得到深度分离的硫化铋及硫化钼精矿.“八五”以来,以郴州柿竹园的全浮流程为代表,进行了一系列的选矿研究[2-3].但仍存在选矿流程长,需要消耗大量选矿药剂,且分离不彻底等问题.因此需要一种更简便、彻底的铋钼分离冶炼的工艺.
传统铋冶炼工艺主要分为湿法与火法2类.前者主要用于低品位复杂铋矿的处理,即以FeCl3、Cl2、HCl为浸出剂进行氧化浸出[4-5],含铋浸出液经净化除杂后采用铁粉置换、隔膜电积、水解沉淀等方法产出铋的各类产品[6].湿法炼铋的主要弊端在于流程冗长,工序繁杂,生产成本高、废水排放量大.铋的火法冶炼是将铋钼混合矿与还原剂粉煤、铁屑、熔剂(纯碱、萤石、黄铁矿)等配料混合后,加入放射炉或回转窑中,在1 200~1 300 ℃温度下进行熔炼,分别产出炉渣、铜锍与粗铋[7].该工艺普遍存在能耗大、消耗多、生产成本高、环境污染严重等缺点[8].低温碱性熔炼法最初由谢里科会母于1948年首先提出并用于铅精矿的熔炼,然后由斯米尔洛夫完成研究[9],具有直收率高,低温环保等优点[10-12].肖剑飞等曾提出了NaOH-Na2CO3体系碱性熔炼的方法冶炼铋[13-14],取得了很好的效果.
本文在前期研究基础上,进一步提出了直接低温熔炼处理铋钼矿工艺,铋钼矿直接低温熔炼得到粗铋,钼以钼酸盐的形式进入浸出液回收钼.该工艺有效解决了铋钼混合矿难于选矿分离,选矿废水量大,传统硫化铋钼混合矿冶炼能耗大,SO2污染严重等问题,降低了冶炼成本,并可通过“水热法”直接制得氧化钼,高效回收了精矿中的钼,对铋钼冶炼的技术进步具有重要意义.
1 实验 1.1 实验原料及试剂实验所用的铋钼混合矿来自湖南郴州柿竹园冶炼厂,其化学成分如表 1所示.实验所用辅助原料包括:碳酸钠(工业级),氯化钠(分析纯)以及活性炭(分析纯).
| 表1 原料的化学组成/wt% |
 |
| 点击放大 |
1.2 实验设备和方法
熔炼实验设备为1台10 kW的马弗炉,装原料容器为石墨坩埚(内径90 mm,高140 mm,容积为763 cm3)和刚玉坩埚(容积500 mL).铋钼混合矿低温碱性熔炼工艺包括熔炼和湿法处理两部分,目的是在800~900 ℃的温度条件下,用氯化钠、纯碱为溶剂进行熔炼,一步产出粗铋,Mo、纯碱在熔炼反应后生成可溶性钠盐进入水浸液,水浸液经浓缩结晶得到钼富集液、硫酸钠、硫化钠和纯碱,钼富集液进一步回收钼,纯碱重新返回配料使用.其原则工艺流程如图 1所示.
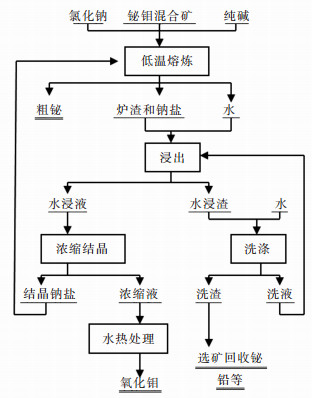 |
| 图 1 铋钼混合矿低温熔炼流程图 |
2 实验原理
铋钼混合矿的低温碱性熔炼实质是用碳酸钠和氯化钠为熔剂,提供反应介质,用煤粉作为还原剂,在800~900 ℃下,按照式(1)、式(2)发生还原固硫反应,一步还原熔炼制取粗铋.其中Na2CO3反应生成Na2S.熔炼中氯化钠不参与反应,但可以显著增加熔盐的流动性,有助于熔融状态下铋的富集和回收.混合矿中的钼则与Na2CO3反应后生成易溶于水的Na2MoO4,使得一次熔炼后便可达到冶炼粗铋又可回收钼的效果.主要反应如下:
| ${\text{2B}}{{\text{i}}_{\text{2}}}{{\text{S}}_{\text{3}}}{\text{ + 6N}}{{\text{a}}_{\text{2}}}{\text{C}}{{\text{O}}_{\text{3}}}{\text{ + 3C = 4Bi + 6N}}{{\text{a}}_{\text{2}}}{\text{S + 9C}}{{\text{O}}_{\text{2}}}\left( g \right)$ | (1) |
| ${\text{4B}}{{\text{i}}_{\text{2}}}{{\text{S}}_{\text{3}}}{\text{ + 12N}}{{\text{a}}_{\text{2}}}{\text{C}}{{\text{O}}_{\text{3}}}{\text{ = 8Bi + 9N}}{{\text{a}}_{\text{2}}}{\text{S + 3N}}{{\text{a}}_{\text{2}}}{\text{S}}{{\text{O}}_{\text{4}}}{\text{ + 12C}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right)$ | (2) |
| $2{\text{Mo}}{{\text{S}}_{\text{2}}}{\text{ + 6N}}{{\text{a}}_{\text{2}}}{\text{C}}{{\text{O}}_{\text{3}}}{\text{ + 9}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right){\text{ = 2N}}{{\text{a}}_{\text{2}}}{\text{Mo}}{{\text{O}}_{\text{4}}}{\text{ + 4N}}{{\text{a}}_{\text{2}}}{\text{S}}{{\text{O}}_{\text{4}}}{\text{ + 6C}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right)$ | (3) |
同时,精矿中的铁、铅、铜等硫化物也会参与反应,可能发生的反应如下:
| ${\text{2PbS + 2N}}{{\text{a}}_{\text{2}}}{\text{C}}{{\text{O}}_{\text{3}}}{\text{ + C = 2Pb + 2N}}{{\text{a}}_{\text{2}}}{\text{S + 3C}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right)$ | (4) |
| ${\text{2Fe}}{{\text{S}}_{\text{2}}}{\text{ + 2N}}{{\text{a}}_{\text{2}}}{\text{C}}{{\text{O}}_{\text{3}}}{\text{ + C = 2FeS + 2N}}{{\text{a}}_{\text{2}}}{\text{S + 3C}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right)$ | (5) |
| ${\text{Fe}}{{\text{S}}_{\text{2}}}{\text{ + 2N}}{{\text{a}}_{\text{2}}}{\text{C}}{{\text{O}}_{\text{3}}}{\text{ + C = Fe + 2N}}{{\text{a}}_{\text{2}}}{\text{S + 3C}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right)$ | (6) |
| ${\text{2Fe}}{{\text{S}}_{\text{2}}}{\text{ + 2N}}{{\text{a}}_{\text{2}}}{\text{C}}{{\text{O}}_{\text{3}}}{\text{ + C = 2Fe + 2N}}{{\text{a}}_{\text{2}}}{\text{S + 3C}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right)$ | (7) |
| ${\text{C}}{{\text{u}}_{\text{2}}}{\text{S + N}}{{\text{a}}_{\text{2}}}{\text{C}}{{\text{O}}_{\text{3}}}{\text{ + C = 2Cu + N}}{{\text{a}}_{\text{2}}}{\text{S + C}}{{\text{O}}_{\text{2}}}\left( {\text{g}} \right)$ | (8) |
| $\Delta G_T^\theta = \Delta {H^\theta } - T\Delta {S^\theta }$ | (9) |
△HTθ和△STθ的值可分别由式(10)、式(11)计算:
| $\Delta H_T^\theta = \Delta H_{298}^\theta + \int_{298}^T {\left[ {\Sigma {C_{P,产物}} - \Sigma {C_{P,反应物}}} \right]} {\text{d}}T$ | (10) |
| $\Delta S_T^\theta = \Delta S_{298}^\theta + \int_{298}^T {\frac{{\Delta {C_P}}}{T}} {\text{d}}T$ | (11) |
将式(9)和式(10)代入式(11)即得:
| $\Delta G_T^\theta = \left[ {\Delta H_{298}^\theta + \int_{298}^T {\Delta {C_P}{\text{d}}T} } \right] - T\left[ {\Delta S_{298}^\theta + \int_{298}^T {\frac{{\Delta {C_P}}}{T}} {\text{d}}T} \right]$ | (12) |
如果参加反应的各反应物与生成物的△HTθ、△STθ和△CP已知,则可依据式(12)计算出任何温度下的△GTθ.但是,在298~T(K)的温度区间内,反应物和产物如果发生了任何相变(如熔化、同素异型变化等),则必须在计算式中引入相应的相变修正项.
当反应达到平衡时,反应物与产物彼此间处于平衡状态,则吉布斯自由能变化值为零,故反应的热力学平衡常数由下式计算:
| $\Delta G_T^\theta = RT\ln K$ | (13) |
根据文献[17]提供的热力学数据,通过式(12)可以计算出上述反应在700~1 500 K温度下的标准吉布斯自由能△GTθ,并由△GTθ按式(13)计算出相关放映的平衡常数,由△GTθ值可绘制相关反应的△GTθ-T图,见图 2,由图 2中曲线和对应平衡常数,可知反应的难易程度.
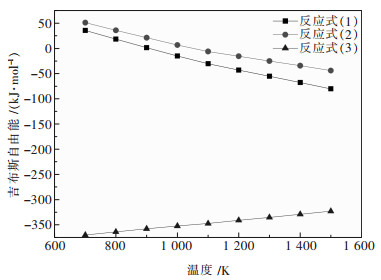 |
| 图 2 铋钼矿中Bi2S3参与反应的GTθ-T图 |
从图 2中可以看出,当温度高于900 K时,反应式(2)的吉布斯自由能变化值为负值,即在有还原剂存在的条件下,硫化铋可以被Na2CO3还原,得到粗铋.而当温度高于1 100 K时,反应式(1)的吉布斯自由能变化值才为负值,即没有还原剂存在的条件下,硫化铋很难被Na2CO3还原.这也从理论上证明了添加还原剂的必要性.反应式(3)在整个温度区间内,吉布斯自由能变化值均很负,反应进行很彻底,反应生成Na2MoO4和Na2SO4;硫化钼全部转化为可溶性的钼酸钠,通过水浸与固体渣分离,进一步回收利用.
由图 3可知,当温度高于1 100 K时,反应式(4)的吉布斯自由能变化值为负值,反应可以进行,但因为平衡常数较小,且精矿中Pb含量很低,反应进程不大,因此Pb很难被还原,仍主要以PbS存在渣中.当温度低于1 300 K时,反应式(7)式(8)的吉布斯自由能变化值均为正,反应不能发生,因此,Cu仍然以Cu2S的形态存在于渣中.当温度高于900 K时,反应式(5)、式(6)的吉布斯自由能变化值均为负值,但是反应式(6)的平衡常数不大,远远低于反应式(5),所以Fe2S会与Na2CO3和C发生还原反应,生成FeS,进入渣相.
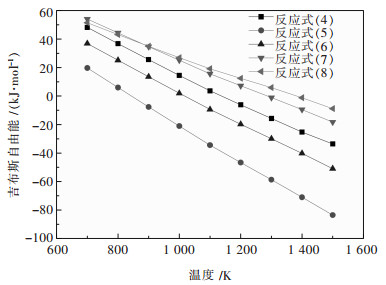 |
| 图 3 铋钼矿中杂质组分反应的GTθ-T图 |
3 结果及讨论 3.1 熔盐组成的影响
取铋钼混合矿100 g,3倍理论量活性炭和3倍固体质量的碱,在850 ℃下熔炼2 h,改变氯化钠的加入量,实验结果如图 4所示.
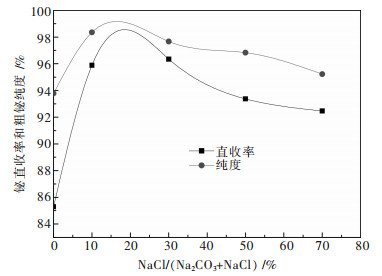 |
| 图 4 熔盐组成对熔炼过程影响 |
从图 4可以看出,随着氯化钠加入量的增加,铋直收率和粗铋品位先增加,后基本保持不变.不加氯化钠时铋直收率只有85.29 %,随着氯化钠的增加铋的直收率在氯化钠质量分数为20 %时,达到最高.这是因为,NaCl的加入降低了熔体的熔点,并且显著地提高了熔体的流动性,有利于铋的富集和沉降.但随着氯化钠量的继续增多,铋直收率并没有继续增加,因为NaCl并不参与铋的还原反应,不能为反应提供动力,仅仅是从熔体的物理性质方面提高铋的收率.因此最终确定氯化钠质量分数在20 %左右时为最优条件.
3.2 熔炼温度的影响按上述配比配制物料,将总碱中NaCl的质量百分含量定为20 %,改变熔炼温度,实验结果如图 5所示.
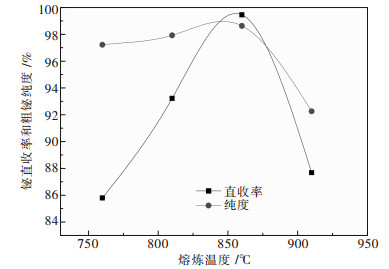 |
| 图 5 熔炼温度对熔炼过程影响 |
从图 5可以看出,熔炼温度对铋的直收率和品位均有很大的影响,随着温度的升高,铋直收率和粗铋品位均呈先上升后下降的趋势.当温度低于700 ℃时,由于低于熔盐的熔点,不能得到粗铋,随着温度的升高熔盐的黏度和流动性都显著改善,有利于铋的沉降和反应的快速进行,在860 ℃时直收率达到最高99.45 %,但温度过高,使得Bi的挥发增加,随后铋的收率下降.综合考虑,选取860 ℃为最优反应温度.
3.3 总碱量的影响取80 g铋钼混合矿,熔炼温度870 ℃,仍按照上述配比配制物料,改变加入的总碱量,实验结果如图 6所示.
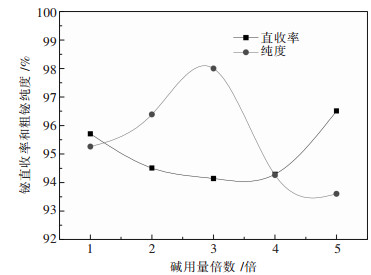 |
| 图 6 总碱量对熔炼过程的影响 |
从图 6可以看出,随着总碱量的增加,铋直收率在94 %~96.5 %范围内波动,粗铋品位先上升后下降,在3倍液固比时达到最高98 %.当总碱量为理论量的1倍时,熔体黏度过大,流动性差.当总碱量为理论量2~4倍时,总碱量对铋的直收率并没有显著影响,总碱量为理论量5倍时铋直收率最高,达到96.5 %,但是粗铋品位也最低.从成本考虑应在保证铋收率和粗铋品位的前提下,尽量减少碱用量.因此综合考虑,取总碱量为理论量的2倍为最优条件.
3.4 熔炼时间的影响取100 g铋钼混合矿,熔炼温度870 ℃,NaCl在总碱中质量百分比30 %,总碱量为理论量2倍,改变熔炼时间,实验结果如图 7所示.
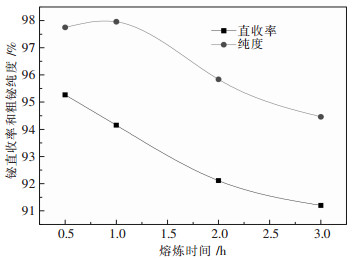 |
| 图 7 熔炼时间对熔炼过程的影响 |
从图 7可以看出,随着熔炼时间的增加,粗铋品位和直收率均呈下降趋势.这是由于熔炼时间的增加,加大了金属铋的挥发量,降低直收率;同时随着时间增加,其余各种杂质如Pb、Cu等元素也开始还原进入金属相,降低粗铋品位.而且,当熔炼时间超过3 h后,由于熔体的大量挥发,溶液黏度急剧增加,十分不利于熔体倾倒和粗铋的沉降.综合考虑,选择0.5 h为最优熔炼时间.
3.5 还原剂用量的影响取100 g铋钼混合矿,熔炼温度870 ℃,NaCl在总碱中质量百分比20 %,总碱量为理论量2倍,熔炼时间1 h,改变还原剂用量,在刚玉坩埚中进行熔炼,实验结果如图 8所示.
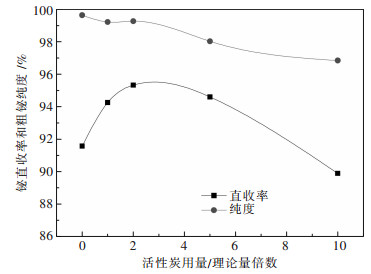 |
| 图 8 活性炭用量对熔炼过程的影响 |
从图 8可以看出,随着还原剂用量的增加,直收率先上升后下降,在2倍理论量时收率达到最高95.33 %.粗铋品位随着还原剂用量的增加呈下降趋势.在没有还原剂存在的条件下,不利于铋的还原,因此铋的收率较低,但是当还原剂超过一定量时,熔体中还原气氛过强,导致Pb等杂质进入金属相,降低粗铋品位和收率.因此,最终选择2倍理论量还原剂为最优条件.
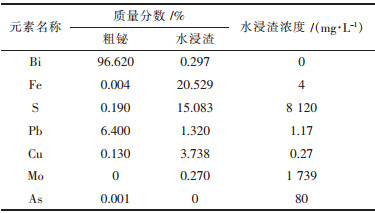
3.6 最优条件综合试验根据前面条件实验结果,称取铋钼混合矿200 g,在850 ℃下,氯化钠质量分数20 %,2倍理论量的总碱量,时间0.5 h条件下,进行了2次最优条件综合试验,结果见表 2和表 3.
| 表2 综合试验-1熔炼产物的组分分析 |
 |
| 点击放大 |
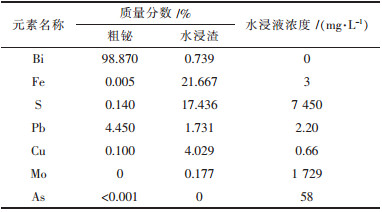
| 表3 综合试验-2熔炼产物的组分分析 |
 |
| 点击放大 |
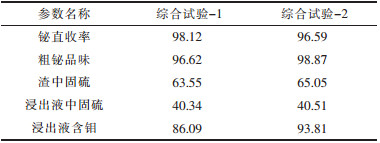
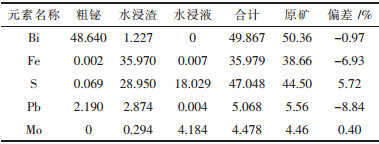
从表 4~表 6中可以得知:2次最优条件综合试验金属铋的直收率分别为98.12 %和96.59 %,纯度分别为96.62 %和98.87 %,反应进行彻底,渣中固硫率分别为63.55 %和65.05 %,浸出液中含硫量分别为40.34 %和40.51 %,硫全部被固定在水浸渣和水浸液中,达到了固硫的目的,钼转化为钼酸盐,水浸液中的钼收率分别为86.09 %和93.81 %,绝大部分的钼被回收,浸出液经浓缩后,在180 ℃,2 MPa条件下,加热20 h,可得到纳米级氧化钼.
| 表4 综合试验主要参数/% |
 |
| 点击放大 |
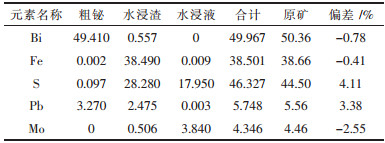
| 表5 综合试验-1中各元素平衡/g |
 |
| 点击放大 |
| 表6 综合试验-2中各元素平衡/g |
 |
| 点击放大 |
4 结论
1)通过热力学计算结果表明,当温度高于1 100 K时,在有还原剂的存在下,Na2CO3可以与硫化铋钼混合矿反应得到粗铋.条件试验说明,适当添加一定比例NaCl有助于提高铋的直收率和纯度.
2)条件试验确定了最佳熔炼条件为:w(NaCl)/w(NaCl+Na2CO3)=20 %,熔炼温度850 ℃,w(NaCl+Na2CO3)/w(混合矿)=2,熔炼时间1 h,w(活性炭)/w(理论量)=2.在此最优化条件下,2次最优条件试验,金属铋的直收率分别为98.12 %和96.59 %,纯度分别为96.62 %和98.87 %,证明硫化铋钼混合矿低温碱性熔炼是可行的.
3)综合试验表明,钼90 %以上进入到溶液中,得以回收.浸出液经浓缩后,用水热法处理可得到纳米级氧化钼,达到了钼分离回收的目的.
| [1] | 汪立果. 铋冶金[M]. 北京: 冶金工业出版社 , 1986: 15-31. |
| [2] | 孙传尧, 程新朝, 李长根. 钨铋相萤石复杂多金属矿综合选矿新技术--柿竹园法[J]. 中国钨业, 2004, 19(5): 8–12. |
| [3] | 周高云, 李晓东, 李绍民, 等. 用新药剂提高柿竹园矿钼铋选矿指标的研究[J]. 有色金属(选矿部分), 2006(5): 43–45. |
| [4] | 唐谟堂, 鲁君乐. 由柿竹园高硅含铍含氟铋钼混合矿直接制取铋品[J]. 中南工业大学学报, 1995, 26(2): 186–191. |
| [5] |
Kim D, Wang S J. Bismuth recovery from hydrochloric acidsolution[J].
Canadian Metallurgical Quarterly, 2008, 47(3): 317–326. DOI: 10.1179/cmq.2008.47.3.317. |
| [6] |
Zheng G Q, Tang M T. Physico-chemistry in distillation processof BiCl3-HC-lH2O system[J].
Trans Nonferrous Met Soc China, 2002, 12(5): 987–991. |
| [7] |
Asahina S, Hosokura K, Hayashi T. Bismuthrecovety from copper smelting dust[J].
Tetsu-To-Hagane/Journal of the Iron and Steel Institute of Japan, 1976(2): 856–874. |
| [8] | 唐朝波, 唐谟堂, 姚维义, 等. 脆硫铅锑精矿短回转窑还原造锍熔炼半工业试验[J]. 矿冶工程, 2004, 4(1): 51–53. |
| [9] |
Margulis E V. Low temperature smelting of lead metallicscrap[J].
Erzmetall, 2000, 53(2): 85–89. |
| [10] | 刘静欣, 田庆华, 程利振, 等. 低温碱性熔炼在有色冶金中的应用[J]. 金属材料与冶金工程, 2012, 39(6): 26–30. |
| [11] | 叶龙刚, 唐朝波, 唐谟堂, 等. 硫化锑精矿低温熔炼新工艺[J]. 中南大学学报(自然科学版), 2012, 43(9): 3338–3343. |
| [12] | 黄潮, 叶龙刚, 唐朝波, 等. 脉石在硫化锑精矿低温熔炼过程中的行为[J]. 中南大学学报(自然科学版), 2012, 43(11): 4178–4182. |
| [13] | 肖剑飞, 唐朝波, 唐谟堂, 等. 硫化铋钼混合矿低温碱性熔炼新工艺研究[J]. 矿业工程, 2009, 29(5): 82–85. |
| [14] | 刘小文, 杨建广, 李静, 等. Bi2S3ZnONa2CO3体系热力学分析及应用[J]. 中国有色金属学报, 2012, 22(1): 310–314. |
| [15] | 傅从说. 有色冶金原理[M]. 北京: 冶金工业出版社 , 1993: 160-163. |
| [16] | 叶大伦. 冶金热力学[M]. 长沙: 中南工业大学出版社 , 1987: 251. |
| [17] | 叶大伦. 实用无机物热力学数据手册[M]. 北京: 冶金工业出版社 , 1981. |
 2014, Vol. 5
2014, Vol. 5


