| 碱性体系下萃取钒的研究 |
1b. 江西理工大学冶金与化学工程学院,江西 赣州 341000;
2. 国家钨与稀土产品质量监督检验中心,江西 赣州 341000
1b. School of metallurgical and chemical engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China;
2. The state of tungsten and rare earth products quality supervision and Inspection Center, Ganzhou 341000, China
钒是一种非常重要的稀有金属,被广泛应用于冶金[[1]]、化工[[2]]、电子[[3]]等领域中,因此其价格出现逐年攀升趋势.钒在自然界的分布相当分散[[4]],一般都不会形成单独的矿床,而主要是以伴生矿的形式存在[[5]],因而钒主要是在各种冶金过程中作为副产品进行回收.从氧化铝生产和石煤中提钒便是生产钒的一种重要途径.
氧化铝生产用的铝土矿中通常都有一定量的含钒矿物,这些矿物在高压溶出过程中大约有30 %左右进入铝酸钠溶液中[[6]],它可以在生产流程中循环积累达到一定的浓度.铝酸钠溶液中的钒对分解过程具有不利的影响[[7]],它可使产品氢氧化铝颗粒变细并进入晶格中,以至于在焙烧氢氧化铝时造成氧化铝的强烈细化,这对生产砂状氧化铝是非常不利的.因此,从氧化铝生产过程中回收钒,不但可以降低钒对氧化铝产品的不利影响,还可以创造更多的经济价值,因此是非常必要的.近年来,石煤提钒已成为石煤资源综合利用的重要方面,其中氧化焙烧——碱浸工艺越来越受青睐[[8]].现有的文献中,在碱性介质中萃取钒的研究都是用N263作为萃取剂,而且都是在pH<10的条件下进行[[9],[10],[11]],有很高的萃取率.如能在更强的碱性条件下有效地萃取钒,对于碱性条件下提取钒有重要的参考价值,因此有必要对此进行深入研究.
在水溶液中,钒在不同pH值和不同浓度条件下存在的状态不同,Clark等总结过这方面的资料[[12]].在一定浓度下,随着溶液由酸性至碱性的转变,钒在溶液中的存在形式依次为VO2+、V2O5(沉淀)、H2V10O284-、HV10O285-、V10O286-、V3O93-、VO3(OH)2-、VO43-.钒只有在较强酸性条件下,以VO2+或V2O5沉淀形式存在,在弱酸性和碱性条件下,都是以阴离子形式存在.能用来萃取阴离子的萃取剂主要是季铵盐和胺类萃取剂.季铵盐可以直接与被萃取物发生阴离子交换反应,如柯兆华等用季铵盐在碱性条件下萃取钨[[13]],刘波等用N263萃取钒[10],盖会法等用N263萃取铼[14],杨项军等用CTAB萃取金[15]等.胺类则需要在酸性条件或者经过酸化后才能萃取阴离子,如伯胺N1923萃取钼[[16]]、萃取钨[ [17]]、萃取金[[18]],N503[[19]]萃取金等.在筛选萃取剂过程中,笔者用酸化(酸过量)的胺类萃取剂和季铵盐萃取剂做对比试验,不管是用硫酸酸化或是用盐酸酸化,萃余液都呈酸性,与本文的初衷有出入,所以选用季铵盐做为萃取剂,本研究用MTOAC做为萃取剂.
1 实验部分 1.1 实验方法有机相采用分析纯MTOAC与工业纯的仲辛醇和磺化煤油按照一定质量比配制,水相采用分析纯的偏钒酸铵配制成含五氧化二钒浓度为2g/L的溶液,用分析纯的氢氧化钠调节pH,在环境温度30℃左右,按一定相比(有机相与水相的体积比,下同)混合于梨形分液漏斗中,于康氏振荡器上震荡一定时间,静置10min后,分液分析.
1.2 分析及数据处理水相中的钒,采用硫酸亚铁铵容量法滴定,实验中萃取率和反萃率分别按以下公式计算:
萃取率
反萃率
有机相按照萃取剂+0.3倍萃取剂的仲辛醇+磺化煤油的质量比配制.萃取剂质量分数为5 %,10 %,15 %,20 %,25 %,分别与水相pH值为9.67、11.14和11.7按相比为1混合震荡反应10 min.考察萃取剂不同浓度对萃取的影响,结果见图 1.
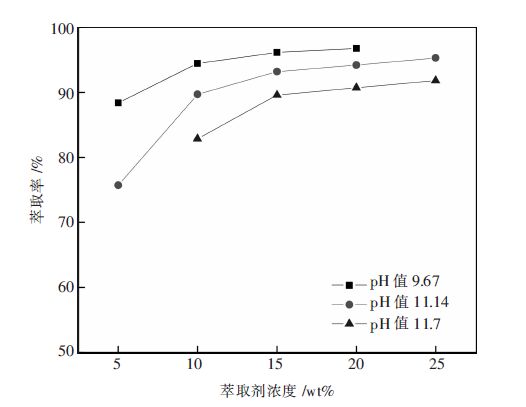 |
| 图 1 萃取剂浓度对萃取钒的影响 |
由图 1可知,在一定pH值条件下,随着萃取剂浓度的升高,萃取率也随之升高;在同一萃取剂浓度条件下,随着pH值的升高,萃取率降低.在pH值为9.67时,萃取剂的浓度从5 %升高到10 %时,萃取率升高得比较快,从88 %升高到94 %,再增加萃取剂浓度,萃取率升高则不明显,出现缓坡.pH值为11.14和11.7时,萃取剂浓度从5 %升高到10 %再到15 %,萃取率明显升高,再升高萃取剂浓度,萃取率升高趋势变缓.当萃取剂浓度的升高,萃取率的升高趋势变缓以后,继续升高萃取剂浓度,萃取剂的未饱和度也越大,不利于萃取剂的有效使用.选择萃取剂的质量浓度为15 %,同时考察仲辛醇的添加量对混合相分相的影响.
2.1.2 仲辛醇的作用在胺类萃取剂的萃取过程中通常会添加醇类防止出现第三相[[20]],本实验添加了仲辛醇.另外在配制有机相的过程中,由于MTOAC吸水性很强,当它直接与磺化煤油混合,搅拌后会出现浑浊,静置10 min左右后,明显分成两层.此时稍添加仲辛醇,分层的两相又很快溶于一相,而且清澈透明.分别取仲辛醇的质量分数为2.0 %、3.5 %、4.5 %、6 %和10 %配制有机相,按相比为1,分别在pH值为11.14和11.7的条件下震荡反应10min,考察不同仲辛醇浓度条件下萃取钒的影响,结果见表 1.
| 表1 不同仲辛醇浓度分别在两种pH值条件下萃取钒的结果 |
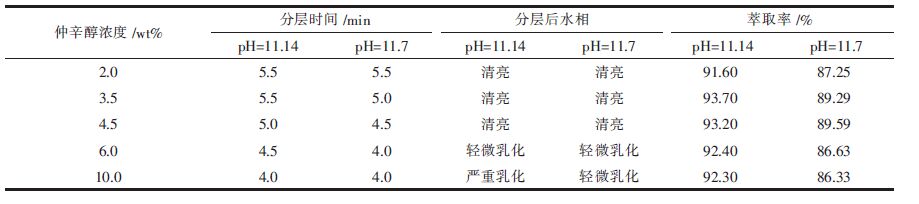 |
| 点击放大 |
由表 1可知,随着仲辛醇的浓度增加,混合液更容易分层;分层后水相的乳化程度也有所增加.仲辛醇的添加量为4.5 %及以下时,混合液分层后水相清亮透明;添加量为6 %时有轻微乳化,静置4 h,乳化消失;添加量为10 %则严重乳化,需要静置十多个小时才能变成澄清.添加量为3.5 %到4.5 %时,萃取率最高,添加量为2 %或者添加量高如6 %和10 %时,萃取率都有所下降.因为添加量为2 %时,添加量太少,影响萃取剂的活性,使得萃取率降低;添加量增加,水相容易乳化,影响萃取效果.由此可见,有机相中仲辛醇的含量为3.5 %或4.5 %较为合适,本文选择仲辛醇的添加量为3.5 %.
通过单因素实验,分别考察萃取剂和仲辛醇的浓度,得到有机相的最佳配比为15 %MTOAC+3.5 %仲辛醇+81.5 %磺化煤油.通过图 1和表 1,在相同条件下,pH值越高,得到的萃取率则越低.
2.2 水相pH值对萃取的影响有机相为最佳配比与不同pH值的水相按相比为1:1震荡反应10 min.考察水相pH对钒萃取率的影响,结果见图 2.
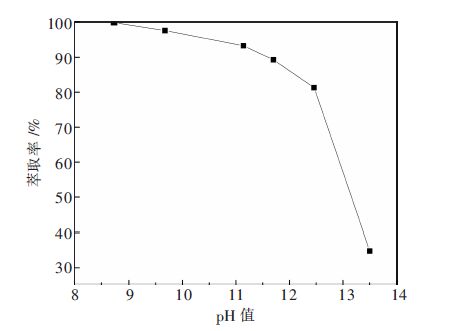 |
| 图 2 水相pH对萃取钒的影响 |
由图 2可知,水相pH对萃取的影响很明显.随着pH值的升高,萃取率逐渐降低.根据Clark等总结的资料[9],在溶液中V2O5的浓度为2 g/L时,随着碱性的增强,钒的主要存在形态从V3O93-到VO3(OH)2-再到VO43-.发生的只要反应为:
| $\eqalign{ & 3{\left( {{R_1}} \right)_3}N{R_2}CI + {V_3}O_9^{3 - } \to \cr & {\left[ {{{\left( {{R_1}} \right)}_3}N{R_2}} \right]_3}{V_3}{O_9} + 3C{I^ - } \cr & 2{\left( {{R_1}} \right)_3}N{R_2}CI + V{O_3}{\left( {OH} \right)^{2 - }} \to \cr} $ | (1) |
| ${\left[ {{{\left( {{R_1}} \right)}_3}N{R_2}} \right]_2}V{O_3}\left( {OH} \right) + 2C{I^ - }$ | (2) |
| $3{\left( {{R_1}} \right)_3}N{R_2}CI + V{O_4}^{3 - } \to {\left[ {{{\left( {{R_1}} \right)}_3}N{R_2}} \right]_3}V{O_4} + 3C{I^ - }$ | (3) |
其中R1为C8H17,R2为CH3,下同.
pH值为9左右,萃取反应主要按式(1)进行;pH值为9.5到12.5时,萃取反应主要按式(2)进行;pH值为13以上,萃取反应主要按式(3)进行.离子中的钒原子数n与离子价态z的比值从1:1到1:2再到1:3,逐渐变小,理论被萃取量也逐渐变小[11,21],在相同条件下越难被萃取. 所以随着碱性的增强,萃取率呈明显下降趋势.本文主要考察在一定碱性条件下萃取钒,并有较高(90 %)的萃取率,所以在后续的实验中,水相pH值定为11.5左右,主要被萃阴离子为VO3(OH)2-.
2.3 震荡时间对萃取的影响在有机相配比不变,水相pH值为11.46,R为1的条件下,分别震荡1,3,5,10,15 min进行试验.考察不同震荡时间对萃取钒的影响,结果见图 3.
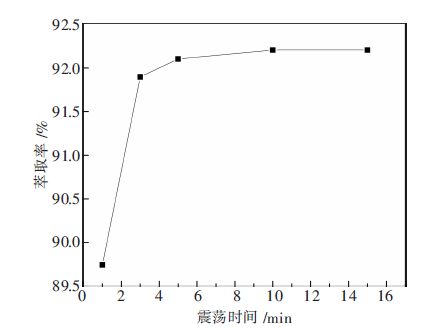 |
| 图 3 震荡时间对萃取钒的影响 |
由图 3可知,震荡反应1 min时,就有89.7 %的萃取率,但是反应尚未平衡;继续震荡至3 min,萃取率明显上升,达到91. 9 %,反应则基本达到平衡;震荡反应时间升至5 min,萃取率稍有升高,达到至92.1 %,;震荡反应时间为10 min和15 min,萃取率较震荡5 min的几乎不变.故取震荡时间5 min为宜.
2.4 相比对萃取的影响在有机相配比不变,水相pH值为11.46,按照不同相比,震荡反应5 min考察相比对萃取的影响,结果见图 4.
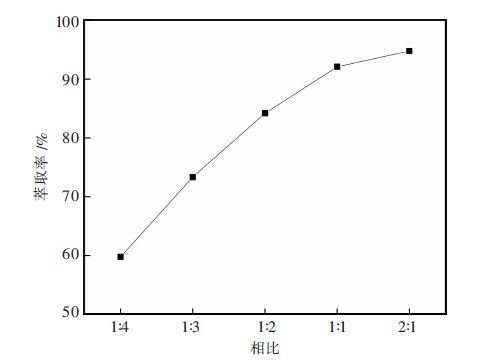 |
| 图 4 相比对钒萃取的影响 |
由图 4可知,钒的萃取率随着相比的不断增大而增大.在萃取过程中,当相比小于1,如1:4、1:3和1:2时,能够在一定程度上富集水溶液中的钒,但是有机相和水相混合震荡后容易发生乳化,需要静置几个甚至十几个小时,水相才能澄清,不利于萃取的连续性;当相比为1:1和2:1时,分层后水相很清亮.相比为2:1或更高时,不利于溶液中钒的富集.综合考虑,为了获得较高浓度的富钒有机相,又要获得高的钒萃取率这两个因素,选择相比为1较适宜,钒的一级萃取率达到了92.1 %.
2.5 反萃根据上面的分析萃取反应为阴离子交换反应,而且强碱性条件下萃取率更低,尝试用不同的钠盐在强碱性条件下进行反萃实验.在环境温度下对负载有机相进行反萃,在0.5 mol/L NaOH的碱性条件下分别用NaCl、NaNO3、Na2SO4和Na2CO3作为反萃剂按相比为1:1进行反萃试验.可能发生反应的化学方程式为:
| $\eqalign{ & {\left[ {{{\left( {{R_1}} \right)}_3}N{R_2}} \right]_2}V{O_3}\left( {OH} \right) + 2C{I^ - } \to \cr & 2{\left( {{R_1}} \right)_3}N{R_2}CI + V{O_3}{\left( {OH} \right)^{2 - }} \cr} $ | (4) |
| $\eqalign{ & {\left[ {{{\left( {{R_1}} \right)}_3}N{R_2}} \right]_2}V{O_3}\left( {OH} \right) + 2N{O_3}^ - \to \cr & 2{\left( {{R_1}} \right)_3}N{R_2}N{O_3} + V{O_3}{\left( {OH} \right)^{2 - }} \cr} $ | (5) |
| $\eqalign{ & {\left[ {{{\left( {{R_1}} \right)}_3}N{R_2}} \right]_2}V{O_3}\left( {OH} \right) + S{O_4}^{2 - } \to \cr & {\left[ {{{\left( {{R_1}} \right)}_3}N{R_2}} \right]_2}S{O_4} + V{O_3}{\left( {OH} \right)^{2 - }} \cr} $ | (6) |
| $\eqalign{ & {\left[ {{{\left( {{R_1}} \right)}_3}N{R_2}} \right]_2}V{O_3}\left( {OH} \right) + C{O_3}^{2 - } \to \cr & {\left[ {{{\left( {{R_1}} \right)}_3}N{R_2}} \right]_2}C{O_4} + V{O_3}{\left( {OH} \right)^{2 - }} \cr} $ | (7) |
VO3(OH)2-被反萃下来后跟溶液中的OH-结合,发生如下反应:
| $V{O_3}{\left( {OH} \right)^{2 - }} + O{H^ - } \to V{O_4}^{3 - } + {H_2}O$ | (8) |
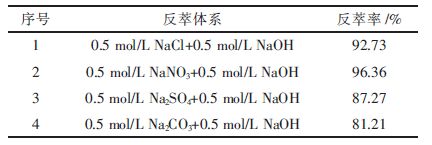
不同反萃剂对负载有机相反萃的效果如下表 2.
| 表2 不同反萃体系对负载有机相的反萃结果 |
 |
| 点击放大 |
由表 2可知,负载有机相可用含NaCl或NaNO3的反萃体系进行反萃,反萃率都在90 %以上,特别是用NaNO3时,其反萃率达到96.36 %,应选为反萃剂.但是实验中发现用NaNO3反萃后,有机相分成清晰的两层,不能再生,会造成有机相的浪费.故实验中选用NaCl作为反萃剂.
经过实验筛选,反萃体系为0.5 mol/L NaCl+1.0 mol/L NaOH,反萃效果最佳.与负载有机相混合震荡10 min,静置10 min后分液,单级反萃率可得到97.72 %.
3 结论(1)以质量分数为15 %三辛基甲基氯化铵+3.5 %仲辛醇+81.5 %磺化煤油为萃取体系的有机相,与水相中pH为11.46,V2O5的浓度为2 g/L的水溶液,按照相比为1:1反应,单级萃取率能达到92 %以上.
(2)负载有机相用0.5 mol/L NaCl+1.0 mol/L NaOH混合溶液反萃,可得到97.72 %的单级反萃率.
| [1] | 邓杰博. 钒在冶金中的应用及研究进展[J]. 铁合金, 2011(2): 45–48. |
| [2] | 杨绍利, 彭富昌, 潘复生, 等. 钒系催化剂的研究与应用[J]. 材料导报, 2008(4): 53–56. |
| [3] | 崔艳华, 孟凡明. 钒电池储能系统的发展现状及其应用前景[J]. 电源技术, 2005(11): 77–81. |
| [4] | 杨守志. 钒冶金[M]. 北京: 冶金工业出版社 , 2010. |
| [5] | 廖世明, 柏谈论. 国外钒冶金[M]. 北京: 冶金工业出版社 , 1985. |
| [6] | 赵卓.氧化铝生产流程中钒的提取研究[D]. 长沙:中南大学,2010. |
| [7] | 杨重愚. 氧化铝生产工艺[M]. 北京: 冶金工业出版社 , 1982. |
| [8] | 史玲, 王娟, 谢建宏. 钠化法提钒工艺条件的研究[J]. 矿冶工程, 2008, 28(1): 58–61. |
| [9] |
EI-Nadi Y A, Awwad N S, Nayl A A. A comparative study of vanadium extraction by Aliquat-336 from acidic and alkaline media with application to spent catalyst[J].
International Journal of Mineral Processing, 2009, 92(3/4): 115–120. |
| [10] | 肖超, 肖连生, 成宝海, 等. 石煤钒矿碱性浸出液提取钒新工艺[J]. 稀有金属与硬质合金, 2011, 39(1): 4–7. |
| [11] | 刘波, 冯光熙, 黄祥玉, 等. 用N263从钒溶液中回收钒[J]. 化学研究与应用, 2003, 15(1): 54–57. |
| [12] | Clark R J H, Brown D. The chemistry of vanadium, niobium and tantalum[M]. London: Oxford Pergamon Press , 1975: 261-302. |
| [13] | 柯兆华, 张贵清, 关文娟, 等. 季铵盐从碱性钨酸钠溶液中萃取钨的研究[J]. 稀有金属与硬质合金, 2012, 40(6): 1–4. |
| [14] | 盖会法, 高自立, 孙思修, 等. 季铵盐N263和叔胺TOA萃取铼(Ⅶ)的研究[J]. 应用化学, 1987(5): 20–24. |
| [15] | 杨项军, 陈景, 韦群燕, 等. 用CTAB/TBP体系从碱性氰化液中萃取低浓度Au (Ⅰ)[J]. 中国有色金属学报, 2004, 14(11): 1958–1962. |
| [16] | 李文华, 杨永会, 孙思修. 伯胺N1923萃取钼(Ⅵ)的研究[J]. 稀有金属与硬质合金, 1998(2): 1–4. |
| [17] | 曾平, 王玉鑫, 王韧. 伯胺N1923萃取钨的机理研究[J]. 湘潭大学自然科学学报, 1991(2): 79–84. |
| [18] | 姜键准, 周维金, 高宏成, 等. N1923从碱性氰化物中萃取金(Ⅰ)的研究[J]. 无机化学学报, 2001, 17(3): 343–348. |
| [19] | 周扬, 李学玲, 顾烁玥, 等. 用N503/TBP从碱性氰化液中萃取低浓度金[J]. 中国有色金属学报, 2009, 19(7): 1345–1349. |
| [20] | 杨佼庸, 刘大星. 萃取[M]. 北京: 冶金工业出版社 , 1988. |
| [21] | 曾添文, 戴文灿, 张志, 等. 离子交换树脂对钒(V)交换性能的研究[J]. 离子交换与吸附, 2002, 18(5): 453–458. |
 2014, Vol. 5
2014, Vol. 5

