| 功能基因芯片技术在生物冶金研究中的应用进展 |
2. 生物冶金教育部重点实验室,长沙 410083
2. Key Laboratory of Bio-metallurgy of Ministry of Education of China, Changsha 410083, China
生物冶金指利用微生物将有价金属从矿石溶浸出来,并使其进入溶液的过程.近年来,随着矿产资源的大量开采,高品位矿石日益枯竭,而传统方法在处理贫矿、废矿、表面矿及难采、难冶矿等低品位矿石时,存在成本高、效率低、环境污染严重等问题.生物冶金作为一项新型的冶金工艺,有着“绿色冶金”的美誉,具有成本低、设备简单、操作方便、环境友好、资源利用率高等优势[1-3],在铜、金、钴、锌等有色金属低品位矿的冶炼上获得了较为广泛的应用,并取得了良好的社会及经济效益[3-6].
在生物冶金过程中,冶金微生物扮演着重要的角色,一般而言,冶金微生物是指能够利用亚铁离子或(和)还原性无机硫化物为能源的菌株,主要包括嗜酸硫杆菌属(Acidithiobacillus)、钩端螺旋菌属(Leptospirillum)、硫化叶菌属(Sulfolobus)、硫化杆菌属(Sulfobacillus)、酸菌属(Acidianus)、嗜酸菌属(Acidiphilium)、生金球菌属(Metallosphaera)和铁质菌属(Ferroplasma)等8 个属.生物冶金体系中微生物的类型复杂多样,性状与功能差异较大,在生物浸出过程中扮演的角色和发挥的作用各不相同.然而,由于绝大多数浸矿微生物代谢类型都属于化能自养型,很大一部分不能被目前的培养技术所培养,并且,以分离培养为基础的传统分析技术存在各种不足,难以对浸矿微生物进行定性定量分析和实时监控[7].目前对于基因表达分析也以蛋白质检测为主,同样依赖于微生物的培养或者过程繁琐的构建表达载体的体外表达方法.
核酸技术可直接从DNA 水平对未可培养微生物进行研究,它的发展和应用大大减少了对培养方法的依赖性,极大扩展了微生物资源的利用空间.随着分子生物学技术的迅速发展,PCR-RFLP[8]、PCR-DGGE[9-10]、FISH[11-12]等方法在检测冶金微生物群落结构及动态等方面有着广泛应用,但都难以准确、快速、高通量地进行检测与分析.比如RFLP 每一个种都有多个谱带类型,故用于群落多样性分析时过于复杂,更加适合于在基因测序之前对克隆文库及分离物进行筛选;DGGE 价格较高且灵敏度低,而且基因克隆与序列分析工作量大;FISH 检测技术尽管灵敏度高、特异性强,但每次检测的微生物种类有限[13];此时,基因芯片的出现很好地克服了这些问题,功能基因芯片便是其中重要的一种.
微生物的浸矿性能归根结底于菌种所包含的各类功能基因不同,所以可通过在基因水平上对菌种的浸矿性能展开研究,找到与浸矿效率相关的基因,从而找到影响菌种浸矿性能的根本原因.另外通过对微生物种群及其相关基因(如16S rRNA)的检测,可获知高活性浸矿体系的微生物群落特征.这种以功能基因组学、基因芯片等基因新技术为主要手段形成的功能基因芯片技术体系,可以对菌种进行定性及定量检测,探究其基因的表达状况与群落结构组成,实现菌种的快速筛选和群落的优化调控,从而最终提高低品位矿物生物浸出速率和浸出率[14](如图 1).
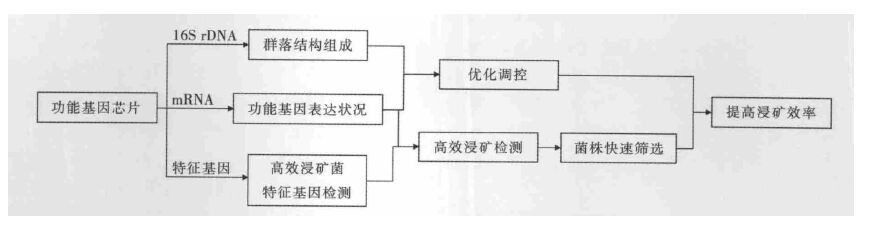 |
| 图 1 功能基因芯片技术在生物冶金过程中的作用机制 |
1 功能基因芯片技术
基因芯片(Microarrays)是近年来兴起的一种强大基因技术,由编码各种在不同生物化学循环过程发挥重要作用的关键酶,以及其他重要代谢功能的基因序列组成的基因芯片即称之为功能基因芯片(FGAs),具有高通量、平行化、微量化、自动化、低成本的特征,它的出现给冶金微生物研究带来了极大突破.功能基因芯片对于检测微生物种群和群落的功能活动和生理状况发挥着重要作用.它通常建立在一组已知序列的催化生化反应的关键酶基因上,这些基因有的与研究对象有确定关系,也有的与研究对象的关系有待考证[15].用于环境微生物中的功能基因芯片包含了地理生物化学过程,如C、N、P、S 等元素循环,有机污染物降解,金属的还原、氧化、及抗性相关的关键基因,由于芯片所涉及的过程大都是地理化学过程(geochemical processes),所以功能基因芯片又称为GeoChip[16].目前它有3 个版本,分别为:GeoChip 2.0、GeoChip 3.0 和GeoChip 4.0.现在生物浸出过程中应用的主要还是第二代功能基因芯片GeoChip 2.0,或称FGA -II.
将功能基因芯片应用于生物冶金是对冶金微生物研究的一大飞跃,对于检测生物浸出体系中冶金微生物种群和群落的生理状态和功能活动,以及快速筛选高效浸出菌种都十分有效.目前用于生物浸出过程的功能基因芯片主要是针对浸矿微生物群落结构与功能分析,其探针除包含各个代谢途径中大量功能基因外,还含有微生物系统发育和分类地位的冶金微生物16S rRNA 序列.这些探针是根据已发现的浸矿微生物已经克隆和测序所获得的序列,结合NCBI 中已有序列设计出来的,并且设计探针时充分考虑了探针的灵敏度、特异性和定量性特征.其中,包含了已知的27 个属和55 种嗜酸性细菌的基因序列,这些序列几乎涵盖了冶金微生物的所有代谢过程,所涉及的功能基因有金属离子抗性基因、碳代谢相关基因、氮代谢相关基因、硫代谢相关基因、铁代谢相关基因、DNA代谢与修复基因、膜蛋白相关基因以及其它相关功能基因,16S rRNA 也涉及到了各个冶金微生物种属[7].
2 功能基因芯片技术在生物冶金研究中的应用自从美国橡树岭国家实验室的周集中教授等构建了世界上第一块用于土壤环境检测的功能基因芯片和用于微生物群落鉴定的群落基因组芯片[17-18]以来,FGAs 虽说在环境微生物领域历史不长,但发展迅速,应用广泛.主要包括分析大量微生物基因组学积累的信息、基因结构与功能的关系以及环境生物检测、菌种鉴定及细菌检测、分子生态学研究等方面.20 世纪40 年代末,矿业界开始应用微生物进行研究和应用,但很少有报道应用基因芯片技术来研究冶金微生物的生理生化功能[19].2007 年,尹华群等首次将功能基因芯片技术应用于浸矿酸性环境微生物检测中,他根据已知的嗜酸微生物的基因序列开发了一种50 mer 的寡核苷酸芯片,并对其特异性、灵敏度及定量性能进行了评估[20].此后,功能基因芯片在生物浸出过程中的应用逐渐发展起来,其主要用于种群结构、群落动态检测和功能基因表达分析.
2.1 冶金微生物种群结构和群落动态检测及分析环境微生物研究的难点是无法准确定性和直接定量地检测环境中可能存在的众多微生物种群.功能基因芯片的发展提供了更大的检测样本容量和更高灵敏度的技术平台,使研究者能够对环境微生物的许多遗传学特征进行检测.中南大学生物冶金教育部重点实验室的申丽等人在第一代功能基因芯片(FGA-I)研究的基础上,发展和建立了针对浸矿体系微生物群落分析的第二代50 mer 寡核苷酸基因芯片(FGA-II)及其技术体系,芯片上所涉及的靶标序列几乎包含目前在自然酸性环境和浸出系统中已知的27 个属和55种嗜酸性细菌的全部基因序列,能够有效地分辨酸性生态系统中微生物群落结构和功能的差异.他们利用所构建的群落基因组芯片和功能基因芯片,对江西德兴铜矿和山西铅锌矿共9 个不同的浸矿样点(DWT、SLS、YTW、ZJ、FKBZ、KZX、YSKI、YSK2 和YSK3)进行研究,结果发现在不同样点微生物的种群结构不同,这些微生物主要涉及到了19 个属或种.另外进一步的分析发现,微生物种群结构与它们的生存环境的理化性质的差异存在很强的相关性(P<0.05)[21].王军等也利用此功能基因芯片,在广东梅州进行低品位铜矿石生物冶金万吨级浸出试验,并对生物浸出过程中微生物群落进行了全程监控,实现了在工业规模上运用功能基因芯片检测浸矿微生物种群的变化规律.浸矿初期的优势菌种为A.ferrooxidans菌,其他菌生长缓慢.这可能由于酸预浸释放的亚铁离子为A.ferrooxidans 菌提供良好的能源物质; 浸矿中期A.ferrooxidans 菌减少,L.ferrooxidans 菌逐渐成为优势菌种,并且A.caldus菌逐渐增多.这是因为在反应中期,硫化矿被氧化产生较多量的元素硫和含硫化合物,能利用硫元素生长的微生物迅速成为优势菌种; 浸出后期A.ferrooxidans菌重新成为优势菌种,但优势不如初期明显,这是因为铁离子沉淀生成铁矾或者局部水解,溶液中亚铁离子相比浸出初始阶段有所减少[22].Liu Yi 等将外来菌种Acidithiobacillus thiooxidans A01 引入原有A.caldus、L.ferriphilum、A.ferrooxidans、S.thermosulfidooxidans、Acidiphilium spp.和F.thermophilum6 种菌的黄铁矿浸出体系,发现引种后黄铁矿溶解率由82.3 %提高到了93 %,浸出率提高了10.7 %.通过RT-PCR 和功能基因芯片对微生物群落及功能基因表达进行了研究,发现引种后除A.Caldus 外其余菌数量都增加了,而A.caldus,L.ferriphilum,F .thermophilum 仍为体系中优势菌种,除A.caldus 外其余菌的铁、硫、碳、氮代谢相关基因,以及金属抗性、电子传递、ESP(胞外多聚物)相关基因都表达上调.从基因层面表明不同生理类型的微生物功能基因之间的互补,导致的不同微生物的协同作用,可据此对浸矿体系进行优化,从而提高浸矿效率[23].
2.2 冶金微生物功能基因表达分析功能基因表达法分析可以用于了解浸矿微生物在环境中的功能活动,mRNA 是转录基因表达的第一级产物,功能基因芯片可以通过对mRNA 的检测来分析基因的表达情况.美国橡树岭实验室Gao H 等[24]采用WCRA (whole-community RNA amplification)技术将RNA 扩增,这是利用功能基因芯片技术检测自然环境中微生物群落活性的首次报道.刘毅等采用功能基因芯片,检测含低品位硫化铜新鲜培养基连续流加对AMD 中微生物群落的影响,结果表明:存在于L.ferriphilum、At.caldus、Sulfobacillus sp.、Acidiphilium sp.和Sulfolobus spp 的功能基因表达量增加,而At.ferro-oxidans、S.thermosulfidooxidans 和Alicyclobacillus sp.的功能基因表达量减少,从而证实了L.ferriphilum、At.caldus、Sulfobacillus sp.、Acidiphiliumsp.和Sulfolobus spp 能同时氧化铁和硫的结论,以及说明了流加培养基对At.ferro-oxidans、S.thermosulfidooxidans和Alicyclobacillus sp.的生长不适合[25-26].李乾应用功能基因芯片研究了5 株浸矿微生物共培养体系,在氟胁迫下的基因调控机理.通过功能基因芯片对该共培养体系在氟胁迫下的基因表达图谱研究,对差异表达基因进行功能分类分析,探明了该共培养体系中与氟胁迫相关的基因主要涉及到硫代谢、细胞膜、电子传递、解毒、碳固定、氮代谢等多个方面功能的代谢途径.并探讨了其基因协作现象以及代谢网络交互调控机制,通过对各菌株功能基因的表达情况,验证了不同种群间的协作及竞争关系[27].谢建平采用功能基因芯片分析来自德兴、银山和永平3 座铜矿的5 个AMD 样品基因多样性、结构和代谢潜力.研究发现,这些微生物群落功能基因组成差异较大.通过Mantel 检验表明,AMD 中的微生物群落功能基因组成,可能在很大程度上受周围环境地球化学参量而不是空间距离的影响.S、Mg、Cu、Ni、Co、B 和La与微生物群落功能基因组成显著相关(P<0.05).功能基因(如narG 和norB)和几个关键功能过程(如甲烷生成、氨化、反硝化、硫酸盐还原和有机物降解)与地化参量显著相关(P<0.10)[28].以上研究结果表明DNA芯片技术在微生物全基因组的基因表达谱研究,以及某特定代谢途径上特殊基因的研究等方面具有很大的潜力.
3 前景展望功能基因芯片因具有快速、高通量、高精度、重复性好、特异性强、灵敏度高,及能够将微生物基因和生态环境功能直接联系起来等特点,为研究环境微生物种类、分布、功能、动力学的变化及相互关系的研究,提供了一种有力的手段.功能基因芯片可从基因水平同时、快速、准确的对生物冶金菌种进行检测与筛选,能够有效地分辨酸性生态系统中,微生物群落活动与功能的差异性.一方面大大缩短了菌种浸矿性能的检测时间,传统方法一次浸矿试验便需要数月,而利用功能基因芯片直接检测与浸矿性能相关基因,从而判定菌种及群落的优劣,这种方法仅仅只需3~5 d; 另一方面,从遗传物质的角度对菌种分析,不受环境及培养条件影响,使检测结果更加准确可靠,同时克服了目前绝大部分菌种不能人工分离培养的局限.芯片的构建加速了酸性环境中冶金微生物系统的结构、生理和功能的了解;从基因水平探究微生物群落结构和功能表达,并与生物冶金过程中的环境条件、物理化学因素相结合,对群落结构及浸出条件进行优化调控,实现了生物冶金由传统的描述性研究,向预测性研究的转变.筛选得到的优良菌种以及搭配合理的共培养体系,可大大提高浸出效率,降低可利用矿产资源的边界条件,缓解了当前矿产资源缺乏、矿物品位降低的危机,因而具有巨大的发展潜力与良好的应用前景.
然而,尽管功能基因芯片功能强大,应用潜力巨大,但是还有一些问题亟待解决.首先,功能基因芯片技术依赖于大量已知序列的基因或基因片段信息作为制备材料,这个资源库还不够丰富,尤其在生物冶金领域,冶金微生物的分子生物学研究历史还不够长,功能基因芯片技术应用还不够广泛,这个基因库还远远不够,目前只有Acidithiobacillus ferrooxidans ATCC23270 等少数几株菌基因组被全部测出.但是,随着基因组测序计划的继续进行,生物冶金的深入研究,冶金微生物的序列片段将会极大地丰富起来.其次,功能基因芯片技术本身存在一些基本问题,如探针对杂交体的稳定性影响,对自然环境中微量表达的基因灵敏度不够,对样品定量性更高潜能的挖掘,这些都是功能基因芯片技术的瓶颈问题,也将是将来功能基因芯片技术研究的重点.再次,除功能基因芯片构建的问题外,我们需要开发新的分析软件,改进数据分析、转换及模型建立,使其达到更高的自动化水平.如果这些问题都能得到妥善解决,相信功能基因芯片技术,必将为冶金微生物群落结构和功能的动力学研究带来一场新的革命.
| [1] |
Brierley J A, Brierley C L. Present and future commercial applications of biohydrometallurgy[J].
Hydrometallurgy, 2001, 59(2): 233–239. |
| [2] |
Ehrlich H L. Beginnings of rational bioleaching and highlights in the development of biohydrometallurgy: A brief history[J].
European Journal of Mineral Processing and Environmental Protection, 2004, 4(2): 102–112. |
| [3] |
Watling H R. The bioleaching of sulphide minerals with emphasis on copper sulphides-a review[J].
Hydrometallurgy, 2006, 84(1): 81–108. |
| [4] |
Breed A W, Dempers C J N, Hansford G S. Studies on the bioleaching of refractory concentrates[J].
Journal of The South African Institute of Mining and Metallurgy(South Africa), 2000, 100(7): 389–398. |
| [5] |
FU Bo, ZHOU Hong-bo, ZHANG Ru-bing, et al. Bioleaching of chalcopyrite by pure and mixed cultures of Acidithiobacillus spp. and leptospirillum ferriphilum[J].
International Biodeterioration & Biodegradation, 2008, 62(3): 109–115. |
| [6] |
Johnson D B. Biodiversity and interactions of acidophiles: Key to understanding and optimizing microbial processing of ores and concentrates[J].
Transactions of Nonferrous Metals Society of China, 2008, 18(6): 1367–1373. DOI: 10.1016/S1003-6326(09)60010-8. |
| [7] | 申丽, 刘学端, 邱冠周. 基于基因芯片对微生物基因功能与群落结构分析的硫化矿生物浸出分析[J]. 生物工程学报, 2008, 24(6): 968–974. |
| [8] |
Roane T M, Pepper I L. Microbial responses to environmentally toxic cadmium[J].
Microbial Ecology, 1999, 38(4): 358–364. DOI: 10.1007/s002489901001. |
| [9] |
Webster G, Newberry C J, Fry J C, et al. Assessment of bacterial community structure in the deep sub-seafloor biosphere by 16S rDNA-based techniques: a cautionary tale[J].
Journal of Microbiological Methods, 2003, 55(1): 155–164. DOI: 10.1016/S0167-7012(03)00140-4. |
| [10] |
Kim J, Koo S Y, Kim J Y, et al. Influence of acid mine drainage on microbial communities in stream and groundwater samples at Guryong Mine, South Korea[J].
Environmental Geology, 2009, 58(7): 1567–1574. DOI: 10.1007/s00254-008-1663-8. |
| [11] |
Mahmoud K K, Leduc L G, Ferroni G D. Detection of acidithiobacillus ferrooxidans in acid mine drainage environments using fluorescent in situ hybridization (FISH)[J].
Journal of Microbiological Methods, 2005, 61(1): 33–45. DOI: 10.1016/j.mimet.2004.10.022. |
| [12] |
Schippers A, Nagy A A, Kock D, et al. The use of FISH and real-time PCR to monitor the biooxidation and cyanidation for gold and silver recovery from a mine tailings concentrate (Ticapampa, Peru)[J].
Hydrometallurgy, 2008, 94(1/4): 77–81. |
| [13] |
Kirk J L, Beaudette L A, Hart M, et al. Methods of studying soil microbial diversity[J].
Journal of Microbiological Methods, 2004, 58(2): 169–188. DOI: 10.1016/j.mimet.2004.04.006. |
| [14] | 张成桂, 夏金兰, 王晶, 等. 嗜酸硫杆菌属硫氧化系统研究进展[J]. 生物技术通报, 2007, 24(1): 59–65. |
| [15] | 金敏, 李君文. 基因芯片技术在环境微生物群落研究中的应用[J]. 微生物学通报, 2008(9): 1466–1471. |
| [16] |
HE Zhi-li, Van Nostrand J D, WU Li-you, et al. Development and application of functional gene arrays for microbial community analysis[J].
Transactions of Nonferrous Metals Society of China, 2008, 18(6): 1319–1327. DOI: 10.1016/S1003-6326(09)60004-2. |
| [17] |
ZHOU Ji-zhong, Thompson D K. Challenges in applying microarrays to environmental studies[J].
Current Opinion in Biotechnology, 2002, 13(3): 204–207. DOI: 10.1016/S0958-1669(02)00319-1. |
| [18] |
WU Li-you, Thompson D K, LI Guang-shan, et al. Development and evaluation of functional gene arrays for detection of selected genes in the environment[J].
Applied and Environmental Microbiology, 2001, 67(12): 5780–5790. DOI: 10.1128/AEM.67.12.5780-5790.2001. |
| [19] | 周吉奎, 钮因健. 硫化矿生物冶金研究进展[J]. 金属矿山, 2005, 346(4): 24–30. |
| [20] |
YIN Hua-qun, QIU Guan-zhou, WANG Dian-zuo, et al. Development and evaluation of 50-met oligonucleotide arrays for detecting microbial populations in acid mine drainages and bioleaching systems[J].
Journal of Microbiological Methods, 2007, 70: 165–178. DOI: 10.1016/j.mimet.2007.04.011. |
| [21] | 申丽. 基于基因芯片对浸矿微生物群落结构及功能的定量化研究[D]. 长沙: 中南大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10533-1011177916.htm |
| [22] | 王军. 低品位复杂硫化铜矿生物浸出的研究与应用[D]. 长沙: 中南大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10533-1011177385.htm |
| [23] |
LIU Yi, YIN Hua-qun, ZENG Wei-min, et al. The effect of the introduction of exogenous strain acidithiobacillus thiooxidans A01 on functional gene expression, structure and function of indigenous consortium during pyrite bioleaching[J].
Bioresource Technology, 2011, 102: 8092–8098. DOI: 10.1016/j.biortech.2011.06.012. |
| [24] |
Gao H, Yang Z K, Gentry T J, et al. Microarray-based analysis of microbial community RNAs by whole-community RNA amplification[J].
Applied and environmental microbiology, 2007, 73(2): 563–571. DOI: 10.1128/AEM.01771-06. |
| [25] |
YI Liu, YIN Hua-Qun, ZENG Wei-min, et al. The effect of the introduction of exogenous strain acidithiobacillus thiooxidans A01 on functional gene expression, structure and function of indigenous consortium during pyrite bioleaching[J].
Bioresource Technology, 2011, 102(17): 8092–8098. DOI: 10.1016/j.biortech.2011.06.012. |
| [26] |
LIU Yi, YIN Hua-qun, LIANG Yi-li, et al. Changes in the composition of an acid mine drainage microbial community upon successive transfers in medium containing low-grade copper sulfide[J].
Bioresource Technology, 2011, 102(20): 9388–9394. DOI: 10.1016/j.biortech.2011.05.095. |
| [27] | 李乾. 低品位铀矿生物浸出及浸矿菌种耐氟机理研究[D]. 长沙: 中南大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10533-1012474747.htm |
| [28] | 谢建平. 功能基因芯片(GeoChip)在两种典型环境微生物群落分析中应用的研究[D]. 长沙: 中南大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10533-1011177388.htm |
 2013, Vol. 4
2013, Vol. 4


