| 锌冶炼污染物减排与治理技术及理论基础研究进展 |
2. 国家重金属污染防治工程技术研究中心, 长沙 410083;
3. 江西理工大学资源与环境工程学院, 江西 赣州 341000
2. Chinese National Engineering Research Center for Control & Treatment of Heavy Metal Pollution, Changsha 410083,China;
3. School of Resource and Environmental Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China
世界上80 %左右的锌采用“沸腾焙烧-浸出-净化-电积”湿法炼锌工艺.硫化锌精矿中常伴生有10 %以上的铁,在沸腾焙烧过程不可避免生成铁酸锌[1,2].因铁酸锌性质稳定,在常规酸浸过程难以溶出,最后进入锌浸出渣[3]造成资源浪费和二次污染.同时锌冶炼过程产生大量酸性废水,废水具有pH 值较低、重金属离子种类多、浓度高、形态复杂、毒性大,传统的石灰中和法难以实现稳定达标与回用.锌冶炼废水经石灰中和法处理后产生大量的含重金属废渣,虽然现有固化等技术可以实现重金属废渣的稳定,但是处理后的重金属难以实现回收,容易造成资源的浪费和环境污染[4-6].围绕上述制约锌冶炼行业可持续发展的关键问题,为了实现锌的清洁冶炼、“三废”治理与资源化,中南大学研发了选冶联合清洁炼锌新方法、锌冶炼废水生物制剂法深度处理与回用新技术,以及锌废渣硫化回收人造硫化矿新工艺.本文对前期研究成果进行简要总结,旨在为锌冶炼行业污染物源头减排与综合治理的进一步研究提供新思路与参考.
1 选冶联合清洁炼锌减排技术研究传统的锌冶炼工艺主要是焙烧-酸浸-电积过程,由于沸腾氧化焙烧将锌铁同时转变为易溶的氧化物和稳定的副产物铁酸锌,造成酸性浸出液需冗长的净化工序,同时对于铁酸锌的处理也成为锌冶炼难题[7].为了实现锌的清洁冶炼,提出并研发了选冶联合清洁炼锌新方法.工艺关键是实现铁锌源头分离,使氧化锌选择性从铁酸锌中析出,铁酸锌转变为具有磁性的四氧化三铁,从而提高锌的浸出率和铁的回收率.基于此目的,首先研究了铁酸锌在弱还原气氛下的物相转化规律,查明了铁酸锌的分解历程,并通过控制还原气氛,抑制了铁酸锌过还原为氧化亚铁的途径.同时,研究了实际锌焙砂的还原焙烧-酸浸-磁选全工艺流程,有效地实现了铁锌分离.
1.1 铁酸锌分解基础研究 1.1.1 铁酸锌的分解历程研究采用CO 混合气作为还原气,控制CO 浓度为4 %,还原温度为800 ℃,纯铁酸锌在不同反应时间下的还原产物XRD 分析结果如图 1 所示,其中图 1(a)为还原产物10°~80°X 射线衍射图谱,图 1(b)为60°~65°特征峰慢扫衍射峰.由图 1 可知,铁酸锌还原过程中,氧化锌衍射峰的强度逐渐增加,铁酸锌的特征峰逐渐向四氧化三铁特征峰偏移,说明了铁酸锌的点阵常数收缩,向四氧化三铁转化[8].由于铁酸锌和四氧化三铁能够形成连续固溶体[9],整个过程并未同时出现铁酸锌和四氧化三铁的特征峰.铁酸锌的特征峰尚未完全转化为四氧化三铁的特征峰,同时在还原时间进行到100 min 时,出现了铁锌固溶体(Fe0.85-xZnxO)的特征峰[10],证明了过还原条件下铁酸锌及四氧化三铁尖晶石结构的崩塌和方铁矿(Fe1-xO)结构的形成,方铁矿中含有混乱和缺陷结构诱使产生了氧化亚铁,这一反应历程与铁氧化物还原反应的物相转变机制类似[11-12],不同的是由于锌的存在使在反应后期还原迁移至混乱结构的方铁矿晶格中形成铁锌固溶体(Fe0.85-xZnxO)[13],该物相的产生将降低铁锌的分离效率.由图 2 的铁酸锌还原反应历程图可知,实现铁酸锌的选择性还原,最主要的是阻止铁锌固溶体的生成以及四氧化三铁的过还原.
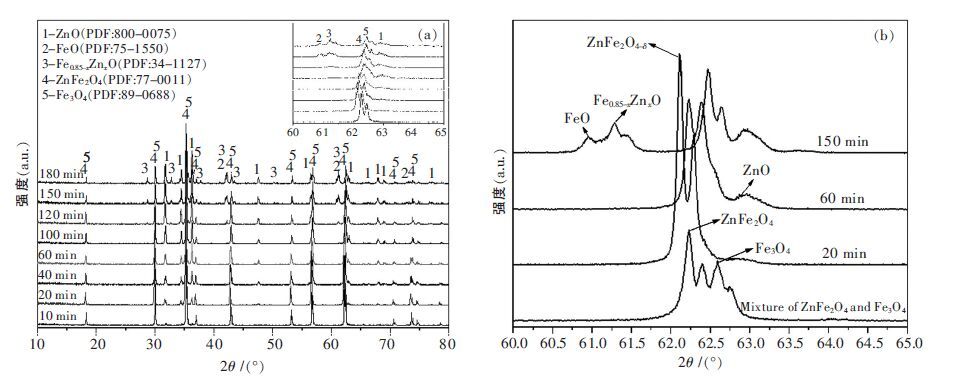 |
| 图 1 不同时间下铁酸锌还原产物XRD |
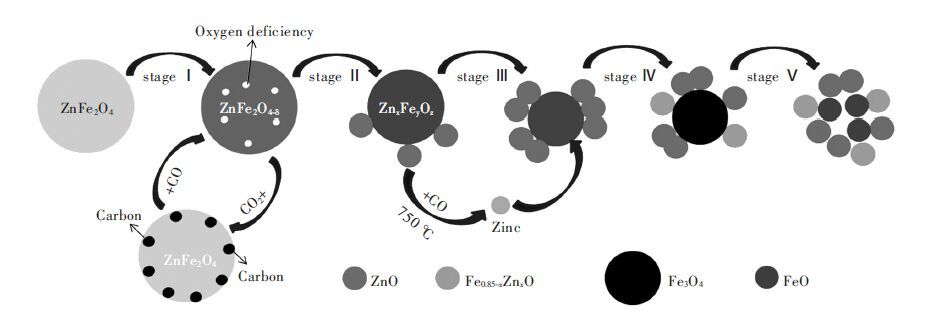 |
| 图 2 铁酸锌分解历程图 |
1.1.2 铁酸锌的选择性还原研究
通过控制铁酸锌的还原条件,可抑制四氧化三铁的过还原以及铁锌固溶体的生成.图 3 为还原温度800 ℃,8 %CO,20 %CO/CO+CO2时铁酸锌分解产物随时间变化规律.图 3(a)表明,在还原过程中仅发现铁酸锌特征峰向四氧化三铁特征峰逐渐偏移,并未出现铁锌固溶体和氧化亚铁的特征峰.图 3(b)中的Fe2+含量分析也表明亚铁在反应过程中起关键性作用,亚铁替代尖晶石中的锌离子,使锌离子发生偏聚过饱和形成氧化锌[14],反应后期由于还原产物同时会氧化二氧化碳[15],亚铁未过饱和以产生氧化亚铁.因此,该反应条件实现了铁酸锌的选择性还原.
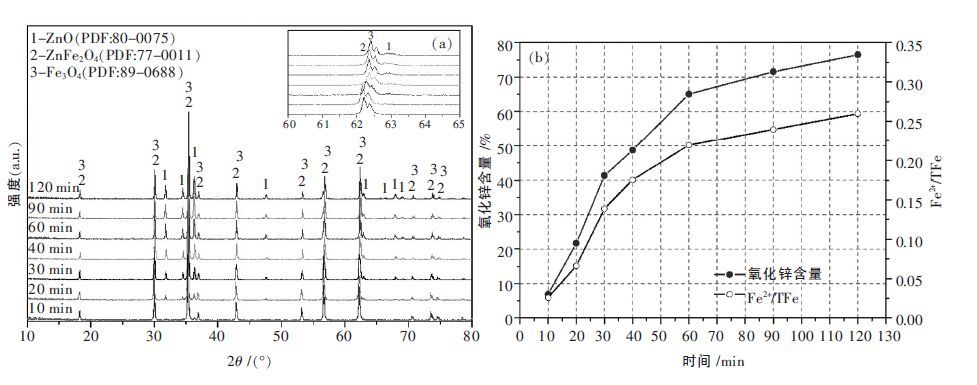 |
| 图 3 铁酸锌分解产物XRD 及分解产物中ZnO 及Fe2+含量的变化规律 |
1.2 铁锌分离工艺研究
锌焙砂在750 ℃,8 %CO,20 %CO/CO+CO2的条件下还原75 min 后,对还原焙砂进行酸性浸出,实验结果如图 4 所示.酸浸条件对锌的浸出率影响不大,锌的浸出率可保持在92 %以上,而浸出酸度对铁的浸出率有较大影响.铁的浸出率在保证锌的浸出率达到92 %的条件下能维持在10 %以下,同时有限的提升酸度不能大幅提升锌铁的浸出率,说明还原产物是相当稳定的.因此控制合适的浸出条件完全可实现铁锌的分离,通过对浸出渣检测发现,未浸出的锌主要以硫化锌形式存在,并含有少量未完全分解的铁酸锌.
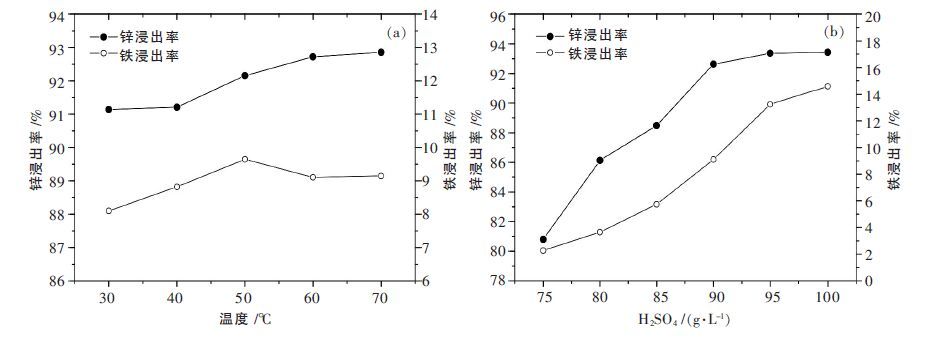 |
| 图 4 浸出温度及酸度对铁锌浸出率的影响 |
对浸出渣采用磁选工艺回收铁,实验结果如图 5所示.铁的总回收率可达到85 %以上,而铁的品位在52 %左右.
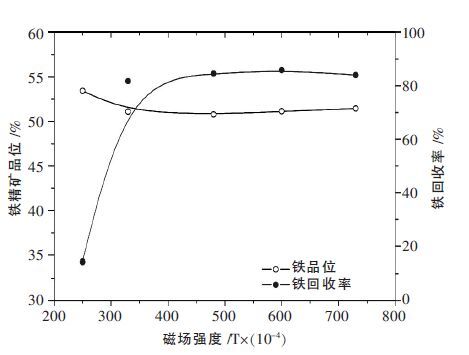 |
| 图 5 磁场强度对浸出渣磁选回收铁的影响 |
提出了选冶联合新工艺流程如图 6 所示.
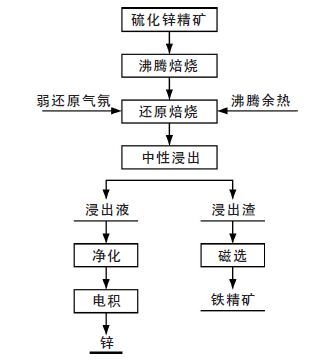 |
| 图 6 选冶联合清洁炼锌工艺 |
本工艺具有以下优势:①还原焙烧温度低(650~800 ℃),可以充分利用沸腾焙烧余热,能耗较低;②还原焙砂中的铁主要以四氧化三铁形式存在,使铁保留在稳定的尖晶石结构中,中性浸出过程中不会有大量的铁溶出,实现了铁锌的源头分离;③浸出渣可通过磁选回收铁精矿,实现了铁的资源化.
2 锌冶炼废水生物制剂法深度处理与回用新技术研究目前我国锌冶炼产生重金属废水主要采用石灰或硫化物中和沉淀法处理[16],基于沉淀剂中单一基团H-或S2-与废水中金属离子形成难溶化合物而去除重金属.由于有色重金属废水具有离子种类多、金属离子浓度和硬度高、水量大等特点,废水中多金属离子与单一基团形成难溶化合物的条件不同,难以实现废水中多金属离子的同时深度净化,致使废水处理不能稳定达标排放; 而且净化水硬度高而回用困难.为了突破重金属废水深度净化与回用的技术瓶颈,中南大学环境所研发了“生物制剂配合-水解-脱钙-絮凝分离” 一体化新工艺,实现了广泛的工业应用.
2.1 生物制剂法深度净化重金属废水的理论基础研究中南大学环境所开发了深度净化多金属离子的复合配位体水处理剂(生物制剂),解决了目前化学药剂难以同时深度净化多金属离子的缺陷.生物制剂是以硫杆菌为主的复合功能菌群代谢产物与其它化合物进行组分设计,通过基团嫁接技术制备的含有大量羟基、巯基、羧基、氨基等功能基团组的水处理药剂,并成功实现了产业化,2009 年建成了1 万t/a 重金属废水处理剂生产线.
2.1.1 不同金属离子的最适配体基团设计研究通过构建各重金属离子分别与羟基、羧基、酰胺基、巯基等基团形成单配位体配合物分子的稳定构型( 见图 7 和表 1).提出了各基团与重金属配合能力强弱的相关判据,即配合物分子的稳定化能越高其配位体基团与重金属配合的能力越强,基于此,确定了不同金属离子的最适配位体基团.
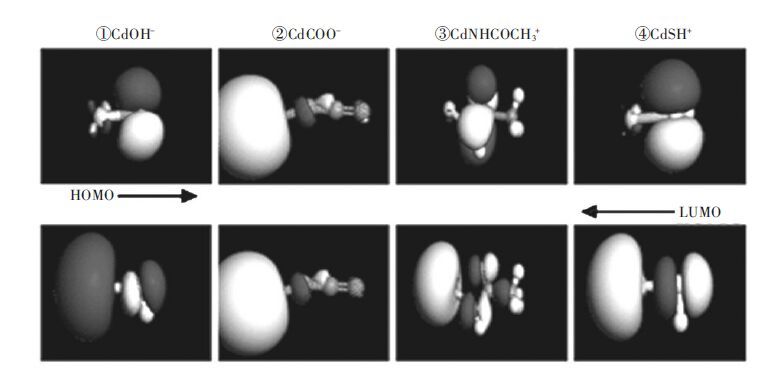 |
| 图 7 含镉配合物的前线轨道分布图 |
| 表1 各配位体与重金属离子形成配合物的稳定化能 |
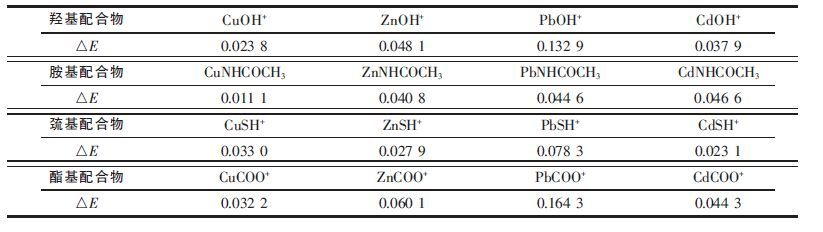 |
| 点击放大 |
2.1.2 微生物代谢产物酯基和巯基嫁接的新方法研究
研究发现柠檬酸和巯基乙酸可分别作为酯化和巯基化的反应试剂,在无机盐作催化剂的条件下,成功嫁接了酯基和巯基至细菌代谢产物表面(图 8),实现了多基团的扩增,基团扩增后产物与多金属的配合能力显著提高[17-18].
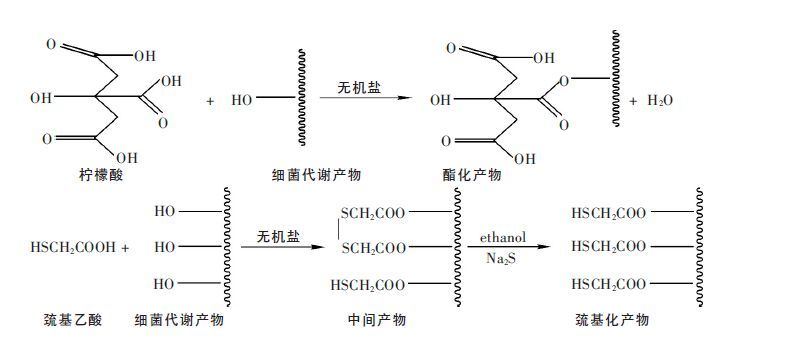 |
| 图 8 酯化和巯基化基团嫁接反应示意图 |
2.2 有色重金属复杂废水生物制剂法处理新工艺研究
“生物制剂配合-水解-脱钙-絮凝分离”一体化新工艺流程如图 9 所示.冶炼重金属废水通过生物制剂多基团的协同配合,形成稳定的重金属配合物,用碱调节pH 值,并协同脱钙;由于生物制剂同时兼有高效絮凝作用,当重金属配合物水解形成颗粒后很快絮凝形成胶团,实现重金属离子(铜、铅、锌、镉、砷、汞等)和钙离子的同时高效净化,净化水中各重金属离子浓度远低于《铅、锌工业污染物排放标准》(GB25466-2010),全面回用于冶炼企业.该技术净化重金属高效、抗冲击负荷强、无二次污染,使用过程无需外加营养源,投资及运行成本低、操作简便,可适用于处理各种重金属离子的工业废水.
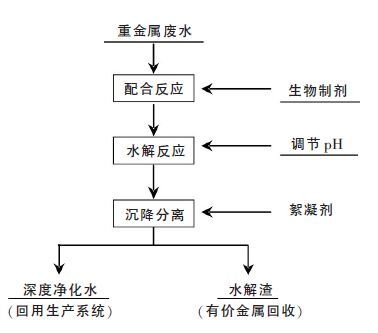 |
| 图 9 生物制剂配合-水解-脱钙-分离(CHDS)深度净化与回用一体化工艺 |
目前该技术已成功应用于我国最大的锌生产基地株洲冶炼集团650 m3/h 重金属废水深度处理与回用工程,生物制剂以废水中锌离子浓度的0.5 倍进行投加,生物制剂与废水中的重金属离子在管道内进行配合反应,调节pH 值使生物制剂-重金属配合离子水解,并协同脱钙控制净化水中钙离子浓度低于50 mg/L,处理后的废水进入斜板沉淀池实现固液分离,上清液全面回用于冶炼生产系统,水解渣通过压滤返回原料仓,每4 小时取废水及净化水分析其中锌、铅、镉离子浓度并计算日平均浓度,结果如图 10 所示.
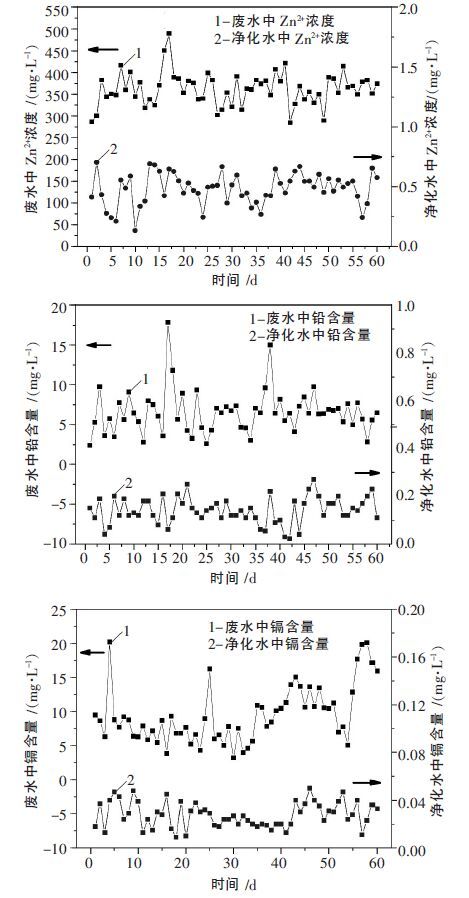 |
| 图 10 生物制剂对废水中锌、铅、镉离子脱除效果 |
由图 10 可知,废水中重金属离子平均浓度波动很大,且无规律,其中锌离子浓度波动范围为284.633~489.476 mg/L,铅离子浓度为2.38~17.84 mg/L,镉离子浓度波动范围为3.87~20.19 mg/L,经生物制剂法处理后废水中重金属离子得到深度脱除,净化水中锌离子浓度为0.133~0.703 mg/L,平均浓度为0.482 mg/L;铅离子残余浓度为0.022~0.25 mg/L,平均浓度为0.141 mg/L,镉离子残余浓度为0.011~0.037 mg/L,平均浓度为0.028 mg/L,各重金属离子浓度均远低于国家《铅锌工业污染物排放标准》(GB25466-2010)的限值,表明生物制剂直接深度处理工艺对废水中的重金属离子的脱除效果非常优越.该技术推广应用于河南豫光金铅集团、中金岭南韶关冶炼厂等二十多个重金属废水深度处理与回用工程.
3 含锌废渣硫化回收人造硫化矿工艺利用硫化浮选技术回收废渣中的重金属是近年来研究的新方法之一[19-21].从世界范围来看,目前绝大部分锌、铅等金属是从硫化矿中提取出来的,如果将废渣中的重金属转化为可浮选性好的金属硫化物,便可以运用成熟的浮选工艺对其进行回收,是一种重金属废渣资源化的新思路[22-24].该工艺不仅硫化转化率高、浮选工艺成熟,处理后的废渣化学性质稳定;同时,采用该技术回收的金属硫化矿可以直接进入现有的冶炼系统,对现有冶炼系统的改造成本相对较低.
根据地质学和矿物学理论,结晶性好的天然硫化矿是在水热条件下形成的.采用水热硫化技术不仅能保证较高的硫化率,同时可以对形成的人造硫化物晶体进行调控[25-27],容易得到结晶性与天然矿物相似、易于浮选的重金属硫化物,从而实现重金属的高效回收.本文以重金属处理后产生的中和沉淀渣为研究对象,考察了含锌废渣水热过程特征,优化了含锌废渣水热硫化工艺参数,开展了含锌废渣硫化物晶型调控技术研究,并开展了含锌废渣硫化回收人造硫化矿的中试研究,完善了含锌废渣硫化回收人造硫化矿工艺.
3.1 含锌废渣水热过程特征的研究含锌废渣的水热硫化是一种重金属化合物的溶解-再结晶过程,为了详细了解研究含锌废渣水热硫化反应的过程特征,本研究将含锌污泥与硫磺单质进行混合,对不同水热硫化时间下的含锌废渣水热硫化产物进行了XRD 分析,见图 11.
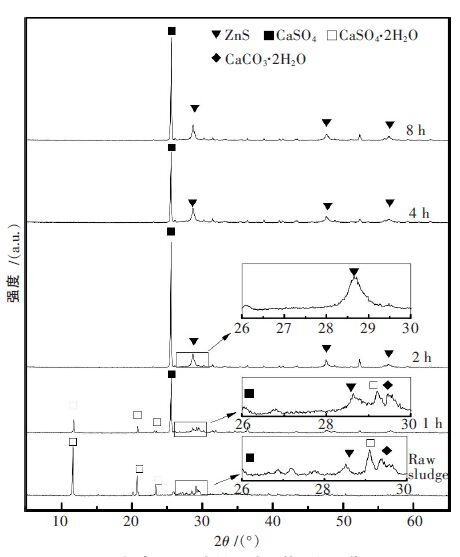 |
| 图 11 不同反应时间下的含锌废渣水热硫化产物的XRD 图 |
研究认为,水热硫化历程的第一步发生的是硫化剂硫磺的歧化反应(式(1)),表现图 11 中的硫磺的特征峰在1 h 后几乎完全消失:
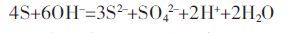
|
(1) |
由式(1)可知,硫磺歧化会消耗大量的H-并产生大量的H+,容易促使水热体系溶液的酸化和废渣中Zn 等重金属化合物的溶解(式(2)):
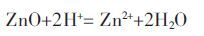
|
(2) |
然而,废渣体系中存在大量的含钙类化合物,对硫磺歧化产生的SO42-起到中和沉淀的作用(式(3)).图 11 也表明,1 h 后,XRD 图谱中开始出现了大量的CaSO4的特征峰.
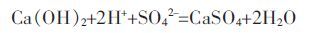
|
(3) |
水热硫化1 h 后的溶液中基本上存在的是Zn2+和S2-,但此时XRD 图谱上并未出现相应的ZnS 晶体的特征峰,这一方面说明硫酸钙晶体的生成早于硫化锌晶体的生成,另一方面说明Zn 与S 在此反应条件下可能是以某种含硫配合物方式结合的[28-29](式4):
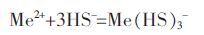
|
(4) |
随着反应时间的延长,溶液体系中重金属含硫配合物的浓度越来越高,当水热温度降低时,形成过饱和溶液,最终析出了ZnS 晶体.综上所述,水热过程硫磺与废渣中锌(主要是Zn(OH)2)及含Ca 杂质的总体反应方程式为:
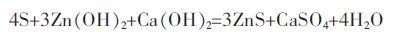
|
(5) |
反应过程特征研究结果表明,ZnS 的形成过程与反应时间、反应温度、硫磺添加量以及固液比等参数密切相关.水热条件对废渣中锌硫化率的影响因素研究结果如图 12 所示.
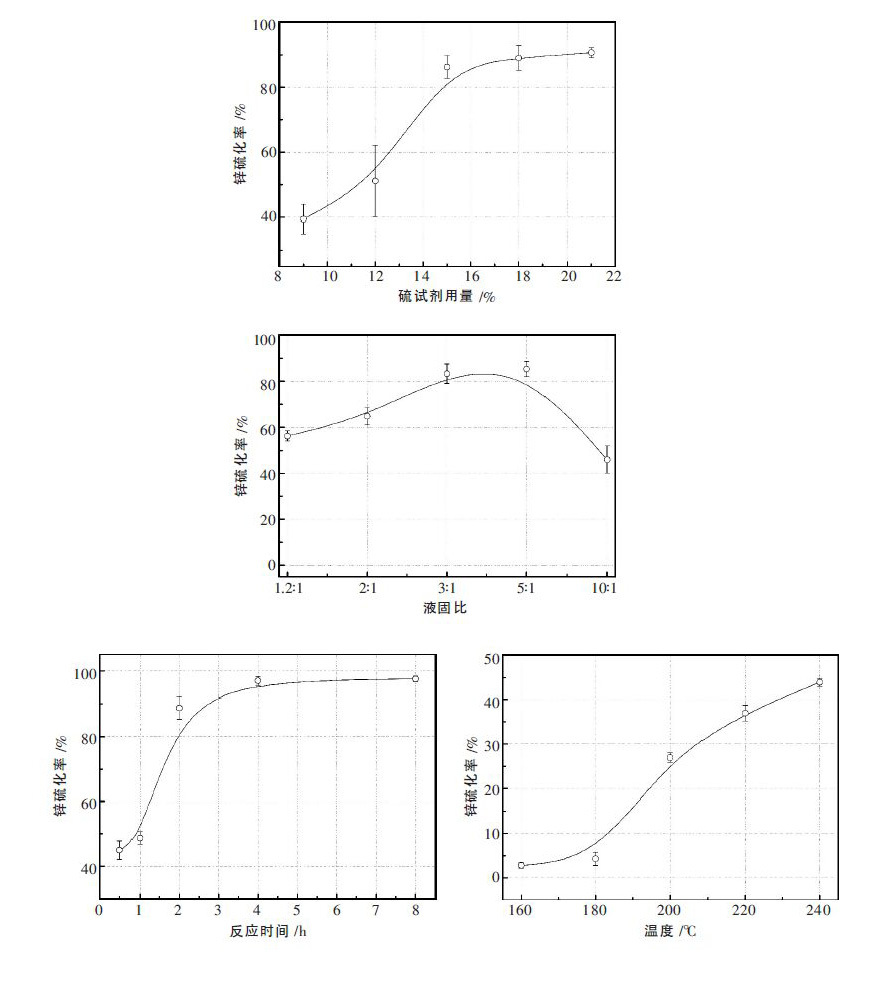 |
| 图 12 水热条件对废渣中锌硫化率的影响 |
实验初步确定了含锌废渣水热硫化工艺参数,即:水热硫化温度200 ℃、水热硫化时间2 h、矿浆浓度300 g/L、pH 值大于10.在此最优条件下,含锌废渣的锌硫化率不仅可以达到85 %以上,且硫化处理后的重金属废渣浸出毒性低于国家标准[30],说明水热硫化后的废渣中重金属的环境活性低,处理后的废渣性质稳定.
3.3 含锌废渣硫化物晶型调控技术研究水热合成的ZnS 的晶粒一般粒径较小、表面粗糙、容易粘附在脉石表面难以通过浮选进行有效分离(图 13(a)).一般认为表面光滑、带棱角的硫化物颗粒容易浮选,这主要是由于颗粒物表面光滑,硫化物与脉石的夹杂、吸附现象就会相应减小,有利于两者之间的分离.因此需要对生成的ZnS 晶体进行调控.晶型调控技术主要是对水热工艺的优化,通过提高反应温度、延长反应时间、添加矿化剂、优化前驱体浓度、筛选晶种等手段,加快ZnS 晶体的聚集生长,通过晶型调控技术,废渣中的ZnS 晶体结构有了较大程度的改变(图 13(b)).调控后产物的TEM 图分析发现,水热硫化含锌废渣产生的ZnS 晶粒尺寸为200~300 nm 左右,晶体为单一晶粒组成,晶体致密,晶体表面光滑平整,且ZnS 晶体与其他杂质组分分离.浮选结果也表明,未进行晶型调控之前,含锌废渣中的锌回收率为33.3 %,富集比为1.36;经过晶型调控之后,含锌废渣中锌的浮选回收率提高为72.8 %,富集比提高至1.57.
 |
| 图 13 晶型调控技术对制备的ZnS 的晶体的TEM 图 |
3.4 含锌废渣硫化回收人造硫化矿的中试结果
中试研究以株冶集团重金属废水处理产生的含锌废渣为对象,处理规模为500 t/a.硫磺、废渣、水等反应原料按一定配比进行调浆,然后通过泥浆泵与硫化反应釜连接的胶管打入硫化反应釜;硫化后通过浮选设备自带的矿浆泵吸入浮选机进行浮选.中试现场如图 14 所示:
 |
| 图 14 水热硫化浮选处理含锌废渣中试现场 |
中试研究结果表明,含锌废渣中Zn 的重金属硫化率达到87.34 %.处理1 t 含锌15 %、含铅1 %左右的废渣,可以回收约66.31 kg 铅锌综合品位为40 %的人造硫化物精矿.水热硫化后的上清液pH 值为7.2~8.5,上清液中的Zn 离子浓度为0.025~0.150 mg/L,达到国家排放标准.水热硫化浮选处理重金属废渣的工艺具有运行稳定、硫化率高等优点,具有潜在的应用前景.
4 结论锌冶炼行业通过实施选冶联合清洁炼锌减排技术可实现铁锌分离,还原焙砂在弱酸浸出过程中锌的一次浸出率达92 %以上、铁的浸出率低于10 %,铁的总回收率可达80 %以上.锌冶炼废水经过生物制剂法深度处理可稳定达到国家《铅锌工业污染物排放标准》并实现回用.硫化浮选回收人造硫化矿新工艺处理含锌废渣实现锌的硫化率85 %以上、浮选回收率达到72.8 %.研究成果将为锌冶炼行业污染物减排与资源循环提供新途径.
| [1] |
Graydon J W, Kirk D W. The mechanism of ferrite formation from iron sulfides during zinc roasting[J].
Metallurgical and Materials Transactions B, 1988, 19(5): 777–785. DOI: 10.1007/BF02650197. |
| [2] |
Chen T T, Dutrizac J E. Mineralogical changes occurring during the fluid-bed roasting of zinc sulfide concentrates[J].
Journal of the Minerals, Metals and Materials Society, 2004, 56(12): 46–51. DOI: 10.1007/s11837-004-0235-y. |
| [3] |
Filippou D, Demopoulos G P. Steady-state modeling of zinc-ferrite hot-acid leaching[J].
Metallurgical and Materials Transactions B, 1997, 28(4): 701–711. DOI: 10.1007/s11663-997-0044-0. |
| [4] |
Michael B Mooiman, Kathryn C Sole, Kinneberg D J. Challenging the traditional hydrometallurgy curriculum-an industry perspective[J].
Hydrometallurgy, 2005, 79(1/2): 80–88. |
| [5] |
Jha M K, Kumar V, Singh R J. Review of hydrometallurgical recovery of zinc from industrial wastes[J].
Resources, Conservation and Recycling, 2001, 33(1): 1–22. DOI: 10.1016/S0921-3449(00)00095-1. |
| [6] |
SHEN Hui-ting, Forssberg E. An overview of recovery of metals from slags[J].
Waste Management, 2003, 23: 933–949. DOI: 10.1016/S0956-053X(02)00164-2. |
| [7] | 孟波, 王吉坤, 张红耀. 锌冶金技术的发展概况[J]. 云南冶金, 2010, 39(2): 99–101. |
| [8] |
Deraz N M, Alarifi A. Structural, morphological and magnetic properties of nano-crystalline zinc substituted cobalt ferrite system[J].
Journal of Analytical and Applied Pyrolysis, 2012, 94: 41–47. DOI: 10.1016/j.jaap.2011.10.004. |
| [9] |
Kirk J W G D. The Evidence for a Miscibility Gap in the Fe3O4-ZnFe2O4 system -a review[J].
Metallurgical and Materials Transactions B, 1988, 19B: 919–925. |
| [10] |
B Andersson J S. Decomposition and Ordering in Fe1-xO[J].
Acta Crystallographica Section A, 1977(A33): 268–276. |
| [11] |
T Yamashita P H. Analysis of XPS spectra of Fe2+ and Fe3+ ions in oxide materials[J].
Applied Surface Science, 2008, 254(8): 2441–2449. DOI: 10.1016/j.apsusc.2007.09.063. |
| [12] |
Guo X, Sasaki Y, Kashiwaya Y, et al. Microreaction mechanism in reduction of magnetite to wustite[J].
Metallurgical and Materials Transactions B, 2004, 35(3): 517–522. DOI: 10.1007/s11663-004-0052-2. |
| [13] |
Lee F T. Reduction mechanisms and behaviour of zinc ferrite-Part 1: pure ZnFeiO4[J].
Trans. Instn Min. Metall. (Sect. C: Mineral Process. Extr. Metall), 2001, 110: C14–C24. DOI: 10.1179/mpm.2001.110.1.14. |
| [14] |
Hidayat T, Rhamdhani M A, Jak E, et al. The kinetics of reduction of dense synthetic nickel oxide in H2-N2 and H2-H2O atmospheres[J].
Metallurgical and Materials Transactions B, 2009, 40(1): 1–16. DOI: 10.1007/s11663-008-9212-0. |
| [15] |
Tabata M, Nishida Y, Kodama T, et al. CO2 decomposition with oxygen-deficient Mn(II) ferrite[J].
Journal of materials science, 1993, 28(4): 971–974. DOI: 10.1007/BF00400881. |
| [16] |
Jia Y, Zhang D, Pan R, et al. A novel two-step coprecipitation process using Fe(III) and Al(III) for the removal and immobilization of arsenate from acidic aqueous solution[J].
Water Research, 2012, 46(2): 500–508. DOI: 10.1016/j.watres.2011.11.045. |
| [17] |
LI Qing-zhu, CHAI Li-yuan, WANG Qing-wei, et al. Fast esterification of spent grain for enhanced heavy metal ions adsorption[J].
Bioresource Technology, 2010, 101(10): 3796–3799. DOI: 10.1016/j.biortech.2010.01.003. |
| [18] |
CHAI Li-yuan, LI Qing-zhu, ZHU Yong-hua, et al. Synthesis of thiol-functionalized spent grain as a novel adsorbent for divalent metal ions[J].
Bioresource Technology, 2010, 101(15): 6269–6272. DOI: 10.1016/j.biortech.2010.03.009. |
| [19] |
Kuchar D, Fukuta T, Onyango M S, et al. Sulfidation treatment of copper-containing plating sludge towards copper resource recovery[J].
Journal of Hazardous Materials, 2006, 138(1): 86–94. DOI: 10.1016/j.jhazmat.2006.05.037. |
| [20] |
Kuchar D, Fukuta T, Onyango M S, et al. Sulfidation of zinc plating sludge with Na2S for zinc resource recovery[J].
Journal of Hazardous Materials, 2006, 137(1): 185–191. DOI: 10.1016/j.jhazmat.2006.01.052. |
| [21] |
LI Yong, WANG Ji-kun, WEI Chang, et al. Sulfidation roasting of low grade lead-zinc oxide ore with elemental sulfur[J].
Minerals Engineering, 2010, 23(7): 563–566. DOI: 10.1016/j.mineng.2010.01.004. |
| [22] |
Rashchi F, Dashti A, Arabpour-Yazdi M, et al. Anglesite flotation: a study for lead recovery from zinc leach residue[J].
Minerals Engineering, 2005, 18(2): 205–212. DOI: 10.1016/j.mineng.2004.10.014. |
| [23] |
FA Ke-qing, Jan Miller, TAO Jiang, et al. Sulphidization flotation for recovery of lead and zinc from oxide-sulfide ores[J].
Transactions of Nonferrous Metals Society of China, 2005, 15(5): 1138–1144. |
| [24] |
Vanthuyne M A Maes. The removal of heavy metals from contaminated soil by a combination of sulfidisation and flotation[J].
Science of the Total Environment, 2002, 269(1/3): 69–80. |
| [25] |
Masoud Salavati-Niasari, MRL-E, Fatemeh Davarb. Controllable synthesis of wurtzite ZnS nanorods through simple hydrothermal method in the presence of thioglycolic acid[J].
Journal of Alloys and Compounds, 2009, 475(1/2): 782–788. |
| [26] |
Byrappa K, Adschiri T. Hydrothermal technology for nanotechnology[J].
Progress in Crystal Growth and Characterization of Materials, 2007, 53(2): 117–166. DOI: 10.1016/j.pcrysgrow.2007.04.001. |
| [27] |
CHENG Zhi-guo, SI Da-jie, GENG Bao-you. Controlled synthesis of copper sulfide 3D nanoarchitectures through a facile hydrothermal route[J].
Journal of Alloys and Compounds, 2010, 492(1/2): 44–49. |
| [28] |
Tagirov B R, Seward T M. Hydrosulfide/sulfide complexes of zinc to 250 ℃and the thermodynamic properties of sphalerite[J].
Chemical Geology, 2010, 269(3/4): 301–311. |
| [29] |
Tagirov B R, Suleimenova O M, Sewarda T M. Zinc complexation in aqueous sulfide solutions: Determination of the stoichiometry and stability of complexes via ZnS(cr) solubility measurements at 100 ℃ and 150 bars[J].
Geochimica et Cosmochimica Acta, 2007, 71(20): 4942–4953. DOI: 10.1016/j.gca.2007.08.012. |
| [30] | 危险废物鉴别标准浸出毒性鉴别[S]. GB5085.3-2007. |
 2013, Vol. 4
2013, Vol. 4

