| 废旧氢镍电池负极材料中稀土的资源化利用 |
我国已经成为电池生产与消费大国.由于氢镍电池有成本低、快充性能良好、循环寿命长、无记忆效应、无污染(不含铅、镉)、温度使用范围广泛、安全性能好等优点,其产量正稳步上升.预计到2020年,氢镍电池的国际电池市场占有率将达到29 %[1-2].按氢镍电池的平均使用寿命2年计,2010~2012年投入使用的氢镍电池至2015年报废,其总量超过10亿只.氢镍电池中含有30 %Ni、4 %Co和10 %左右的轻稀土,根据目前市场各种型号及其市场占有率的调查,氢镍电池平均单重约25 g,则这10亿只废氢镍电池含镍7500 t、钴1000 t和轻稀土2500 t.同时,由于其含有镍、钴等重金属,属于典型的危险固体废物,不允许在环境中任意弃置.因此,废旧氢镍电池等小型二次电池的回收与资源化处置已成为人们关注的焦点[3-4].
废旧氢镍电池中有价金属的回收利用自1993年氢镍电池的商品化以来就进行了研究.Zhang P W等[5-6]将氢镍电池正负级材料用盐酸浸出,萃取分离稀土、钴、镍后用草酸盐沉淀分别回收草酸稀土、草酸钴和草酸镍.Tzanetakis等[2, 7]用盐酸浸出氢镍电池中的稀土和镍、钴,用D2EHPA萃取分离稀土后用电解沉积的方法回收镍粉和钴粉.Wang R等[8]将失效的氢镍电池贮氢合金进行再生,其电化学性能可以得到恢复.Tenorio等[9]用选矿的方法从氢镍电池中回收镍基合金.这些回收方法主要针对镍的回收而未涉及稀土元素的回收.近年来,针对氢镍电池中稀土元素的回收,主要有两种方法,一是Zhang P W等将浸出的稀土在低pH值下用萃取的方法回收[5-6],二是徐丽阳[10]和Pietrelli L.等[11]研究的用硫酸浸出并用硫酸稀土复盐沉淀的方法回收稀土.
本文的工艺流程针对废旧镍氢电池负极回收稀土元素的同时,注重其中镍钴的回收.氢镍电池负极有不同的电极载体,市场常见的有镍网负极、铜网负极和钢带负极.对这3种负极的浸出进行比较.同时考虑到镍钴的回收采用浓缩结晶为硫酸镍、硫酸钴晶体,镍浓度过低将增加浓缩能耗,控制浸出液中镍的浓度100 g/L左右,设计一种新的稀土回收流程,考察浸出、萃取过程中各种因素对稀土回收和分离的影响.
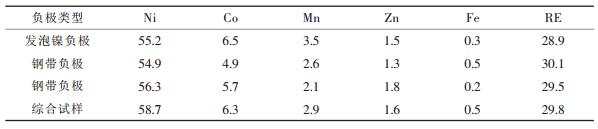
1 实验 1.1 实验原料氢镍电池的负极由负极活性物质储氢合金和作为电极载体的金属材料以及少量添加剂等组成.目前常用的电极载体有发泡镍、镀镍钢带和多孔铜网.实验采用的原料是某电池厂提供的氢镍电池负极边角料.其组分如表 1所示.
| 表1 试验原料的成分/wt% |
 |
| 点击放大 |
由表 1可见,3种负极材料的负极活性材料是基本一致的.经检测其中混合稀土的组成是相似的,主要为La (48 %~53 %),Ce (3 %~4 %),Pr (10 %~11 %),Nd (30 %~35 %),Sm (约1 %).负极材料中还加入了少量有机黏结剂使活性物质和添加剂粘结成型.
1.2 实验原理及方法 1.2.1 浸出氢镍电池负极废料的浸出剂主要有盐酸[2, 5]和硫酸[6, 10, 11].由于氢镍电池含有大量镍、钴,且镍、钴价值高,在回收稀土的同时必须考虑镍、钴的回收.本文选用硫酸为浸出剂.
由于硫酸稀土溶解度较小,浸出时如浓度过高将产生硫酸稀土沉淀.在稀土回收流程设计时,文献[6]、[11]采用较大液固比,使浸出液中稀土的浓度控制在2.5~3.5 g/L,不产生沉淀,稀土在后续萃取过程中回收,但此溶液中镍的浓度也很低,约20~30 g/L,镍、钴回收时废水多、能耗高;文献[10]采用的是加入硫酸钠将稀土转化为溶解度更小的硫酸稀土复盐沉淀,在浸出阶段实现稀土与镍、钴的分离.为使稀土沉淀完全,硫酸钠用量为理论量的3倍,这样将有大量的钠离子进入硫酸镍溶液.经计算,Ni2+浓度达100 g/L时,Na+浓度将超过20 g/L.Na+在后续硫酸镍净化的过程中无法去除,将严重影响硫酸镍结晶产品质量[12].本文利用硫酸稀土的溶解度小的特性,使大部分稀土以硫酸盐形式沉淀与镍、钴分离,不引入Na+.进入溶液的部分稀土,在后续萃取过程分离回收.
浸出后过滤分离浸出液和滤渣.滤渣主要为稀土硫酸盐沉淀和少量有机黏结剂,经碱转化后变为氢氧化稀土,再与滤液萃取分离中稀土反萃液的盐酸中和,得到氯化稀土,经过滤、浓缩后得到氯化稀土结晶产品.
1.2.2 溶剂萃取P507是稀土的优良萃取剂,有机相组成20 %P507+80 %煤油.浸出液的溶剂萃取实验在混合澄清槽中进行.实验用混合澄清槽混合室有效容积200 L,混合搅拌速度80 r/min,澄清室有效容积600 L,共30级,其原则槽模型图如图 1所示.
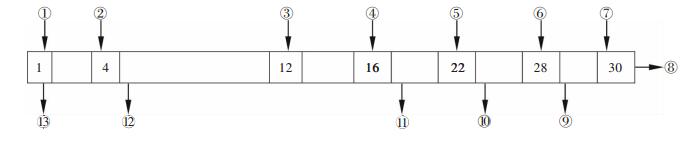 |
| 图 1 溶剂萃取实验槽模型图 |
1-4级:制镍皂;5-12级:萃取段;13-16级:洗涤段;17-22级:锌、锰反萃段;23-28级:稀土反萃段;29-30级:有机相纯水洗涤段.
各级进出口溶液分别为:
①有机相,组成为20 %P507+80 %煤油,氢氧化钠均相皂化率70 %;②硫酸镍溶液,pH=6,浓度约50g/L;③料液,即浸出液;④洗涤液,0.05 mol/L H2SO4;⑤Zn2+、Mn2+元素反萃剂,2 mol/L HCl;⑥稀土元素反萃剂,4 mol/L HCl;⑦有机相洗涤剂,纯水;⑧再生后的有机相出口,经过氢氧化钠均相皂化后返回使用;⑨有机相洗涤水出口;⑩稀土反萃液出口;⑪杂质Zn2+、Mn2+反萃剂出口;⑫萃余液出口,萃余液为硫酸镍和硫酸钴溶液,经进一步分离镍、钴后分别回收硫酸镍和硫酸钴;⑬镍皂水出口.
1.2.3 稀土的回收浸出时沉淀的硫酸稀土,经碱转化为氢氧化稀土.萃取时的稀土反萃液还含有相当高浓度的HCl,可用来中和氢氧化稀土得到氯化稀土.其反应为:
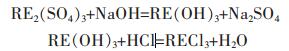
|
氯化稀土浓缩结晶,得到氯化稀土结晶产品.
1.3 分析方法稀土元素总量的测定采用GB/T14635.1-93(草酸盐重量法测定稀土总量),镧的测定采用XB/T606.4-95(镧量的测定),其他稀土元素的测定采用GB/T12690-90规定的方法[13].钴的常量分析用722型分光光度计,微量钴和水溶液中其他金属离子的含量用NITACHI Z-8230型原子吸收光谱,P507萃取后有机相中的元素分析用HCl反萃后测定,pH值用HM-30S型pH计测定.
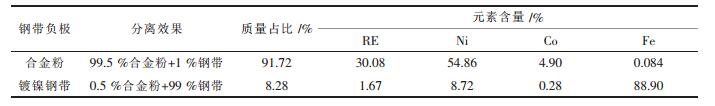
2 实验结果及讨论 2.1 废氢镍电池负极材料的浸出 2.1.1 钢带负极的机械分离浸出发泡镍负极时,其中发泡镍以金属状态存在,浸出后一并回收其中的镍.用硫酸浸出铜网负极时,多孔铜网不溶于稀硫酸,浸出后很容易分离.镀镍钢带负极的浸出,如不进行电极活性材料的剥离,会导致大量的Fe进入浸出液,增加后续工序除铁负担并影响萃取分离效果以及稀土和镍、钴的回收率.采用湿式滚动球磨的方式机械分离合金粉和钢带基体.实验结果如表 2所示.
| 表2 滚动球磨分离镀镍钢带负极分离效果 |
 |
| 点击放大 |
由表 2可见,钢带负极机械分离,合金粉的回收率达到99.5 %,有约1 %的钢带混入合金粉.分离出的镀镍钢带可于不锈钢生产另行回收.如不将钢带单独分离,在后续增加氧化沉铁造成的铁渣夹带,镍、钴、稀土等的回收率<98 %.
由于各种负极废料中的负极活性材料是一致的,下述实验中采用综合试样,其组成如表 1所示.
2.1.2 浸出温度的影响实验条件:H2SO4浓度1.5 mol/L,浸出时间4 h,控制液固比,使镍完全浸出时浓度在100 g/L左右.浸出温度对浸出效果的影响如表 3所示.
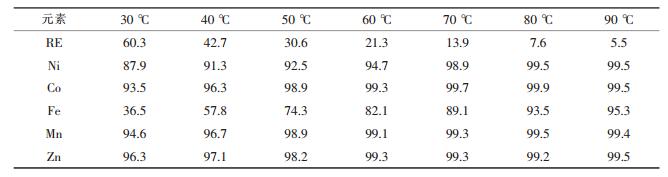
| 表3 不同温度下的浸出率/% |
 |
| 点击放大 |
由表 3可见,稀土元素由于生成稀土硫酸盐进入渣中,其浸出率随着温度的升高而降低,Mn、Zn的浸出率随温度变化不大,Ni、Co、Fe的浸出率随温度升高而升高,90 ℃时Ni、Co的浸出率可达99.5 %.不同温度下浸出液的组成如表 4所示.
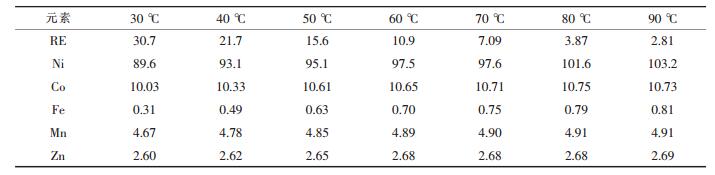
| 表4 不同温度下的浸出液成分/(g·L-1) |
 |
| 点击放大 |
由表 4可见,浸出液中稀土元素的含量随温度升高而降低,90 ℃时为2.81 g/L.废氢镍电池负极材料中所含的稀土元素主要是La、Ce、Pr、Nd等轻稀土,其硫酸盐的溶解度随温度升高而显著下降[14].实际浸出液中稀土的溶解度比计算值要小,尤其是在高温时,这种差别更加明显,这主要是因为溶液中的离子强度较大、硫酸根过量等同离子效应的影响.因此,浸出过程应控制温度在90 ℃以上,趁热过滤并用热水洗渣.浸出液为进入萃取流程用黄钠铁矾法除铁,控制铁含量小于50 mg/L,此时由于渣量少,稀土、镍、钴的回收率均>99.5 %.
2.2 萃取过程经浸出过程过滤分离后,有5.5 %的稀土与镍、钴等一起进入萃取过程,这部分稀土用萃取法回收.将Mn2+、Zn2+等杂质在反萃阶段分离,在回收稀土的同时净化硫酸镍、硫酸钴溶液,萃余液经镍、钴分离可回收硫酸镍和硫酸钴.
2.2.1 萃取分离稀土和镍、钴等元素硫酸介质中P507的萃取的pH值分别为[15]RE3+≈1,Fe3+1.2,Zn2+2.5,Mn2+3.5,Co2+4.2,Ni2+5.6.因此控制平衡pH值可实现稀土与其他元素的分离.经实验所用的8级分馏萃取后,pH值对各元素萃取率的影响如表 5所示.
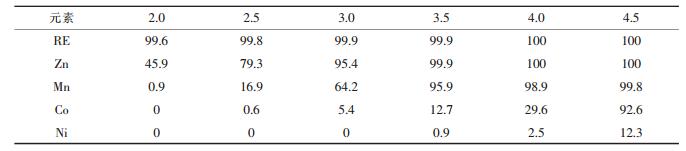
| 表5 pH值对各元素萃取率的影响/% |
 |
| 点击放大 |
由表 5可见,稀土元素在pH≥3.0时即可完全进入有机相,与钴、镍的萃取分离只需要不到4级的萃取,但为实现Mn2+与Co2+的有效分离,采用了8级萃取.控制平衡pH值在3.0~3.5时,稀土和Zn2+、Mn2+等一起完全进入有机相,Co2+的萃取<13 %,Ni2+的萃取<1 %.
2.2.2 稀土元素的反萃用4 mol/L HCl对稀土进行6级反萃.反萃液反萃稀土后及时添加盐酸,在维持酸度的情况下循环使用,使其中的稀土富集,稀土富集至溶液含RE=200~250 g/L时,更新反萃液.富集稀土的反萃液平均组成(g/L):RE 250,Zn2+6.32,Mn2+ 1.96,Fe3+0.68,稀土回收率99.5 %.
2.2.3 萃余液的回收从第5级澄清槽回收的是经过除杂的高品质硫酸镍、硫酸钴混合溶液.溶液平均组成(g/L):Ni2+98.04,Co2+10.20,Mn2+0.05,Zn2+<0.001,Fe3+<0.001,RE3+<0.001,Na+1.35由于在流程中控制了Na+的引进,该溶液经进一步镍、钴分离,分别浓缩结晶,可得优质硫酸镍和硫酸钴结晶.试验运行结果显示:镍、钴的回收率>99.0 %.考虑除铁过程,镍、钴的综合回收率约98.5 %.
2.3 稀土的回收浸出时沉淀的硫酸稀土沉淀,经碱转化为氢氧化稀土.稀土元素氢氧化物的溶度积非常低,La (OH)3、Ce (OH)3、Pr (OH)3、Nd (OH)3、Sm (OH)3的溶度积分别为1.0×10-19,1.5×10-20,2.7×10-20,1.9×10-21,6.8×10-22.加入理论量约1.1倍的NaOH可使转化完全.
萃取时的稀土反萃液还含有相当高浓度的HCl,补充适量的HCl,中和氢氧化稀土得到氯化稀土,控制氯化稀土的浓度250~300 g/L.洗涤过滤得到氯化稀土.由于硫酸稀土沉淀时夹杂了少量电池负极的有机黏结剂等杂质,过滤时形成少量夹带损失,稀土回收率99.0 %.氯化稀土加热浓缩至450~500 g/L,冷却结晶,得到氯化稀土结晶产品.无母液产生.
综上,该流程各步骤稀土的回收情况为:稀土元素94.5 %进入硫酸稀土沉淀,5.5 %进入溶液由萃取过程回收.在进入溶液的5.5 %份额中,稀土元素反萃回收率为99.5 %.而氯化稀土回收过程的回收率为99 %,稀土的综合回收率可达(94.5 %+5.5 %×99.5 %)×0.99=98.9 %.考虑镀镍钢带首先湿式球磨过程中有0.5 %的损耗,稀土的回收率为98.4 %.
3 结论(1)设计了综合回收氢镍电池负极材料中稀土元素并同时回收镍、钴的湿法冶金流程.回收的步骤包括:硫酸浸出负极,大部分稀土以硫酸稀土的形式与镍、钴分离,硫酸稀土经碱转化为氢氧化稀土;进入浸出液的稀土,用P507+煤油萃取与镍、钴分离,并同时将锌、锰等杂质与镍、钴分离;用HCl反萃稀土,反萃液与氢氧化稀土中和得到氯化稀土.
(2)镀镍钢带为载体的氢镍电池负极材料回收时,用湿式球磨的方法分离合金粉与钢带,发泡镍负极和铜网负极可直接回收.
(3)在回收稀土元素的同时,考虑氢镍电池负极材料中具有高回收价值的镍、钴的回收,浸出时控制液固比,使镍浓度达100 g/L左右,便于工业化回收;浸出条件为:H2SO4浓度1.5 mol/L,浸出时间4 h,温度95 ℃,此时,94.5 %的稀土进入硫酸稀土沉淀,Ni、Co的浸出率可达99.5 %.
(4)萃取时有机相为20 %P507+煤油,有机相采用镍皂,控制pH值为3.0~3.5,稀土完全进入有机相,反萃液为4 mol/LHCl,萃取阶段稀土的回收率为99.5 %.
(5)稀土的综合回收率为98.4 %,镍、钴的综合回收率为98.5 %.
| [1] | 《电池工业》编辑部. 中国电池工业协会专讯[J]. 电池工业, 2004, 9(2): 109–110. |
| [2] |
Tzanetakis N, Scott K. Recycling of nickel-metal hydride batteries: Dissolution and solvent extraction of metals[J].
J. Chemical Technology and Biotechnology, 2010, 79: 919–926. |
| [3] | 吴芳. 从废旧锂离子二次电池中回收钴和锂[J]. 中国有色金属学报, 2004, 14(4): 697–701. |
| [4] | 朱建新, 于波, 聂永丰, 等. 废旧镉镍电池再生利用技术述评[J]. 电池, 2001, 31(5): 248–250. |
| [5] |
Zhang P W, Yokoyama T, Itabashi O, et al. Hydrometallurgical process for recovery of metal values from spent nickel-metal hydride secondary batteries[J].
Hydrometallurgy, 1998, 50: 61–75. DOI: 10.1016/S0304-386X(98)00046-2. |
| [6] |
Zhang P W, Yokoyama T, Itabashi O, et al. Recovery of metal values form spent nickel-metal hydride rechargeable batteries[J].
J. Power Sources, 1999, 77: 116–122. DOI: 10.1016/S0378-7753(98)00182-7. |
| [7] |
Tzanetakis N, Scott K. Recycling of nickel-metal hydride batteries: Electrochemical deposition of cobalt and nickel[J].
J Chemical Technology and Biotechnology, 2004, 79: 927–934. DOI: 10.1002/(ISSN)1097-4660. |
| [8] |
Wang R, Yan J, Zhou Zh, et al. Regeneration of hydrogen storage alloy in spent nickel-metal hydride batteries[J].
Journal of Alloys and Compounds, 2002, 336: 237–241. DOI: 10.1016/S0925-8388(01)01862-X. |
| [9] |
Tenorio J A S, Espinosa D C R. Recovery of Ni-based alloys from spent NiMH batteries[J].
J. Power Sources, 2002, 108: 70–73. DOI: 10.1016/S0378-7753(02)00007-1. |
| [10] | 徐丽阳, 陈志传. 镍氢电池负极板中稀土的回收工艺研究[J]. 中国稀土学报, 2003, 21(1): 66–70. |
| [11] |
Pietrelli L, Bellomo B, Fontana D, et al. Rare earths recovery from NiMH spent batteries[J].
Hydrometallurgy, 2002, 66: 135–139. DOI: 10.1016/S0304-386X(02)00107-X. |
| [12] | 张黎鸣. 提高硫酸镍产品质量的实践[J]. 有色矿业, 1996(5): 38–40. |
| [13] | 朱玉华. 稀土标准总汇[M]. 北京: 冶金工业出版社 , 1995. |
| [14] | 徐光宪. 稀土[M]. 2版. 北京: 冶金工业出版社 , 2002. |
| [15] | 汪家鼎, 陈家镛. 溶剂萃取手册[M]. 北京: 化学工业出版社 , 2001. |
 2013, Vol. 4
2013, Vol. 4

