| 废料中有价金属离子铁、铜、镍的测定及浸出工艺研究 |
b. 江西理工大学, 资源与环境工程学院, 江西 赣州 341000
b. School of Resource and Environmental Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China
基于我国资源现状,一些矿物资源--如铁、铜、镍仍不能完全满足人们的需要[1].将废料中的有价金属离子回收利用也是缓解这一问题的关键[2].在一些矿石的开采、冶炼、电镀、皮革鞣制、印染等行业,每天排放出大量的污水及废料,这些废料若长期堆放,很容易使一些重金属渗入土壤及水体中,不仅会污染环境,还会对人与动植物的生命造成威胁[3].因此对废料资源化利用方面的研究就显得十分必要,废料的资源化利用一般包括制作玻璃、磁性材料、回收重金属[4]及塑料制品等, 其中以回收有价金属离子方面的报道据多.
一般情况下,对废料中金属离子的测定方法有多种,如化学分析方法,仪器分析方法等.运用一般的化学方法对废料中的金属离子进行测定,成本高、操作繁琐且分析时间长.紫外可见分光光度计操作简便、快速且准确度高,无论是在食品检测、矿物分析及其它行业的发展中都发挥着重要作用[5].X射线荧光光谱法广泛应用于矿石中元素的测定,不仅可以对固体、粉末样品进行分析测定,同时也可以测定液体样品.此方法分析速度快、处理简单且不会因待测元素灰化而造成损失,测定的准确率也非常高[6-8].废料中的铁、铜、镍离子在测定波长处的干扰离子对被测离子的干扰分析研究较少,这样干扰离子在金属离子最佳测定波长处的影响的研究显得十分必要.
对废料处理的方法有很多,一般会采用酸浸、碱浸、微生物浸出[9]、盐浸[10]、水浸出[11]等,但是针对我们所研究的废料中金属离子的种类,较为有效的方法是酸浸及氨浸[12-14].氨浸法的选择性好,但是氨水在浸出过程中容易挥发,影响浸出效果;酸浸相对于氨浸来说有以下优点:首先是浸出金属种类较多;另外在废料中加入酸之后,自身会产生大量的热,这会使酸浸效率大大提升,同时它也是在湿法冶金中广泛应用的方法之一.
实验中所采用的废料来源于镀铁、铜、镍的废水,而后又加入石灰等沉淀剂,将有价金属离子转变为难溶氢氧化物、碳酸盐或硫化物等, 成为电镀污泥[15].通过对电镀污泥性质及酸浸及氨浸优缺点的对比来分析,本实验适合用酸浸法对废料中的金属离子进行浸出,然后设定一系列影响因素,从而得出最佳的浸出条件,使有价金属离子的浸出率达到最佳.通过以上步骤,可使废料中的有价金属离子浸入到溶液中去,然后再采用沉淀法将这几种金属离子分步沉淀下来,从而得以回收.
1 有价金属离子铁、铜、镍测定方法 1.1 铁的测定(1)铁标准液配制.称取0.861 1 g FeNH4(SO4)2·12H2O于少量水中溶解,然后将其转移至100 mL容量瓶中,用蒸馏水定容.此时溶液中铁离子浓度为1.00 g/L(1 000 μg/mL)保存备用.将浓度1 000 μg/mL稀释10倍即达可达到标准浓度100 μg/mL.
(2)标准曲线绘制.分别取铁标准浓度(100 μg/mL)溶液0.00、0.40、0.60、0.80、1.00、2.00 mL于50 mL容量瓶中,用水稀释至15 mL左右,加入2.50 mL浓度为50 g/L盐酸羟胺溶液,摇匀.放置片刻,加1.00 mL浓度为50 g/L酒石酸溶液,5.00 mL浓度为2.5 g/L邻菲啰啉溶液,10.00 mL浓度为250 g/L乙酸钠溶液,用水定容.用1 cm吸收皿在510 nm波长处测量其吸光度,如图 1的所示.
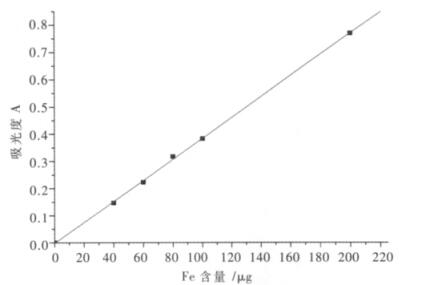 |
| 图 1 铁标准曲线 |
1.2 铜的测定
(1)铜标液的配制.称取0.390 1 g CuSO4·5H2O于少量水中溶解,将其转移至100 mL容量瓶中,用蒸馏水定容.此时溶液中铜离子浓度为1.00 g/L(1 000 μg/mL), 保存备用.在进行测定时,将浓度为1.00 g/L溶液稀释100倍,可达到标准浓度10 μg/mL.
(2)标准曲线的绘制.移取0.00、1.00、2.00、3.00、4.00、5.00 mL铜标准液,分别置于一组125 mL分液漏斗中,用蒸馏水稀释至40 mL左右,然后加入10.00 mL柠檬酸铵-EDTA混合溶液,2滴甲酚红指示剂,滴加氨水至溶液恰好变红色,再加入5.00 mL铜试剂溶液摇匀,准确加入10.00 mL四氯化碳,振荡1 min,静置分层后,有机相放入干燥的25 mL比色管中,再加入5.00 mL四氯化碳萃取一次,有机相合并,加0.50 g左右无水硫酸钠于比色管中,摇匀.用1 cm吸收皿,于435 nm波长处测定其吸光度, 结果如图 2所示.
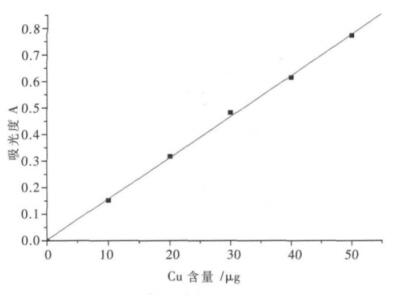 |
| 图 2 铜标准曲线 |
1.3 镍的测定
(1)镍标准液配制.称取0.447 9 gNiSO4·6H2O于少量水中溶解,将其转移至100 mL容量瓶中,用蒸馏水定容,此时溶液中镍离子1 g/L(1 000 μg/mL), 保存备用.将配好的溶液再稀释50倍可达到标准浓度20 μg/mL.
(2)标准曲线的绘制.分别吸取镍标准液0.00、2.00、3.00、4.00、5.00、6.00 mL于50 mL容量瓶中,用水稀释至15~20 mL.按顺序依次加入5.00 mL 500 g/L酒石酸钾钠溶液,5.00 mL 50 g/LNaOH溶液,5.00 mL 50 g/L过硫酸铵溶液,5.00 mL 10 g/L丁二酮肟溶液,静置15 min,用蒸馏水定容至刻度.用1 cm吸收皿,在500 nm波长处测定其吸光度,结果如图 3所示.
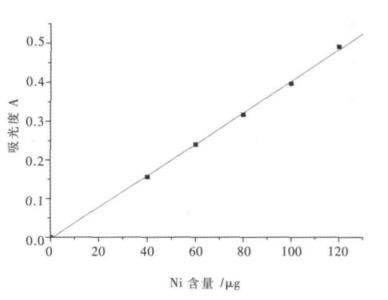 |
| 图 3 镍标准曲线 |
2 干扰离子因素分析
在样品中,主要探讨铁、铜、镍、铬4种金属离子相互干扰情况,以一种元素A为标准进行测定,可以确定最佳吸收波长,将另外3种金属离子作为干扰元素,配制成一定浓度的溶液,与A在相同的条件下进行测定分析.
2.1 干扰离子对铁离子的影响在pH值为2~9范围内,用盐酸羟胺将Fe (Ⅲ)还原为Fe (Ⅱ),与邻菲啰啉溶液反应生成稳定的红色络合物时,矿样中大量的金属元素对铁离子会有不同程度的影响,其中钛不干扰其测定,相当于含铁量40倍的钙、镁、硅、铝,20倍的铬、钒、锰,5倍的铜、钴、镍不干扰测定,若这些离子超过一定的倍数,就会对铁离子的测定有一定的影响,造成干扰.根据这一原理,现分别取铁标准溶液(100 μg/mL)1.00 mL,铜离子溶液(1 000 μg/mL)1.00 mL,镍离子溶液(1 000 μg/mL)1.00 mL,铬离子溶液(1 000 μg/mL)3.00 mL(相当于铜、镍干扰离子浓度是铁离子浓度的10倍;铬干扰离子浓度是铁离子浓度的30倍)于4个50 mL容量瓶中,用水稀释至15 mL左右,以下操作同1.1(2)分析步骤.然后用紫外-可见分光光度法来对这4个样进行分析测定,如图 4所示.
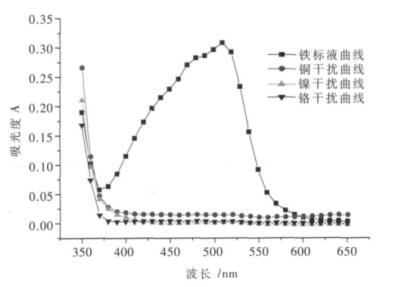 |
| 图 4 铁离子最佳波长的选择及干扰元素分析 |
由图 4可知,在对铁标准溶液进行测定时,发现在波长为510 nm处铁离子的吸光度达到最大;另外在同一实验条件下,当铜、镍干扰离子的浓度是铁离子浓度的10倍,铬干扰离子的浓度是铁离子浓度的30倍时,在510 nm波长处铜、镍、铬离子的吸光度基本趋于0,对它无任何干扰,因此就将铁的最佳波长设为510 nm.
2.2 干扰离子对铜离子的影响在微酸性或氨性溶液中,铜(Ⅱ)与铜试剂生成黄棕色络合物,然后用四氯化碳进行萃取.Fe(Ⅲ)在酸性或中性溶液中与铜试剂生成沉淀,溶于四氯化碳中呈棕色,但是在柠檬酸盐的氨性溶液中并不反应.钴、镍分别与铜试剂生成沉淀,溶于四氯化碳呈绿色和黄绿色且干扰测定,可加EDTA掩蔽消除干扰.根据此原理,分别取铜标准溶液(10 μg/mL)为1 mL,铁离子溶液(100 μg/mL)为1 mL,镍离子溶液(500 μg/mL)为1 mL,铬离子溶液(100 μg/mL)为1 mL(相当于铁、铬干扰离子浓度是铜离子浓度的10倍;镍干扰离子浓度是铜离子浓度的50倍)于4个125 mL分液漏斗中,用水稀释至40 mL左右,以下操作同1.2(2)分析步骤.然后用紫外-可见分光光度法来对这4个样进行分析测定,结果如图 5所示.
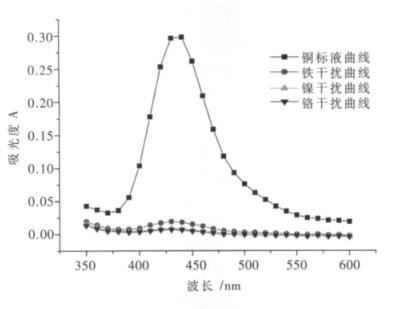 |
| 图 5 铜离子最佳波长的选择及干扰元素分析 |
由图 5可知,对铜标准溶液进行测定时,发现在波长为435 nm处铜离子的吸光度达到最大;在同一实验条件下,当铁、铬干扰离子的浓度是铜离子浓度的10倍,镍干扰离子的浓度是铜离子浓度的50倍时,在435 nm波长处镍、铬离子的吸光度基本趋于0,铁离子稍有一点点干扰,但是干扰不大,不影响整个测定结果,因此将铜的最佳波长设为435 nm.
2.3 干扰离子对镍离子的影响在有氧化剂存在的碱性介质中,镍与丁二酮肟生成可溶性酒红色络合物,显色溶液可稳定24 h.铁、铝在碱性溶液中形成氢氧化物沉淀,可用酒石酸掩蔽.Fe(Ⅲ)的酒石酸盐络合物呈黄色,在500 nm波长处吸收极弱,故应在500 nm波长处进行光度测定以消除铁的影响,在此测定条件下,20 mg的铁并无影响,铜、钴与丁二酮肟生成有色络合物,其量各为0.1 mg对测定无干扰.铬(Ⅲ)小于0.5 mg不影响测定.现分别取镍标准溶液(20 μg/mL)1.00 mL,铁离子溶液(1 000 μg/mL)1.00 mL,铜离子溶液(1 000 μg/mL)1.00 mL,铬离子溶液(1 000 μg/mL)1.00 mL(相当于铁、铜、铬干扰离子浓度是镍离子浓度的50倍)于4个50 mL容量瓶中,用水稀释至15~20 mL,以下操作按1.3(2)步骤操作,然后用紫外-可见分光光度法来对这4个样进行分析测定,结果如图 6所示.
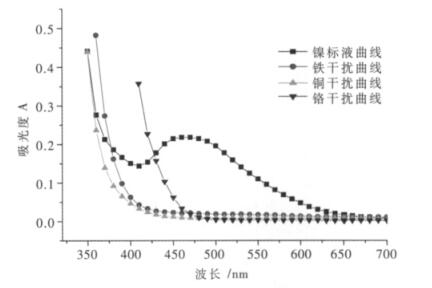 |
| 图 6 镍离子最佳波长的选择及干扰元素分析 |
在此实验中,取铁、铜、铬干扰离子的浓度都是镍离子的50倍情况下进行的.由图 6可知,当吸收峰达到475 nm时,镍离子的吸光度达到最大值,但是此时铬离子的干扰较大,不利用镍离子的测定,因此,将波长向后移,大约490~500 nm处,铬离子的吸光度基本上趋于0,其它离子也没有干扰,另外在500 nm波长处铁的吸收极弱,不会对镍离子的测定造成影响,将镍的吸收波长定为500 nm.
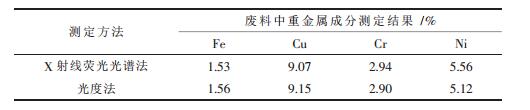
2.4 废料中铁、铜、镍、铬成分分析采用X射线荧光光谱法及光度法来对废料中的金属成分进行分析,结果如表 1所示.
| 表1 XRF与光度法测定废料中金属成分的对比 |
 |
| 点击放大 |
通过以上2种仪器所测的结果对比,可知,利用光度法测定的结果与X射线荧光光谱法所测的结果相符合,说明采用此方法对废料中有价金属离子铁、铜、镍测定是可行的.
3 对废料中有价金属离子浸出条件的选择 3.1 液固比对废料中有价金属离子浸出率影响试验称取10.00 g左右的废料,加入适量的硫酸进行浸出,在浸出时,控制不同的液固比(重量比),浸出时间为0.5 h,浸出温度为35 ℃.将滤液及滤渣转移至1 000 mL容量瓶中定容,直接取上清液1.00 mL用分光光度法来测定其中铁的含量;将此上清液再稀释10倍,取0.50 mL测定铜的含量;取1.00 mL用于镍离子的测定,从而得到最佳的液固比值,不同液固比与铁、铜、镍离子浸出浓度关系如图 7所示.
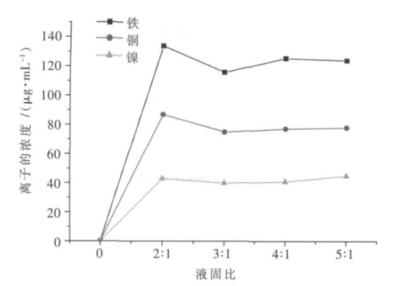 |
| 图 7 不同液固比与铁、铜、镍离子浸出浓度的关系 |
由图 7可知,发现在液固比为2:1时,这3种金属离子的浸出浓度基本上达到最大值,随着液固比的不断增大,这3种金属离子的浓度无明显的变化,这说明铁、铜、镍在此条件下的浸出率也达到最大,因此将液固比选定为2:1.由于所用原料较干,当控制液固比为1:1时,样品呈糊状,无法进行浸出,所以未设定液固比为1:1条件实验.
3.2 浸出时间对废料中有价金属离子浸出率影响试验称取10.00 g左右的废料,加入适量的硫酸,由3.1分析步骤可知,最佳液固比为2:1,浸出温度为35 ℃,在不同的浸出时间下,将浸出所得的滤液及滤渣转移至1 000 mL容量瓶中定容,直接取上清液1.00 mL用分光光度计来测定其中铁的含量;将上清液再稀释10倍,取0.50 mL测定铜的含量;取1.00 mL用于镍离子的测定,找出最佳浸出时间,不同浸出时间与铁、铜、镍离子浸出浓度关系如图 8所示.
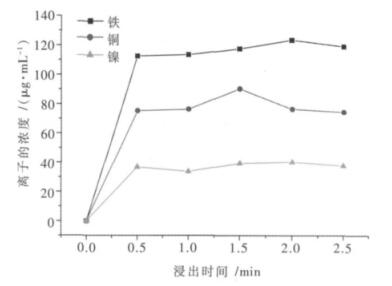 |
| 图 8 不同浸出时间与铁、铜、镍离子浸出浓度的关系 |
由图 8可知,铜的浸出浓度在1.5 h时达到最大,但是从1.0 h至1.5 h之间的浮动不是特别大;铁、镍这2种元素的浓度在0.5 h基本达到最大值,且随着时间的推移,它们的吸光度值基本不变,因此我们将最佳浸出时间定为0.5 h.
3.3 浸出温度对废料中有价金属离子浸出率影响试验现称取10.00 g左右的废料,加入适量的硫酸,控制最佳液固比为2:1(由3.1步骤可得),浸出时间为0.5 h(3.2步骤可得),在不同的浸出温度下,将浸出所得的滤液及滤渣转移至1 000 mL容量瓶中,直接取上清液1.00 mL用分光光度计来测定其中铁的含量;将上清液再稀释10倍,取0.50 mL测定铜的含量,取1.00 mL用于镍离子的测定,从而确定出最佳的浸出温度,不同浸出温度与铁、铜、镍离子浸出浓度关系如图 9所示.
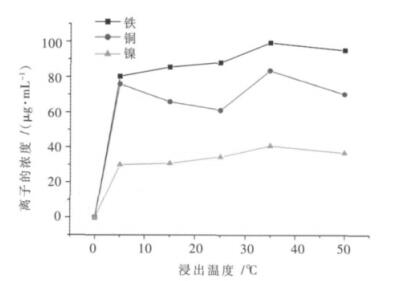 |
| 图 9 不同浸出温度与铁、铜、镍离子浸出浓度的关系 |
由图 9可知,铜离子受温度的影响较大,在5 ℃时浓度达到76.00 μg/mL,但是当温度达到25 ℃时,浓度的变化较大,变为61.20 μg/mL左右,而铁、镍的浓度值一直保持的较为稳定,所以最终将最佳的浸出温度值定为35 ℃.
3.4 硫酸用量对废料中有价金属离子浸出率影响试验由理论值计算可知,若处理1.00 g废料需要消耗0.24 mL的浓硫酸,本实验步骤讨论不同硫酸用量情况下废料中有价金属离子的浸出情况,现称取10.00 g左右的废料,加入不同量的浓硫酸,实验控制液固比为2:1(由3.1步骤可得),最佳浸出时间为0.5 h(由3.2步骤可得),最佳浸出温度为35 ℃(由3.3步骤可得),按照此实验条件进行浸出,将浸出所得的滤液及滤渣转移至1000 mL容量瓶中定容,直接取上清液1.00 mL用分光光度计来测定其中铁的含量;将上清液再稀释10倍,取0.50 mL测定铜的含量,取1.00 mL用于镍离子的测定,通过检测,可得知哪个加酸量下3种金属浸出率是最高的.
图 10是考察加酸量对铁、铜、镍浸出率的影响,通过理论值计算得知,要使1.00 g废料中的金属离子完全浸出,需要加入浓硫酸的量为0.24 mL,从图 10可看出,当加入硫酸的量为0.24 mL,3种金属离子的浸出率是很低的,随着酸量的加大,它们的浸出浓度值越来越大,但是变化量不大,因此将最佳加酸量定为0.5 mL/g废料.
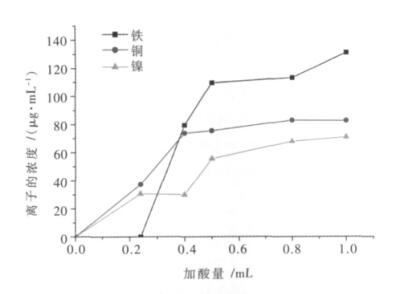 |
| 图 10 不同加酸量与铁、铜、镍离子浸出浓度的关系 |
3.5 浸出次数对废料中有价金属离子浸出率影响试验
通过实验研究废料中有价金属离子的最佳浸出条件为:液固比为2:1,浸出时间是0.5 h,浸出温度为35 ℃,硫酸加入量为0.5 mL/g废料,在此基础上,又研究了不同浸出次数对废料的影响.
(1)浸出一次的效果.现称取50.00 g左右的废料,按照以上最佳条件进行浸出,然后利用循环水泵对其抽滤,再用蒸馏水洗涤数次,从而使滤液及滤渣分离开来,得到滤液约200 mL左右,滤渣经干燥后约35.00 g.将所得的滤液转移至1 000 mL容量瓶中定容,取适量的溶液用紫外-可见分光光度计进行测定,通过计算可得到铁、铜、镍的浸出率.
(2)浸出二次的效果.将第1次浸出后剩余的滤渣(约35.00 g),再次按照3.5(1)实验步骤进行浸出,得到第2次浸出后铁、铜、镍的浸出率,两次对比结果如图 11.
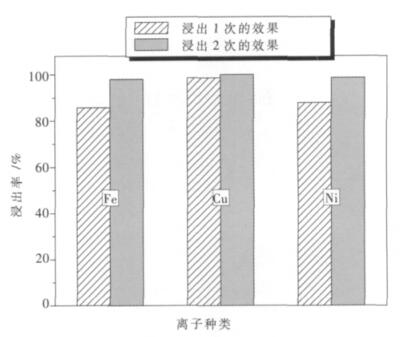 |
| 图 11 不同浸出次数与铁、铜、镍离子浸出率的关系 |
由图 11可知,在浸出一次的情况下,铁的浸出率为85.7 %,铜的浸出率可达98.5 %,镍的浸出率为87.8 %;对剩余的滤渣在同一浸出条件下浸出第2次时,3种金属离子的浸出率接近100 %,其中铁的浸出率为97.95 %,铜的浸出率可达99.97 %,镍的浸出率为98.51 %,由此发现,对废料大约进行两次浸出后,有价金属离子可以完全浸出.
4 结果讨论(1)利用紫外-可见分光光法对铁、铜、镍金属离子测定是较为准确、简便的方法,并应用此测定方法对废料有价金属铁、铜、镍离子进行了分析,测定结果与X射线荧光光谱法测定结果一致.
(2)对铁、铜、镍金属离子进行干扰元素分析,在最佳波长处,其他可能存在的干扰金属离子对此无明显干扰.
(3)在浸出实验中,得出最佳的浸出条件是:液固比2:1,浸出温度为35 ℃,浸出时间为0.5 h,硫酸加入量为0.5 mL/g废料.
(4)不同浸出次数对废料中金属离子浸出率的影响,浸出一次时,铁、镍的浸出率不是很高,分别为85.7 %和87.8 %,而铜的浸出率可达98.5 %;浸出2次后,3种金属离子的浸出率基本上接近100 %,其中铁的浸出率为97.95 %,铜的浸出率可达99.97 %,镍的浸出率为98.51 %,有价金属离子可以完全浸出.
| [1] | 胡宝兰, 许民才. 从含镍废料中提取高纯氧化镍新工艺研究[J]. 安徽化工, 2001, 27(5): 40–41. |
| [2] | 陈凡植, 陈庆邦, 陈淦康, 等. 从铜镍电镀污泥中回收金属铜和硫酸镍[J]. 化学工程, 2001, 29(4): 28–31. |
| [3] | 彭滨. 从电镀污泥中回收铜和镍[J]. 广东化工, 2005, 32(12): 59–60. |
| [4] |
Dutra A J B, Rocha G P, Pombo F R. Copper recovery and cyanide oxidation by electrowinning from a spent copper-cyanide electroplating electrolyte[J].
Journal of Hazardous Materials, 2008, 152: 648–655. DOI: 10.1016/j.jhazmat.2007.07.030. |
| [5] | 北京矿冶研究总院分析室. 矿石及有色金属分析手册[M]. 北京: 冶金工业出版社 , 1990: 12. |
| [6] | 廖海平. X射线荧光光谱法测定铁矿石中全铁及18个次量成分[J]. 冶金分析, 2011, 31(5): 36–40. |
| [7] | 李田义, 柯玲. 滤纸制样X射线荧光光谱法测定矿石中的多元素[J]. 岩矿测试, 2010, 29(1): 77–79. |
| [8] | 谷松海, 宋义, 郭芬. X-射线荧光光谱法同时测定铬矿中主次成分[J]. 冶金分析, 2008, 28(4): 16–19. |
| [9] | 吕飞龙, 李江. 微生物冶金在矿物开采中的应用进展[J]. 化学工程与装备, 2012(5): 131–133. |
| [10] | 汤海波, 曹普军, 肖培平, 等. 铬鞣废液的循环再利用[J]. 甘肃化工, 2003(4): 47–48. |
| [11] | 邱沙, 车小奎, 郑其, 等. 红土镍矿硫酸化焙烧-水浸实验研究[J]. 稀有金属, 2010, 34(3): 406–412. |
| [12] | 何炎庆, 张广柱. 从电镀污泥中回收有价金属的工艺探究[J]. 再生资源与循环经济, 2010, 3(8): 39–42. |
| [13] | 石太宏, 陈可. 电镀重金属污泥的无害化处置和资源化利用[J]. 污染防治技术, 2007, 20(2): 48–52. |
| [14] | 李盼盼, 彭昌盛. 电镀污泥中铜和镍的回收工艺研究[J]. 电镀与精饰, 2010, 32(1): 37–40. |
| [15] |
Kuchar D, Fukuta T, Onyango M S, et al. Sulfidation treatment of copper-containing plating sludge towards copper resource recovery[J].
Journal of Hazardous Materials, 2006, 138(1): 86–94. DOI: 10.1016/j.jhazmat.2006.05.037. |
 2012, Vol. 3
2012, Vol. 3


