| 从石煤酸浸液中萃取分离钒钼 |
2. 大唐华银怀化石煤综合利用筹建处,长沙 410083
2. Huaihua Stone Coal Comprehensive Utilization Programs of Datang Huayin Co., Changsha 410083, China
石煤是我国特有的一种低品位含钒矿物,国外还没有石煤利用方面相关研究的报道,石煤在我国主要作为提取五氧化二钒的原料.石煤中除含有钒外,还常伴生有少量的钼.钒和钼的性质相近,在石煤提钒矿物分解过程中钼也会被浸出到溶液中,对这部分钼作为副产品进行综合回收利用,既可降低钒的生产成本,又可提高资源综合利用率.
钼、钒在元素周期表中对角相邻,水溶液性质十分相似,难以分离[1].人们对水溶液中钼、钒分离进行了大量的研究,并开发了各种钼、钒分离的方法,其中包括:萃取分离法、硫化沉淀分离法和铵盐沉淀分离法[2].由于石煤浸出液中钼含量很低,采用硫化沉淀分离法和铵盐沉淀分离法不能有效的分离回收其中的钼,因此采用萃取法来富集和提取石煤酸浸出液中的钒和钼应是一种合理的选择.
周新花等[3]采用N263研究了石煤钠化焙烧浸出液中钒和钼的分离提取过程;沈明伟等[4]采用P507研究了石煤钠化焙烧浸出液中钒和钼分离行为.上述学者的研究都取得了不错效果,但由于钠化焙烧提钒污染大,目前国家已经禁止石煤钠化焙烧提钒技术的应用.
石煤提钒矿石分解过程方法有多种,但目前主要以酸浸出为主[5-6].已有很多学者研究了石煤酸浸液中钒的萃取规律及机理[7-10],但对于石煤酸浸液中钼的萃取研究则为空白.本文采用P204为萃取剂对石煤酸浸液中钒和钼的萃取分离进行了研究,以期为石煤中钼的提取利用提供一种可行的途径.
1 实验实验选用湖南某地石煤钒矿,其中V2O5含量为1.12 %,Mo含量为0.028 %.采用低温硫酸化焙烧-水浸出[11]的工艺制得pH值为1.0左右的钒钼混合液,其主要成分见表 1.
| 表1 浸出液主要成分/(g·L-1) |
 |
| 点击放大 |
从表 1中可以看出,酸性浸出液中钒和钼的浓度分别为V2O5 5.5 g/L和Mo 0.29 g/L,其他杂质主要为铁和铝.
采用溶剂萃取法分离回收酸浸出液中的钒和钼,萃取有机相组成为10 % P204+5 % TBP+85 %磺化煤油.实验过程所用的其他试剂都是分析纯试剂.
取萃取有机相放入125 mL分液漏斗中,按相比取调好pH值的水相放入漏斗中匀速振荡10 min,澄清数分钟后取萃余液分析其中的钒和钼含量,并计算萃取率;对负载有机相,取一定组成的反萃液重复上述操作,并计算反萃率.溶液中钒的分析采用硫酸亚铁铵还原滴定法,钼的分析采用硫氰酸盐比色法.
2 结果与讨论 2.1 溶液预处理P204能萃取Fe3+不萃取Fe2+,石煤低温硫酸化焙烧水浸液中存在一定量的Fe3+, 所以萃取之前要将浸出液中的Fe3+还原成Fe2+.本实验采用Na2S2O3为还原剂,为防止萃取过程中Fe2+的二次氧化,还原时控制浸出液氧化还原电位在-100 mV左右[12].
2.2 溶液初始pH值对钒和钼萃取率的影响在O/A (体积比)为1.2:1的条件下,考察不同溶液初始pH值对钒和钼萃取率的影响,结果如图 1所示.从图 1中可以看出,溶液初始pH对钒的萃取率影响比较大,随着pH值的变大,钒的萃取率快速增加,当pH值到达2.0之后,钒的萃取率到达84.1 %,随pH值进一步升高钒萃取率增加缓慢;而对钼的萃取来说,在实验范围内,pH的变化对钼的萃取率影响不大,当pH值为2.0时,萃取率为81.1 %.虽然pH的增大有利于钒的萃取,但随着pH值升高,Fe2+氧化速度加快,溶液的稳定性减弱,当溶液初始pH值达到2.5左右的时候,水相中析出絮状沉淀物,影响萃取的进行.
 |
| 图 1 pH对钒和钼萃取率的影响 |
在酸性介质中P204萃取钒和钼都是阳离子交换过程,其萃取反应方程式如下:

|
(1) |
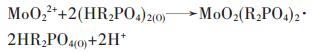
|
(2) |
式(1)、式(2)中R是C8H17.从式(1)和式(2)可以看出,溶液中H+浓度高,对钒和钼的萃取都是不利的. 图 1显示,pH的变化对钒的萃取率影响更大,主要是由于两方面原因导致的,一是P204对钼的萃取能力要比钒强,另一个原因是溶液中钒的含量要远远大于钼的含量.
2.3 钒的反萃实验所用有机相为小型逆流萃取装置制得的负载有机相,其钒浓度为4.97 g/L,钼浓度为0.31 g/L.对于负载有机相中钒的反萃,采用一定浓度的硫酸溶液进行的,其反应方程式如下:

|
(3) |
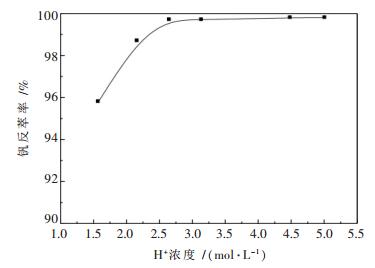
在O/A (体积比)为2:1的条件下,考察不同硫酸浓度对钒和钼反萃取率的影响,实验结果表明:即使采用H+浓度5 mol/L的硫酸溶液,反萃液中也检测不到钼的存在,所以图 2中只列出了H+浓度对钒反萃率的影响.
 |
| 图 2 H+浓度对钒反萃率的影响 |
从图 2中可以看出,随着硫酸浓度的增大,钒的反萃取率也在升高,当硫酸浓度为1.5 mol/L时,钒的反萃率可达99.7 %,继续增加硫酸浓度,钒的反萃取率变化不明显.从上述的实验结果可以看出,即使采用高浓度的酸也无法将钼反萃下来,而钒则比较容易被硫酸溶液反萃,这为钒和钼在反萃阶段实现分离提取提供了条件.
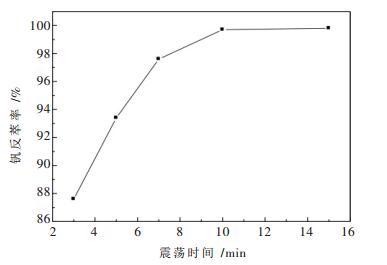
2.3.2 震荡时间的影响改变震荡时间,考察其对钒反萃率的影响,反萃采用的硫酸浓度为1.5 mol/L,试验结果见图 3.从图 3可以看出,在3~10 min范围内,随着震荡时间的延长,钒的反萃率快速变大,当震荡时间超过10 min后钒反萃率的变化不是很明显,所以最适宜的反萃时间为10 min.
 |
| 图 3 震荡时间对钒反萃率的影响 |
反萃液中V2O5含量为9.9 g/L,实际工业可以通过改变流比来提高反萃液中钒的含量.向反萃液中加入200 g/L的氯酸钠在60 ℃条件下氧化1 h,然后加入氨水调节溶液的pH到1.5在加热条件下水解沉钒,得到的沉淀物在530 ℃下焙烧4 h,得到含98.6 %V2O5的产品.
2.4 钼的反萃采用碳酸氢铵反萃钼,其反应方程式如下:
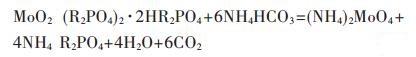
|
(4) |
图 4是在O/A (体积比)为3:1的条件下得到的碳酸氢铵浓度与钼反萃取率的关系.从图 4可以看出,随着碳酸氢铵浓度的增加,钼的反萃率迅速变大,当碳酸氢铵浓度为40 g/L的时候,钼的反萃率为64.9 %,当碳酸氢铵为60 g/L时,钼的反萃率为76.4 %,进一步增加碳酸氢铵浓度对钼反萃率的增加没有明显影响,甚至当碳酸氢铵达到140 g/L时,钼的反萃率还会有下降的趋势,这是因为有机相中除了钼之外还有铁,随着碳酸氢铵浓度的变大,铁也会被反萃,造成分相困难从而导致水相中钼的损失.综合考虑,最佳的反萃取剂浓度为NH4HCO3 60 g/L.
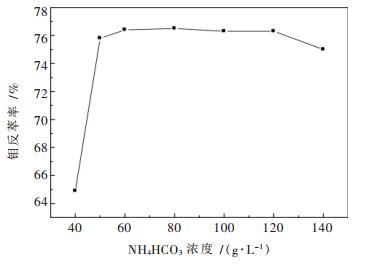 |
| 图 4 碳酸氢铵浓度对钼反萃率的影响 |
2.4.2 相比的影响
由于石煤酸浸出液中钼的浓度低,所以希望反萃液中钼浓度尽可能的高,这样才有利于后续钼的提取,而提高反萃液中钼浓度的一个有效方法就是增加反萃过程的相比. 图 5是NH4HCO3 60 g/L条件下,反萃相比与钼反萃率的关系.从图 5中可以看出,相比由2:1到3:1的时候钼的反萃率变化不大,随着相比的进一步变大,钼的反萃率快速降低;虽然增加相比可以提高反萃液中钼的浓度,但是相比太大对钼的反萃不利,综合考虑以相比3:1为宜.
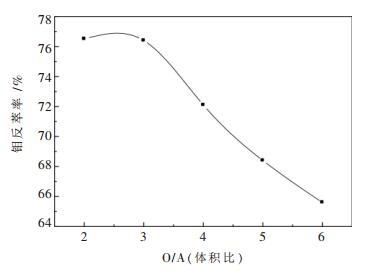 |
| 图 5 相比对钼反萃率的影响 |
反萃液中钼的浓度比较低,只有0.45~0.75 g/L,实际工业过程除了通过调整流比或者回流反萃来提高反萃液中钼含量外,还需要通过进一步的富集来回收钼,对于碱性体系中钼的富集可以通过离子交换来实现[13].
3 结论(1)采用10 %P204+5 %TBP+85 %磺化煤油体系,在O/A (体积比)为1.2:1,初始溶液pH值2.0条件下,钒和钼的单级萃取率分别为84.1%和81.1 %;
(2)采用1.5 mol/L的硫酸溶液反萃负载钒和钼的有机相,钒的反萃率可以达到99 %以上,钼不能被反萃,从而可以实现钒和钼的分离;
(3)在O/A (体积比)为3:1的条件下采用60 g/L的碳酸氢铵溶液可以将钼反萃,其反萃率为76.4 %.
| [1] |
HU Jian, WANG Xue-wen, XIAO Lian-sheng, et al. Removal of vanadium from molybdate solution by ion exchange[J].
Hydrometallurgy, 2009, 95: 203–206. DOI: 10.1016/j.hydromet.2008.05.051. |
| [2] | 施友富, 王海北. 废催化剂中钼和钒的分离[J]. 中国钼业, 2004, 28(2): 39–41. |
| [3] | 周新花, 郑洁修, 马玉龙. 溶剂萃取法从含钒水浸溶液中分离钒和钼[J]. 武汉大学学报:自然科学版, 1991(4): 83–88. |
| [4] | 沈明伟, 朱昌洛, 李华伦. P507-煤油体系在钒钼萃取分离中的试验研究[J]. 矿产综合利用, 2007(4): 14–18. |
| [5] | 王明玉, 王学文. 石煤提钒浸出过程研究现状与展望[J]. 稀有金属, 2010, 34(1): 90–97. |
| [6] | 王学文, 王明玉. 石煤提钒工艺现状及发展趋势[J]. 钢铁钒钛, 2012, 33(1): 8–14. |
| [7] | 李晓健. 酸浸-萃取工艺在石煤提钒工业中的设计与应用[J]. 湖南有色金属, 2000, 16(3): 21–23. |
| [8] | 胡建锋, 朱云. P204萃取硫酸体系中钒的性能研究[J]. 稀有金属, 2007, 31(3): 367–370. |
| [9] |
WANG Ming-yu, ZHANG Gui-qing, WANG Xue-wen, et al. Solvent extraction of vanadium from sulfuric acid solution[J].
Rare Metals, 2009, 28(3): 209–211. DOI: 10.1007/s12598-009-0041-3. |
| [10] |
LI Xing-bin, WEI Chang, DENG Zhi-gan. Selective solvent extraction of vanadium over iron from a stone coal/black shale acid leach solution by D2EHPA/TBP[J].
Hydrometallurgy, 2011, 105: 359–363. DOI: 10.1016/j.hydromet.2010.10.006. |
| [11] | 刘万里, 王学文, 王明玉, 等. 石煤提钒低温硫酸化焙烧矿物分解工艺[J]. 中国有色金属学报, 2009, 19(5): 943–948. |
| [12] | 鲁兆伶. 用酸法从石煤中提取五氧化二钒的试验研究与工业实践[J]. 湿法冶金, 2002, 21(4): 175–183. |
| [13] |
WANG Ming-yu, WANG Xue-wen, LIU Wan-li. A novel technology of molybdenum extraction from low grade Ni-Mo ore[J].
Hydrometallurgy, 2009, 97: 126–130. DOI: 10.1016/j.hydromet.2008.12.004. |
 2012, Vol. 3
2012, Vol. 3

