1.
中南大学冶金科学与工程学院,长沙 410017;
2.
国家重金属污染防治工程技术研究中心,长沙 410017
基金项目:国家杰出青年科学基金(50925417);国家自然科学基金重点项目(50830301)
收稿日期:2012-08-06
1.
School of Metallurgical Science and Engineering, Central South University, Changsha 410017, China;
2.
National Engineering Research Center for Pollution Control of Heavy Metals, Changsha 410017, China
有色金属冶炼与加工过程中会产生大量的工业废水,这些废水中含有大量的重金属离子,如铜、锌、铅、镉等[1].据第1次全国污染源普查公报显示,全国工业废水中每年排放的重金属总量高达900 t,数量如此巨大的重金属进入自然水体不仅严重污染了生态环境,给人类健康造成了威胁,而且也造成了资源的极大浪费[2].随着人们对环保要求的日益提高,水质排放标准和质量标准日益严格[3],给重金属污染的治理提出了更高的要求.
针对重金属废水的处理国内外的研究者进行了大量的研究[4-5],但在工业上应用最为广泛的仍然是化学沉淀法[6],常规的石灰中和沉淀法无法满足现在严格的水质标准,硫化沉淀法因硫离子能够与金属离子形成较低溶度积的金属硫化物[7],而能将重金属离子处理到较低浓度,再加上该法具有渣量少,易脱水,渣金属品位高等优点,在工业上得到了广泛应用.尤其是近几年来,硫化沉淀法已经不仅仅局限于处理单一重金属废水,对于多金属废水体系也卓有成效.日本H.Tokuda等[8]就利用不同金属硫化物溶度积的差异,通过改变溶液pH值实现了Cu-Zn-Ni以及Sn-Zn废水体系的选择性沉淀,达到回收重金属的目的.波兰也有学者[9]通过相似的方法实现了Cu与Co-Ni体系的分离,但是对多金属废水体系的理论研究没有做详细的说明.本文在理论分析的基础上结合实验验证对多金属体系进行了详细的研究.
针对有色行业重金属废水中常涉及到的4种重金属离子Cu2+、Pb2+、Zn2+、Cd2+,为探求硫化沉淀法选择性分离Cu-Zn-Pb-Cd多金属废水体系的最佳pH值,本研究全面考虑了这4种重金属离子水解过程中生成的羟合配离子对硫化平衡的影响[10].引入了配位化学[11]和水化学[12]的相关概念,绘制了S-H2O体系中各含硫物种的离子分率αn-pH图,Me(II)-S-H2O体系中各种可溶形态的重金属浓度pMe-pH图,并以实验进行验证.
1 热力学分析
1.1 S(Ⅱ)-H2O系热力学平衡
在含硫水溶液中,含有的组分为:[H+]、[OH-]、[H2S]、[HS-]、[S2-].此体系的总浓度方程为:
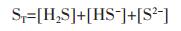
|
(1) |
H2S在水溶液中的逐级电离常数[13-14]分别为:
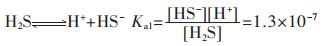
|
(2) |
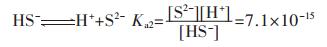
|
(3) |
由式(2)可得:
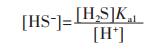
|
(4) |
由式(3)可得:
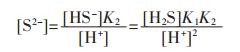
|
(5) |
联立式(1)、式(4)、式(5),得:

|
(6) |

|
(7) |
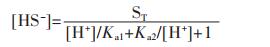
|
(8) |
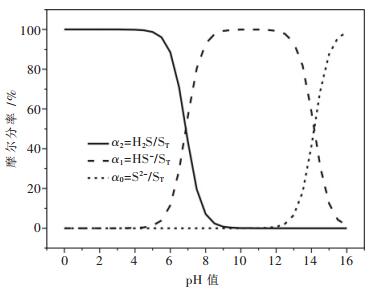
令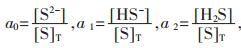 , 由此可得到S(Ⅱ)-H2O体系中各含硫物种的摩尔分率与pH的关系,如图 1所示.
, 由此可得到S(Ⅱ)-H2O体系中各含硫物种的摩尔分率与pH的关系,如图 1所示.
由图 1可知,当pH < 5时,溶液中硫主要以H2S的形式存在,基本没有S2-的存在.当pH在5~12之间时,溶液中S2-的含量也很低,当pH=12时,S2-的含量仅为0.70 %.当pH>12.5时,溶液中逐渐出现S2-,并随pH值的增大而逐渐升高,当pH值达到16时,溶液中S2-为主要存在形式,其含量达到98.61 %.S(Ⅱ)-H2O体系αn-pH图的绘制能为Me(Ⅱ)-S-H2O体系的热力学分析提供强有力的理论基础.
1.2 Me(Cu、Pb、Zn、Cd)-S-H2O系热力学平衡
1.2.1 pH值对Cu2+、Pb2+、Zn2+、Cd2+羟基配位平衡的影响
各重金属离子在水溶液中会发生水解反应,形成多种羟基型配合物.在含铜溶液中,主要有Cu(OH)+、Cu(OH)2、Cu(OH)3-、Cu(OH)42- 4种配合物,在298.15 K条件下逐级累积稳定常数如下[15]:
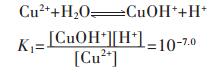
|
(9) |
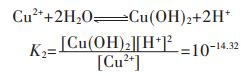
|
(10) |
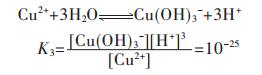
|
(11) |
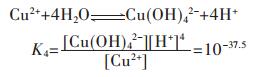
|
(12) |
由式(9)可得:
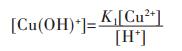
|
(13) |
同理,由式(10)~式(12),可分别得到式(14)~式(16)
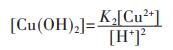
|
(14) |
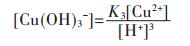
|
(15) |
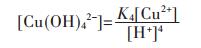
|
(16) |
因此,在水溶液体系中,铜的总量可定义为:
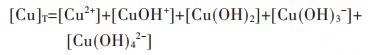
|
(17) |
将式(17)两边同除以[Cu2+],结合式(13)~式(16)可变形为:
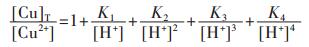
|
(18) |
同理,在含铅水溶液中,主要有PbOH+、Pb(OH)2、Pb(OH)3-、Pb2OH3+、Pb4(OH)44+、Pb6(OH)84+ 6种配离子存在,在298.15 K条件下逐级累积稳定常数分别为:
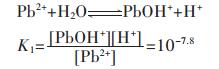
|
(19) |
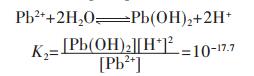
|
(20) |
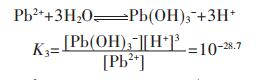
|
(21) |
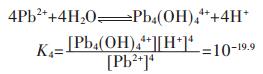
|
(22) |
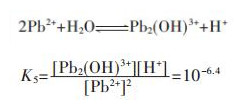
|
(23) |
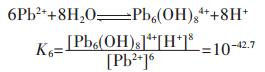
|
(24) |
因此,在水溶液体系中,铅的总量可表示为:
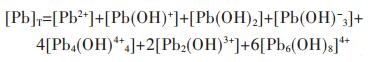
|
(25) |
结合式(19)~式(24),将式(25)右边用[Pb2+]表达,得:
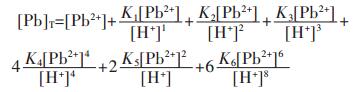
|
(26) |
在含锌水溶液中,主要有ZnOH+、Zn(OH)2、Zn(OH)3-、Zn(OH)42- 4种配离子存在.在298.15 K条件下逐级累积稳定常数分别为:
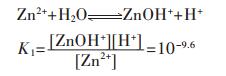
|
(27) |
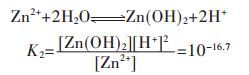
|
(28) |
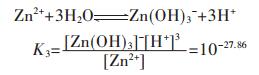
|
(29) |
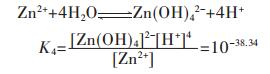
|
(30) |
因此,在水溶液体系中,锌的总量可表示为:
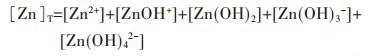
|
(31) |
将式(31)两边同除以[Zn2+],得
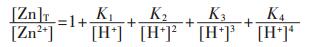
|
(32) |
在含镉水溶液中,主要有CdOH+、Cd(OH)2、Cd(OH)3-、Cd(OH)42- 4种配离子存在,在298.15 K条件下逐级累积稳定常数分别为:
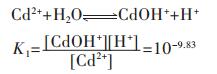
|
(33) |
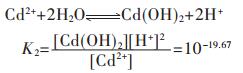
|
(34) |
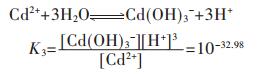
|
(35) |
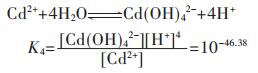
|
(36) |
因此,在水溶液体系中,镉的总量可表示为:
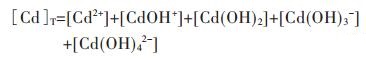
|
(37) |
将式(37)两边同除以[Cd2+],得
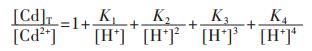
|
(38) |
1.2.2 MeS(s)(CuS、PbS、ZnS、CdS)溶解平衡与pH值的关系
当体系中引入S2-时, Cu2+将优先与S2-结合成CuS沉淀,其溶解平衡反应式为:
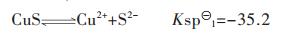
|
(39) |
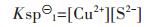
|
(40) |
将式(6)和式(18)代入到式(40)得:

|
(41) |
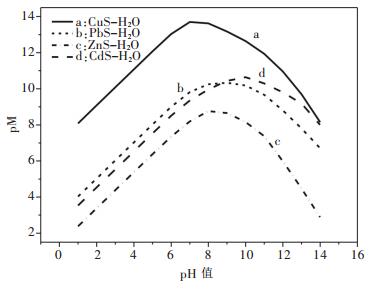
假设CuS按化学计量溶解平衡,故[Cu]T=[S]T[16],由式(41)求解[Cu]T或[S]T与pH值的关系,以溶液pH值为横坐标,以Cu2+的负对数为纵坐标,用pCu表示,绘图可得到图 2(a).
同理,PbS溶度积常数为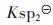 =[Pb2+][S2-]=8.0×10-28,并结合式(6)和式(26)可得:
=[Pb2+][S2-]=8.0×10-28,并结合式(6)和式(26)可得:
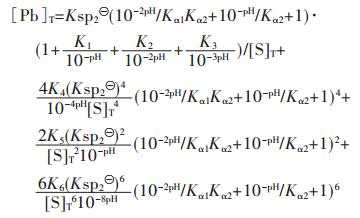
|
(42) |
假设PbS按化学计量溶解平衡,故[Pb]T=[S]T,由式(42)求解[Pb]T[17]或[S]T与pH值的关系,以溶液pH值为横坐标,以Pb2+的负对数为纵坐标,用pPb表示,绘图可得到图 2(b).
ZnS溶度积常数为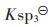 =[Zn2+][S2-]=1.6×10-24,并合并式(6)和式(32)到
=[Zn2+][S2-]=1.6×10-24,并合并式(6)和式(32)到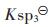 苓中,可得:
苓中,可得:
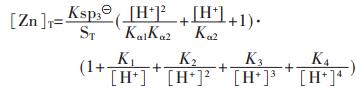
|
(43) |
假设ZnS按化学计量溶解平衡,故[Zn]T=[S]T,由式(43)求解[Zn]T或[S]T与pH值的关系,以溶液pH值为横坐标,以Zn2+的负对数为纵坐标,用pZn表示,绘图可得到图 2(c).
CdS溶度积常数为 =[Cd2+][S2-]=7.9×10-27,按相同的处理方法,可得:
=[Cd2+][S2-]=7.9×10-27,按相同的处理方法,可得:
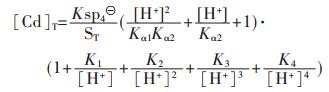
|
(44) |
假设CdS按化学计量溶解平衡,故[Cd]T=[S]T,由式(44)求解[Cd]T或[S]T与pH值的关系,以溶液pH值为横坐标,以Cd2+的负对数为纵坐标,用pCd表示,绘图可得到图 2(d).
图 2表明了CuS、PbS、ZnS、CdS的溶解平衡与pH的关系.由图 2可知,随着pH的增大,4种金属硫化物溶解度均表现出连续不断的降低,并出现最小溶解度.当pH值达到一定值后,硫化物的溶解度反而随pH的增大而增加.呈现这种规律的原因是当溶液中的pH值达到一定值时,溶液中少量的S2-离子就会和重金属形成多硫配合离子,从而影响了金属硫化物沉淀的生成.4种金属离子的最低溶解度及相应的最小溶解度的pH值分别为:CuS在pH值为7.75时出现最小溶解度, 其值为1.733×10-14 mol/L;PbS沉淀的最佳pH值为8.87,得到最小溶解度为4.16×10-11 mol/L;ZnS和CdS达到最小溶解度的最佳pH值分别为8.36及9.83,相应的溶解度分别为1.463×10-9 mol/L及1.016×10-8 mol/L.
2 实验验证
2.1 主要仪器及试剂
主要仪器:PHS-3C精密pH计;AUY220型电子分析天平;磁力加热搅拌器;离心机;原子吸收测定仪;蠕动泵.
主要试剂:CuSO4·5H2O(分析纯);ZnSO4·
7H2O(分析纯);Pb(NO3)2(分析纯);CdCl2·5/2H2O
(分析纯);Na2S·9H2O(分析纯);NaOH(优级纯);超纯水(电导率为5.47×10-4 S/m);浓HCl;98 %浓H2SO4.
2.2 试验方法
实验自行配制重金属废水,其浓度与株洲冶炼集团产生的废水相当,即废水中Cu、Pb、Zn、Cd的含量分别为50 mg/L、50 mg/L、150 mg/L、10 mg/L,采用不同浓度的NaOH和H2SO4对其进行pH调节,Na2S投加量摩尔比为1:1.实验在500 mL烧杯中进行,采用六联磁力搅拌器对其进行搅拌,反应40 min后,水样经离心过滤,通过0.2 μm的膜过滤,滤液经过0.1M HNO3酸化,保存在4 ℃下,采用原子吸收光谱仪[18]分析溶液中残留的重金属浓度.
2.3 结果与讨论
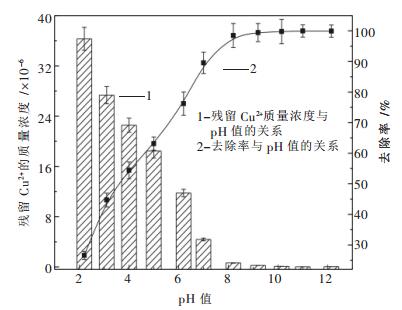
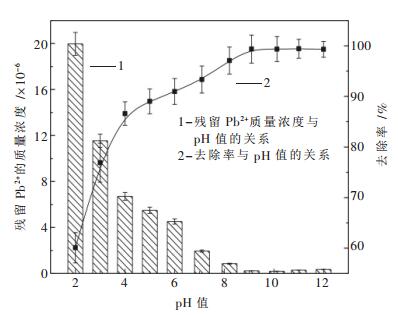
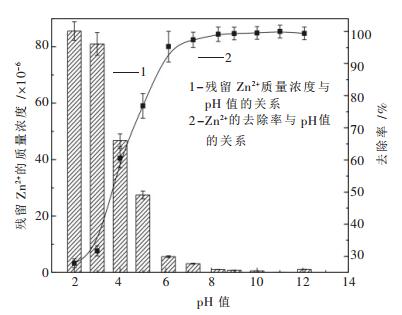
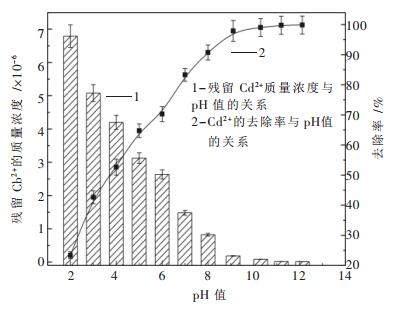
pH值对Cu2+、Pb2+、Zn2+、Cd2+的脱除效果的影响如图 3~图 6所示.
图 3~图 6表明了Na2S去除Cu2+、Pb2+、Zn2+、Cd2+的实验结果.由图 3~图 6可知,随着溶液pH值的不断增加,溶液中的金属离子逐渐降低,当pH值增加到一定值后,这4种金属离子浓度达到最低.由图 3可知,当pH=8.2时,溶液中含铜量最低,其去除率高达99.44 %.由图 4可知,当pH=8.7时,溶液中含铅量最低,其去除率高达99.304 %.由图 5可知,当pH=8.3时,溶液中含锌量最低,其去除率高达99.132 %.由图 6可知,当pH=10.3时,溶液中含镉量最低,其去除率高达99.03 %.这4种金属脱除的最佳pH值与理论计算得到的最佳pH值(Cu为7.75,Pb为8.87,Zn为8.36,Cd为9.83)比较相符.
另外,由图 3~图 6不难看出,硫化钠沉淀法处理Cu2+、Pb2+、Zn2+、Cd2+的最佳pH值为碱性条件,而图 1显示该pH范围内S-H2O体系中S的存在形式几乎为HS-,可见引入重金属离子时,S离子会优先与金属离子结合生成沉淀,从而加速了HS-的电离.
当pH值分别达到一定值后,这4种金属离子去除率均达到了99 %以上,继续增加溶液pH值,其去除率基本保持不变,这与理论计算所得结论即超过最佳pH值后硫化物溶解度会降低不太相符.出现这种现象的原因有以下两种推测:一是随着pH的不断增加,溶液中会产生少量的氢氧化物沉淀,该沉淀物与部分反溶的金属硫化物发生共沉淀反应;二是溶液中少量游离的金属离子穿插进入硫化物晶格空隙内,形成了较复杂的多硫化物沉淀.总之,反应中生成的沉淀只是从一种形态转化成了另一种形态,并不影响溶液中的残留重金属离子的浓度.
3 结论
(1) S-H2O体系各含硫物种的离子分率αn-pH图表明,当pH>12.5时,溶液中逐渐出现S2-,pH达到16以上时,溶液中的S主要以S2-的形式存在,其离子分率达到了98.61 %.
(2)在Cu-S-H2O、Pb-S-H2O、Zn-S-H2O、Cd-SH2O系的硫化平衡的理论研究中,pM-pH图描述了CuS、PbS、ZnS、CdS溶解平衡时,铜、铅、锌、镉的总离子平衡浓度与pH的关系.当pH为7.75时,CuS的溶解度最小;pH为8.87时,PbS的溶解度最小;pH为8.36时,ZnS的溶解度最小;pH为9.83时,CdS的溶解度最小.
(3)通过实验验证,在一定的金属浓度下,M/S摩尔比为1:1时,溶液pH分别控制在8.2、8.7、8.3、10.3时,溶液中M2+浓度达到最小值.理论计算与实验数据比较相符,所得结论能为硫化沉淀法净化分离重金属废水提供一定的理论参考依据.
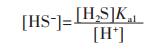
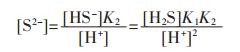


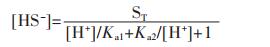
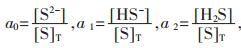
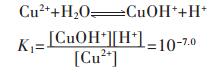
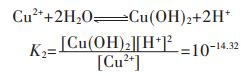
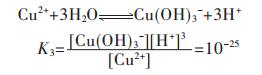
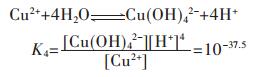
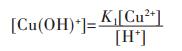
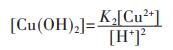
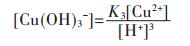
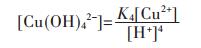
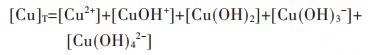
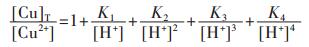
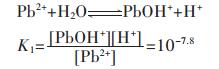
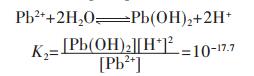
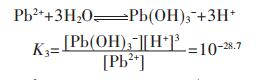
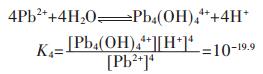
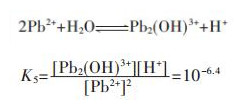
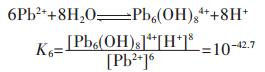
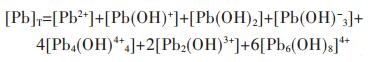
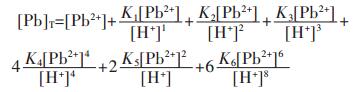
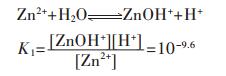
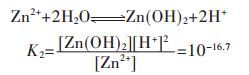
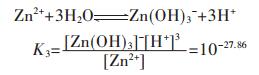
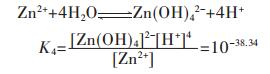
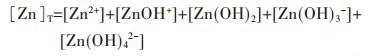
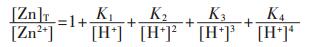
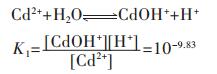
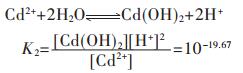
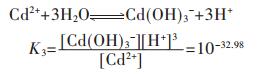
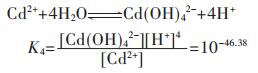
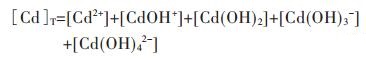
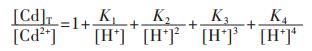
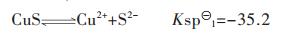
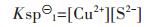

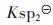
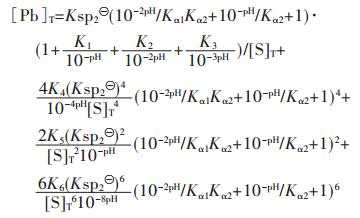
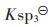
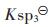
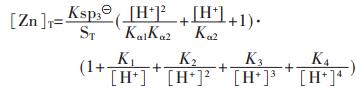

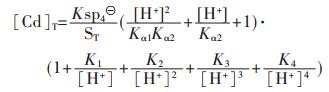
 2012, Vol. 3
2012, Vol. 3

