| 溶剂热制备球状ZnS 纳米光催化剂及其光催化性能 |
2. 福州大学,福建省光催化重点实验室-省部共建国家重点实验室培育基地,福州350002
2. Fujian Provincial Key Laboratory of Photocatalysis-State Key Laboratory Breeding Base , Fuzhou University, Fuzhou 350002, China
利用纳米半导体光催化降解有机污染物具有效率高、能耗低、反应条件温和、适用范围广和可减少二次污染等优点,因此引起越来越多的研究者的重视[1-12].ZnS 是一种II-VI 族化合物直接带隙半导体材料,禁带宽度为3.6~3.8 eV,为一种应用广泛的半导体光学和光电材料,主要用作光致发光[13]、电致发光[14]、磷光体[15]、传感器[16]、红外窗口等材料[17].近期研究发现它具有较好的光催化性能[18-19].其光催化性能主要取决于它的结构和制备方法.溶剂热是近年来发展制备纳米材料的一种软化学合成方法,在溶剂热条件下,反应溶剂处于临界状态,反应物质在溶剂中其物性与化学反应性能发生极大变化,有利于某些化学反应和半导体晶化的进行,近年来在光催化材料的低温合成中受到重视[20-22],是一种绿色化学合成方法.如我们报道了以苯甲醇为溶剂低温合成了通常需要1000 ℃才能合成的微米级CuInS2四方体、以聚乙二醇合成粒径大小可控的磁性纳米Fe3O4和以苯甲醇合成ZnO 纳米晶等.本文首次以乙二醇为反应介质,在溶剂热的条件下制备了ZnS 光催化剂,并分别考察了溶剂热的反应温度、时间对ZnS 的物理结构和光催化性能的影响.
1 实验部分 1.1 样品合成准确称取15 mmol 二水合醋酸锌(Zn(CH3COO)2·2H2O,AR)和15 mmol 硫脲((NH2)2CS,AR)溶于25 mL乙二醇(AR)中,磁力搅拌2 h 至样品完全溶解后转入不锈钢水热釜,于不同温度(100~180 ℃)和不同反应时间(8~28 h)进行处理,冷却,过滤,用无水乙醇和去离子水洗涤数次,80 ℃恒温干燥,得到一系列ZnS光催化剂.
1.2 催化剂表征BET 比表面积测试在美国Quantachrome Instru鄄ments 公司生产的NOVA 4000 型自动物理吸附仪上进行.测试前,样品首先在100 ℃的真空下脱气处理1 h, 然后以N2为吸附质在77 K 下恒温吸附.比表面积通过BET 方程求得.样品的X 射线粉末衍射(XRD)表征在德国Bruker D8 型X 射线衍射仪(Cu Kα λ=0.154178 nm)上进行.电压40 kV,电流40 mA,扫描速率5 °/min, 扫描范围10°~80°.用XL30 扫描电子显微镜(SEM)(荷兰飞利浦)观察样品整理形貌.紫外可见漫反射光谱(UV-vis)在UV-2550 型(日本岛津)紫外可见分光光度计上获得,以BaSO4做参照.室温下,利用Perkin ElmerLS55(美国)型荧光光谱仪测试样品的荧光发射光谱(PL),以390 nm 激光做激发光源.
1.3 光催化活性测试光催化反应在自制光催化反应器中进行,光源为7 W,254 nm 的紫外灯.在光催化反应中,染料的初始浓度为20 mg/L,溶液体积为80 mL,催化剂用量为50 mg.在光催化反应开始前,先于暗处搅拌吸附40 min 达到物理吸附和脱附平衡后打开光源.每一小时取样3 mL,离心分离,用岛津UV-2550 型紫外可见分光光度计测定上层清液的吸光值.根据吸光值的变化求得染料的降解率,即降解率:D=(A0-A)/A0×100 %(其中A0为初始吸光度值,A 为降解后的吸光度值).
2 结果与讨论 2.1 N2物理吸附(BET)分析表 1给出了在不同温度和时间下合成的样品的比表面积值.由表 1 可以看出,反应温度和时间对其比表面积具有显著的影响.在温度固定为140 ℃时,反应时间为16 h, 所得样品的比表面积最大,表明时间过短和太长都难于得到比表面积大的ZnS.当固定反应时间,改变反应温度,发现温度也对ZnS 的比表面积有一定的影响,当反应温度大于140 ℃时,其比表面积略有减小.因此,最佳的溶剂热条件是温度为140 ℃时,反应时间为16 h, 这可能是由于ZnS 的晶体生长对反应温度和时间较为敏感所致.不同的温度和时间影响到其成核和晶体生长速率,进而影响到最终产品颗粒的大小、形貌和聚集状态,导致具有不同的比表面积.
| 表1 不同溶剂热条件下制备的ZnS 样品的比表面积 |
 |
| 点击放大 |
2.2 X 射线衍射(XRD)分析
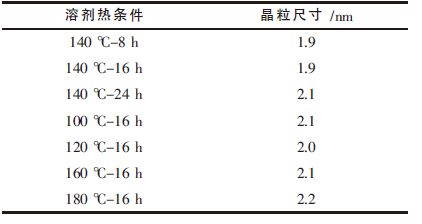
用X 射线粉末衍射技术对样品的结晶性能和晶型进行分析.图 1 为在不同溶剂热时间和温度制备的样品的XRD 谱图.各样品在2θ 为28.8° 、48.4° 和57.1°处出现明显的衍射峰,这些衍射峰分别对应于立方闪锌矿晶型的ZnS 的(111)、(220)和(311)晶面的衍射峰,与PDF 卡中的ZnS(65-5476)相吻合,表明溶剂热下合成所有样品均具有较好的结晶性能.从图 1 中还可以看出,所有样品的衍射峰的位置基本相同,只是衍射峰的强度略有不同,其中140 ℃反应16 h 所制样品呈现的峰型最为尖锐,且半峰宽也最窄,说明此条件下所制备的ZnS 的结晶性能最好.根据Scherrer 公式:D=0.89λ/(βcosθ)计算ZnS 的平均晶粒尺寸D;式中,β 为(111)晶面对应的最强衍射峰的半峰宽,λ 为入射光波长(0.154 nm),θ 为该晶面对应的衍射角.计算各样品的平均晶粒尺寸结果见表 2.由表 2 中数据可见,合成的样品平均晶粒粒径为1.9~2.2 nm 之间,所得的样品基本由纳米级的颗粒所组成.
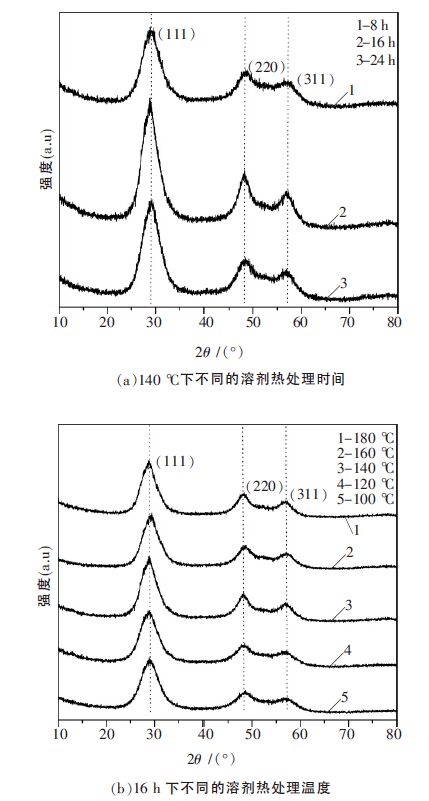 |
| 图 1 样品的XRD 谱图 |
| 表2 不同溶剂热条件下制备的ZnS 样品平均晶粒粒径 |
 |
| 点击放大 |
2.3 形貌分析
对所得样品的整体形貌进行扫描电镜分析.图 2(a)、(b) 给出140 ℃反应16 h 所得典型样品ZnS 的不同倍数的SEM 照片图.从图 2 可以看出,制备的ZnS 光催化剂具有较规则的形貌,样品由大量尺寸不等的光滑球状颗粒物所组成.构成的球状颗粒的粒径大约在0.5 μm 左右.
 |
| 图 2 典型ZnS 的扫描电镜照片 |
经作者研究分析提出的溶剂条件下球状ZnS 的可能形成机理如图 3 所示.首先醋酸锌溶解在乙二醇中电离出Zn2+,电离的Zn2+可能会与乙二醇产生相互作用,通过形成Zn-(OHCH2-CH2HO),而被乙二醇分子包围.在升温的条件下,硫脲开始分解释放出S2-,释放的S2-逐步扩散到溶剂中与Zn2+发生反应,生成ZnS 晶核.ZnS 晶核可能也被乙二醇所包围和吸附,随着反应时间的进行,ZnS 晶核开始融合和长大.最终形成具有球状形貌的ZnS 聚集体.
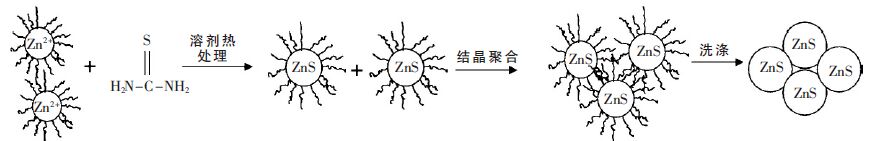 |
| 图 3 溶剂热条件下球状ZnS 的形成机理 |
2.4 紫外可见漫反射吸收光谱分析
对所得样品的光吸收性能进行紫外可见漫反射吸收光谱分析,以反映固体样品对不同波长的光吸收情况.测试结果见图 4(a)和(b).由图 4 可见,各样品的吸收边的位置在358 nm 附近,随着反应温度的上升和时间的延长,样品的吸收边仅有略微的红移.对140 ℃反应16 h 所得ZnS 的吸收曲线,做其切线与X 轴相交得样品的光吸收边,即光吸收阈值λg, 然后根据带隙能(eV)公式:Eg=1240/λg[23],算出其禁带宽度为3.46 eV.
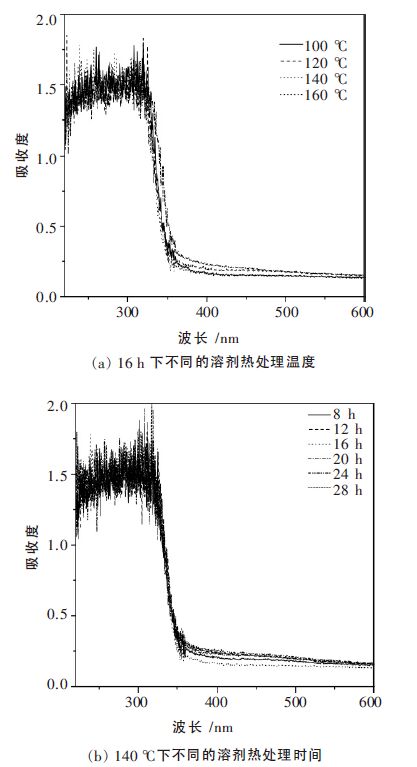 |
| 图 4 样品的紫外可见漫反射吸收光谱 |
2.5 光致发光谱(PL)分析
光致发光谱可以用来表征光催化剂的光生电子空穴对的重组程度和寿命.实验中的光致发光谱是在激发波长为390 nm 和室温条件下获得的,图 5 给出样品的光致发光光谱图.由图 5 可知ZnS 的发射主峰在460 nm 附近,其归属为ZnS 晶体中形成的硫空位导致的缺陷发光所引起[24].由图 5(a)可以看出,当增加反应温度时,ZnS 的发射峰先减弱后不断增强,其中140 ℃所制样品发光能力最弱,说明增加反应温度可以抑制ZnS 晶体中硫空位的形成,减少晶体的缺陷数量.然而随着温度的继续提高,发光峰强度又开始增强,这可能是由于高温处理使得晶格中的硫原子离开原来的位置,从而产生更多的硫空位缺陷,导致发光强度增强.半导体中的晶体缺陷,往往可能成为光生电子与空穴的复合中心,不利于光生电子和空穴的分离.光生电子和空穴的分离效率则直接和光催化性能相关.光生电子和空穴的分离效率越高,则越有利于产生更多的光催化活性自由基.因此,合适的处理温度有利于光催化性能的提高.从图 5(b)可以看出,当增加反应时间时,ZnS 的发射峰先减弱后增强.说明,溶剂热的处理时间也对ZnS 晶体的缺陷的形成产生影响.处理16 h 的发射峰最弱,说明此时间下处理的ZnS 光催化剂的缺陷较少,可能具有更好的光催化性能.
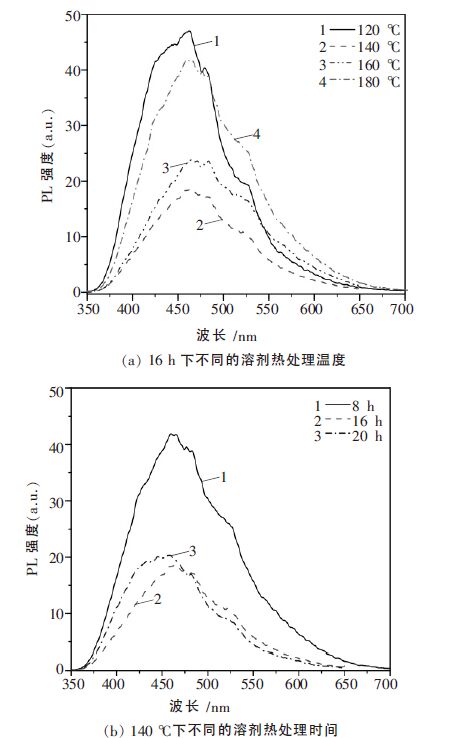 |
| 图 5 样品的光致发光谱 |
2.6 光催化活性测试
选用波长为254 nm 的紫外灯作为光源,首先将各样品对含有染料酸性橙Ⅱ的水溶液进行光催化活性测试.反应开始前,先于暗处搅拌吸附40 min 达到物理吸附和脱附平衡后打开光源.酸性橙Ⅱ浓度随光照时间的变化曲线如图 6 所示.图 6(a)和(b)分别为染料酸性橙Ⅱ的浓度在不同反应温度和不同反应时间制备的样品的反应催化体随光照时间的变化.由图 6 可知,不加入催化剂时酸性橙Ⅱ浓度随光照时间的变化基本保持不变,表明酸性橙Ⅱ是一个稳定的染料分子,直接光解反应可以被忽略.图 6(a)表明,随着制备样品处理温度的上升,酸性橙Ⅱ的降解速率迅速加快,当温度达到140~180 ℃时,其活性达到最大值.光催化活性的上升是因为随着溶剂热温度的上升,ZnS 半导体中晶体缺陷逐渐减小,有利于光生电子和空穴的分离效率的提高,从而促进了光催化活性的提高.从图 6(b)可以看出,当制备样品的处理温度为140 ℃,时间为16 h 时,制备的ZnS 样品具有最高的光催化活性.对140 ℃下溶剂热处理16 h 获得的活性最好的ZnS 样品,进一步考察它对甲基橙、亚甲基蓝、罗丹明B 不同染料的光催化降解性能,结果见图 7.由图 7 可见,该催化剂同样对其它染料具有较高的光催化降解活性.光照5 h 后甲基橙(MO)、亚甲基蓝(MB)、罗丹明B (RhB) 的降解率分别为93.04 %、64.63 %和51.79 %.ZnS 对不同染料具有不同的降解性能,可能和染料的分子结构有关,酸性橙Ⅱ、甲基橙均含有易降解的-N=N-基团[25],而亚甲基蓝和罗丹明B 的含N 基团不同,因此二者的光催化降解效率相对较低.
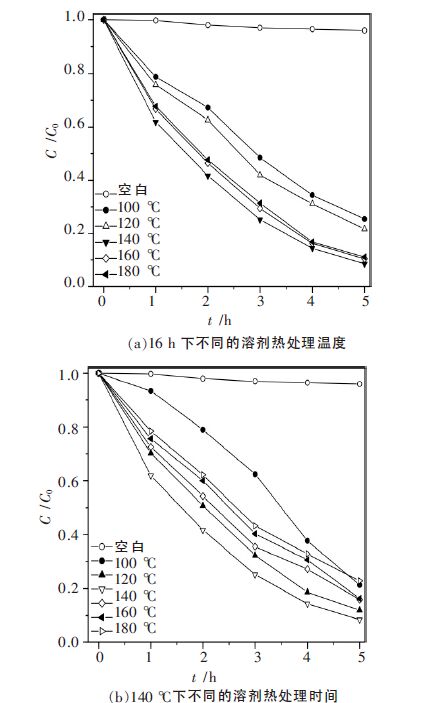 |
| 图 6 不同条件下制备的 ZnS对酸性橙Ⅱ光催化降解性能比较 |
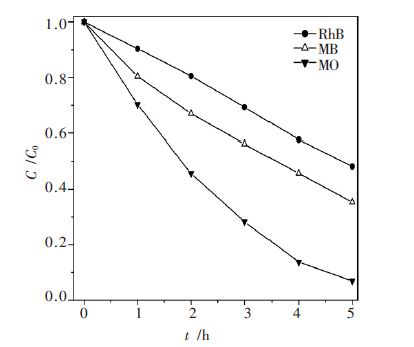 |
| 对不同染料的光催化降解性能比较甲基橙:MO;亚甲基蓝:MB;罗丹明B:RhB 图 7 140 ℃下溶剂热处理16 h 获得的ZnS |
3 结论
以乙二醇为反应介质,采用溶剂热法制备了一系列禁带宽度为3.46 eV 左右的球状ZnS 纳米光催化剂.光催化降解酸性橙Ⅱ活性测试表明,140 ℃反应16 h 所制样品活性最高.其原因是该条件下制备的ZnS 具有较高的结晶度、较大的比表面积和较少晶格缺陷.该ZnS 催化剂对酸性橙Ⅱ、甲基橙、亚甲基蓝和罗丹明B 均具有较好的光催化降解活性.
| [1] | 余长林, 操芳芳, 李鑫, 等. 纳米BiOI 的稳定性、结构及光催化性能研究[J]. 有色金属科学与工程, 2011, 2(4): 86–91. |
| [2] | 余长林, 杨凯. 异质结构的复合光催化材料的研究新进展[J]. 有色金属科学与工程, 2010, 1(2): 16–23. |
| [3] |
Yu C L, Yu J C. A simple way to prepare C-N-codoped TiO2 photo- catalyst with visible light activity[J].
Catalysis Letters, 2009, 129(3/4): 462–470. |
| [4] | 余长林, 操芳芳, 舒庆, 等. Ag/BiOX (X=Cl, Br, I)复合光催化剂的制备、表征及其光催化性能[J]. 物理化学学报, 2012, 28(3): 647–653. |
| [5] |
Cao Y Q, He T, Chen Y M, et al. Fabrication of rutile TiO2-Sn/Anatase TiO2-N heterostructure and its application in visible-light photocatal- ysis[J].
The Journal of Physical Chemistry B, 2010, 114(8): 3627–3633. |
| [6] |
Yu C L, Zhou W Q, Yang K, et al. Hydrothermal synthesis of hemi- sphere -like F -doped anatase TiO2 with visible light photocatalytic activity[J].
Journal of Materials Science, 2010, 45(21): 5756–5761. DOI: 10.1007/s10853-010-4646-6. |
| [7] |
Yu C L, Cai D J, Yang K, et al. Sol-gel derived S, I-codoped meso- porous TiO2 photocatalyst with high visible-light photocatalytic activi- ty[J].
Journal of Physics and Chemistry of Solids, 2010, 71(9): 1337–1343. DOI: 10.1016/j.jpcs.2010.06.001. |
| [8] |
Yu C L, Yu J C, Chan M. Sonochemical fabrication of fluorinated mesoporous titanium dioxide microspheres[J].
Journal of Solid State Chemistry, 2009, 182(5): 1061–1069. DOI: 10.1016/j.jssc.2009.01.033. |
| [9] | 余长林, 温和瑞, 相彬, 等. 不同晶体结构的BiVO4 的制备及其可见光催化性能[J]. 江西理工大学学报, 2009, 30(4): 9–12. |
| [10] |
Yu C L, Meng X J. A novel Ag/BiOBr nanoplate catalyst with high photocatalytic activity in decomposition of the dyes[J].
Reaction Ki- netics Mechanisms and Catalysis, 2011, 103(1): 141–151. DOI: 10.1007/s11144-011-0291-6. |
| [11] |
Yu C L, Yu J C, Fan C F. Synthesis and characterization of Pt/BiOI nano-plate catalyst with enhanced activity under visible light irradi- ation[J].
Materials Science and Engineering B, Solid-State Materials for Advanced Technology, 2010, 166(3): 213–219. DOI: 10.1016/j.mseb.2009.11.029. |
| [12] |
Yu C L, Fan C F, Yu J C. Preparation of bismuth oxyiodides and ox- ides and their photooxidation characteristic under visible/UV -light irradiation[J].
Materials Research Bulletin, 2011, 46(1): 140–146. DOI: 10.1016/j.materresbull.2010.08.013. |
| [13] | 张立德. 纳米材料[M]. 北京: 化学工业出版社 , 2000: 37-39. |
| [14] |
Henglein A. Small particle research: physicochemical properties of extremely small colloidal metal and semiconductor particles[J].
Chemical Reviews, 1989, 89(8): 1861–1873. DOI: 10.1021/cr00098a010. |
| [15] |
Müller B R, Majoni S, Memming R, et al. Particle size and surface chemistry in photoelectrochemical reactions at semiconductor parti- cles[J].
The Journal of Physical Chemistry B, 1997, 101(14): 2501–2507. DOI: 10.1021/jp962749v. |
| [16] |
Kanemoto M, Hosokawa H, Wada Y, et al. Semiconductor photocatal- ysis.Part 20.-Role of surface in the photoreduction of carbon dioxide catalysed by colloidal ZnS nanocrystallites in organic solvent[J].
Jour- nal of the Chemical Society, Faraday Transactions, 1996, 92(13): 2401–2411. DOI: 10.1039/FT9969202401. |
| [17] |
Qian Y T, Su Y, Xie Y, et al. Hydrothermal preparation and charac- terization of nanocrystalline powder of sphalerite[J].
Materials Research Bulletin, 1995, 30(5): 601–605. DOI: 10.1016/0025-5408(95)00040-2. |
| [18] |
Feng S A, Zhao J H, Zhu Z P, et al. Kinetically restraining aggrega- tion of ZnS nanocrystals and the effect on photocatalysis[J].
Materi- als Science and Engineering: B, Solid -State Materials for Ad- vanced Technology, 2008, 150(2): 116–120. DOI: 10.1016/j.mseb.2008.02.002. |
| [19] |
Stroyuk A L, Raevskaya A E, Korzhak A V, et al. Zinc sulfide nanoparticles: spectral properties and photocatalytic activity in metals reduction reactions[J].
Journal of nanoparticle research, 2007, 9(6): 1027–1039. DOI: 10.1007/s11051-006-9183-5. |
| [20] |
Yu C L, Yu J C, Wen H R, et al. A mild solvothermal route for preparation of cubic-like CuInS2 crystals[J].
Materials Letters, 2009, 63(23): 1984–1986. DOI: 10.1016/j.matlet.2009.06.030. |
| [21] |
Yu C L, Wen H R, Yu J C. Preparation of different magnetic Fe3O4 nanocrystals under mild conditions with different poly (ethylene glycol)[J].
Nanotechnology and Precision Engineering, 2010, 8(2): 161–166. |
| [22] | 余长林, 杨凯, 范采凤, 等. 溶剂热合成Sn 掺杂的纳米ZnO 光催化剂及其光催化性能[J]. 纳米技术与精密工程, 2011, 9(6): 499–503. |
| [23] | 高濂, 郑珊, 张青红. 纳米氧化钛光催化材料及应用[M]. 北京: 化学工业出版社 , 2002: 72. |
| [24] |
Suyver J F, Wuister S F, Kelly J J, et al. Synthesis and photolumines- cence of nanocrystalline ZnS:Mn2+[J].
Nano Letters, 2001, 1(8): 429–443. DOI: 10.1021/nl015551h. |
| [25] | 邓玲娟, 黄方千, 高丰琴, 等. ZnS 光催化剂对不同偶氮类染料光降解的光催化性能的比较[J]. 应用化学, 2010, 27(6): 705–709. |
 2012, Vol. 3
2012, Vol. 3


