| 甲烷部分氧化催化剂上的积碳研究进展 |
2. 厦门大学固体表面物理化学国家重点实验室,福建 厦门 361005
2. State Key Laboratory of Physical Chemistry of Solid Surfaces, Xiamen University, Xiamen 361005, China
甲烷是天然气的主要成分,相对于石油和煤炭等能源具有使用安全、热值高、洁净等优势,在当今能源短缺的时代,对于甲烷的合理利用显得意义更重大.甲烷的直接转化法存在反应活性差、选择性低等缺点而短时间内难于实现工业化,因此,甲烷间接转化制合成气是现阶段甲烷利用的主要途径.现阶段水蒸汽重整(SMR)、二氧化碳重整(CDR)、甲烷部分氧化(POM)以及它们之间的串联[1]是甲烷转化制合成气的基本方法,其中水蒸汽重整早已技术成熟.水蒸汽重整[2]是一个强吸热、高能耗、设备投资大的工艺,并且产物中H2/CO 的摩尔比偏大,不适合作甲醇合成、F-T 合成的原料.二氧化碳重整制得的合成气摩尔比约为1,比较适合F-T 合成,但该过程仍需消耗大量热量,同时甲烷的单程转化率较低,催化剂的积碳失活较严重[3].POM 反应制合成气的反应为:
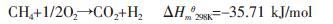
|
此反应在热力学上是一温和放热反应,在较低温度(750~800 ℃)、高空速(105 数量级)条件下可达到较高的转化率(90 %)和选择性(95 %以上),合成气H2/CO 摩尔比约为2,可直接用于甲醇合成和F-T合成等后续工业过程,并且该过程具有反应器体积小,能耗低等优点[4]而深受广泛研究者的关注[5-7].但是在POM 反应中存在着因催化剂表面形成积碳而严重失活的现象,因此研究甲烷部分氧化过程的催化剂积碳问题显得非常重要.
1 甲烷部分氧化反应机理和催化剂体系 1.1 甲烷部分氧化反应机理POM 反应是一个极快速的反应,对于其反应机理至今仍争议不止.目前被大部分研究者所认同的两种机理是燃烧-重整机理和直接氧化机理.燃烧-重整机理认为POM 反应可分为两步: 第一步是部分CH4被全部的O2氧化生成CO2和H2O,认为CO2和H2O是POM 反应的初级产物;第二步是余下的CH4与第一步生成的CO2和H2O 发生重整反应进而生成CO和H2.Prettre 等[8]在Ni 基催化剂上研究POM 反应机理,认为POM 反应应该遵循燃烧-重整机理,因为他们发现POM 反应中催化剂床层存在明显的纵向温度梯度,即顶端温度很高,然后温度开始下降,温度梯度的存在是因为该过程起初发生放热反应,然后发生吸热反应.而金荣超等[9]在Ni/α-Al2O3催化剂上研究POM 反应机理,他们发现甲烷部分氧化反应的核心步骤是CH4和O2在活化相Ni0 上的活化,形成中间碳物种Ni…C 和氧物种Niδ+…Oδ-,然后两者发生反应生成CO,POM 反应应该按照直接氧化机理进行.Hickman 和Choudhary 等[10-11]也认为POM 是一个高空速、非稳态的反应,CO 和H2是该反应的初级产物,而不是由CH4和CO2或H2O 重整得来.翁维正等[12]借助原位Raman 光谱和原位时间分辨红外手段对催化剂表面的物种和POM 反应的初级产物进行分析,发现被H2预还原的新鲜Ir/SiO2表面上形成的CO 是由CH4直接氧化而来,POM 反应遵循直接氧化机理;但在稳态反应条件下,生成CO 的主要途径可能是CO2和H2O 与积碳物(CHx)和/或CH4的反应.由此看来,两种机理的主要差异在于CO 和H2是否为该反应的一次产物,而催化剂表面不同浓度的O2-物种和反应条件下产生的积碳物种被认为可能是导致POM 反应机理存在差异的主要原因.所以,进一步借助先进的分析手段如同位素跟踪等深入研究其反应机理对于理解甲烷部分氧化中积碳的形成机理具有重要作用.
1.2 甲烷部分氧化的催化剂体系研究结果显示,用于POM 反应的催化剂体系大致有3 类[13]:(1) Ir、Pt、Pd、Rh、Ru 等负载型贵金属催化剂;(2) 以Ni、Co、Fe 为主的负载型非贵金属催化剂;(3)金属氧化物催化剂.在催化活性、选择性及抗积碳性等方面贵金属催化剂具有明显的优势,其中Ru 对H2和CO 的选择性更高,而Pt 催化剂的稳定性更好[7],但是贵金属催化剂因价格昂贵使其工业应用受到一定的限制.Silva 等[14]制备了不同负载量的Pt催化剂,结果表明,在POM 反应过程中1.5 wt% Pt 催化剂的催化活性和稳定性最高.Ni 基催化剂较贵金属催化剂的价格更低,且具有很高的活性,是研究最多的反应体系[15],但其缺点是易发生积碳、烧结、活性组份流失,从而导致失活现象严重;与Ni 基相比,Co 基催化剂的POM 反应活性较差,而且Co 基催化剂更倾向于将甲烷完全氧化,导致H2和CO 的选择性下降,但Co 的熔点较高,具有在高温条件下抵抗活性组分流失的优势[16].金属氧化物催化剂大致包含钙钛矿型(ABO3)或类钙钛矿型(A2BO4)氧化物及复合氧化物,也有使用单金属氧化物的报道.Wei 等[17]采用共沉淀法制备Ce-Fe-O(Ce/Fe=7)系列催化剂用于POM反应,实验发现升高温度有利于合成气的生成,在900 ℃时催化剂的转化率和选择性均很高,这说明晶格氧催化甲烷部分氧化制取合成气同样是可行的.但3 类催化剂体系都面临着因为不同程度的积碳而导致失活的问题.
2 甲烷部分氧化中催化剂的积碳形成研究催化剂失活的因素大概包括积碳、烧结、活性组分流失、中毒、化合态组成发生变化等.其中积碳是造成甲烷催化转化制合成气的催化剂失活的最主要因素,原因在于一旦产生了积碳,催化剂的活性中心将会被积碳所覆盖,催化剂的孔道被堵塞,造成催化剂活性的迅速下降.研究表明,以下3 个反应可能会导致积碳的产生:

|
目前对催化剂表面形成积碳而失活现象的研究主要集中在两方面: 一是判断造成积碳失活的碳物种的主要类型,二是确定反应过程中形成积碳的主要途径.
文献[18-19]报道证实了催化剂表面积碳的主要类型是石墨型碳,但是在能量和结构上都偏离标准的石墨碳构型.井强山等[20]研究反应条件下Ni 催化剂的积碳性能,实验发现反应后催化剂表面沉积了3 种不同反应活性的碳物种:Cα(碳化物),Cβ(Cα继续脱氢形成的石墨型积碳物的前驱物)和Cγ(类石墨型碳).其中Cα是一种反应活性较高且不会影响催化剂反应活性的碳物种,而Cγ被称为毒性碳容易造成催化剂的失活,由此说明Cγ是积碳物种的主要类型.陈吉祥等[21]研究CH4-CO2重整反应催化剂表面沉积的碳物种的类型,根据X 射线光电子能谱分析(XPS)和程序升温氧化(TPO)表征结果显示反应过程中产生的碳物种主要有2 种: 活性较高的碳化物和性质稳定的石墨型碳,而且碳化物有可能会转化为石墨型碳.史克英等[22]采用热重分析(TG)技术考察了700 ℃ H2氛围下预还原的Ni/γ-A12O3上积碳反应的程序升温积碳曲线,实验结果表明CH4分解是造成催化剂积碳的主要方式.Claridge[23]等对POM 反应催化剂上积碳进行了研究,也认为CH4催化裂解是产生积碳的主要途径.贾庆超等[24]考察Ni/ZrO2催化剂POM 反应的积碳性能,发现催化剂的积碳大多数是由甲烷的分解所造成的,而且随着温度的升高,积碳量也大大增加.严前古等[25]则考察反应条件对POM 反应中催化剂积碳的影响并依据体系的热力学分析,认为催化剂的积碳主要是由CO 的歧化和还原产生的.热力学推导[26]和大多数实验认为,当反应温度低于600 ℃时CO 的歧化速率远远大于CH4的分解速率,CO 的歧化是催化剂积碳的主要方式; 而随着温度的升高催化剂的积碳则逐渐以CH4的分解为主.
关于在催化剂表面形成积碳物种的位置,也有不少人进行了研究,比如Bengaard 等[27]和Helveg 等[18]借助实验和电子密度泛函理论(DFT)计算对催化剂表面形成的单石墨层进行了研究,发现催化剂的台阶位较平台位更容易产生积碳.Nakano 等[28]也认为催化剂的台阶位是形成积碳的主要位置,而且台阶或缺陷位上形成的积碳物容易向平台位迁移.Fleming 等[29]采用在线分析法研究了影响反应中催化剂的积碳因素,发现活性金属种类、活性金属的负载量和分散度、载体、助剂、反应条件、反应器类型等均能影响催化剂的积碳性能.目前,对于增强催化剂稳定性的研究主要集中通过添加合适的助剂或者改变制备方法等手段以加快催化剂表面吸附碳的氧化而提高催化剂的抗积碳能力.
3 甲烷部分氧化抗积碳性能研究 3.1 活性组分效应POM 反应中负载型催化剂的活性组分主要是贵金属和过渡金属元素,活性组分效应主要表现为活性金属组分的选择和活性组分的负载量的不同.不同金属的结构和表面性能不一样,与甲烷的作用机理也不同; 而不同负载量的活性组分因表面活性中心数量的差异造成表面积碳反应程度不同,从而导致它们的催化性能和抗积碳性能也各不相同.
Claridge 等[23]发现贵金属催化剂的抗积碳性能优越,其中以Pt 和Ir 最为突出,在经过长时间反应之后,保持高活性的同时几乎不产生积碳.他们也认为积碳的形成与生成合成气的反应历程无关,因此使用合适的催化剂可一定程度上避免产生积碳物.Rostrup等[30]研究重整反应中Pt 族贵金属及Ni 催化剂的抗积碳性能,实验发现贵金属催化剂的表面只有极微量的积碳生成,Ni 与贵金属的催化活性相近但表面生成的积碳物却很多.陈吉祥等[21]考察了Ni-CeO2/γ-A12O3催化剂的积碳与温度之间的关系,发现随着反应温度的升高催化剂的抗积碳能力增强,而且达到相对稳定的积碳量所需的时间明显减少.他们还总结出以下规律:活性组分镍颗粒越细,催化剂的抗积碳性能越好;随着反应温度的升高,催化剂表面酸性反而有利于积碳反应的进行,增加积碳量.
另外,催化剂的抗积碳性能与活性金属的负载量也有密切的联系,活性组分的负载量有一个最佳值,过多或过少都会严重影响催化剂的催化活性,甚至还会导致积碳的加剧.吴延华等[31]研究Ni 的含量对Ni/Al2O3催化剂积碳性能的影响,结果发现当Ni含量小于7.5 wt%时,催化剂抑制积碳的作用很强,积碳量很少;而当Ni 含量增加时,催化剂表面产生的积碳量则大大增加.也有报道表明,增加Co 基催化剂中Co 的负载量也可以提高其POM 反应活性,具有较高POM 反应活性的Co/MgO 和Co/A12O3催化剂[32],其Co 负载量达到了24 wt%,甲烷转化率和合成气的选择性均在90 %以上,但活性组分负载量过高的催化剂由于其活性位密集参与了更多的催化反应,从而容易导致积碳失活.
3.2 助剂效应添加合适的助剂以提高POM 反应催化活性和抗积碳性能的重要方法.常见的助剂大概可分为碱金属(电子型助剂)、碱土金属(结构型助剂)、稀土金属(Ce、Zr、La 等)和其他过渡金属(Cu、Mo、Co、Zn等)等4 大类,也有少数文献报道过添加非金属助剂(如F、B 等).
碱金属可以作为一类重要的电子型助剂掺杂到催化剂中,提高催化剂的抗积碳性能[33].碱金属可以有效地减少催化剂表面的酸性位,使活性组分富电子性,降低甲烷的分解速率,加快催化剂表面CO 的脱附以及碳物种的氧化,达到消除表面积碳的目的.尚丽雯等[34]根据甲烷催化制合成气的研究发现,不同的碱金属对提高催化剂抗积碳能力的效应各不一致,以助剂K 的效应最佳.他们也认为添加碱金属助剂之后,有利于催化剂表面对CO2的吸附,促使CO2和碳物种反应生成CO,从而促进催化剂的消碳.
碱土金属助剂是研究使用最广泛的一类助剂,通常作为结构型助剂添加至催化剂中,修饰和改进催化剂的活性,使活性物种的电子密度增大,颗粒度减小,增强催化剂的抗积碳性能.张诺伟等[16]考察了向Co/HZSM-5 中添加Mg 助剂对POM 反应的影响,XRD 表征结果说明Mg 助剂促进Co 物种的分散或与Co 作用生成了新的物相MgCo2O4,使还原后金属的颗粒度降低,并抑制了反应过程中活性相Co 的再氧化以及与分子筛骨架中Al2O3的相互作用生成CoAl2O4,从而增强了催化剂的活性和稳定性.廖卫兵等[35]制备了用于CH4-CO2重整反应的Mg-Ni/BaTiO3催化剂,研究助剂对Ni 催化剂积碳性能的影响,实验结果MgO 助剂可以明显的降低消碳反应的引发温度,有效地抑制碳物种在催化剂表面的生长,进而改善催化剂的抗积碳性能.Chen 等[36]制得了Ni/Ca-AlO和NiB/Ca-AlO 2 种催化剂,这2 种催化剂都有很好的活性和抗积碳性能,最主要的原因可能是Ca 助剂的添加对Ni 物种起到一定的“阻隔"或者“包埋"作用,阻碍了Ni 颗粒的迁移和团聚,提高了金属Ni 的分散度.
稀土金属助剂以CeO2、ZrO2、La2O3居多.CeO2和ZrO2是一类性能优异的抗积碳助剂,它们会和活性组分间产生强烈的相互作用,促使活性组分在载体表面高度分散或者提供部分的碱性位,可以在较大程度上抑制积碳物的形成.王锐[37]向Rh 基催化剂上掺杂CeO2用于CH4-CO2重整反应,实验结果说明添加CeO2后增强了催化剂表面碳物种CHx和CO2的活化,减少了催化剂表面的积碳反应,使抗积碳能力得以提高.Souza 等[38]考察了助剂ZrO2对Pt/Al2O3催化剂积碳性能的影响,结果发现Pt/ZrO2/Al2O3样品中Pt 与Zr 的相互作用促进了活性组分的分散,使其催化性能和抵抗积碳生成的能力明显优于Pt/Al2O3样品.Cao 等[39]研究了La2O3助剂对Ni 催化剂积碳性能的影响,结果发现La2O3的不同添加量对催化性能的影响不一致,加入适量的La2O3会与NiO 形成钙钛矿结构的LaNiO3,降低反应的引发温度,从而提高催化剂的活性和抗积碳性能;但是过量的La2O3会生成大量的LaNiO3而覆盖载体A12O3的表面,削弱NiO 和A12O3的相互作用,出现了部分游离的、还原后颗粒度较大的NiO,反而不利于提高稳定性和抗积碳性能.
添加过渡金属氧化物如Cu、Co 和Mo 的氧化物也能一定程度上提高催化剂的抗积碳性能.刘淑红等[40]研究CuO 对于Ni 催化剂POM 引发过程的影响时,发现CuO 的添加能够牵制和阻碍活性相Ni0 的再氧化,同时也细化了活性组分的晶粒,增加了活性位的数目,从而提高了催化剂的催化活性和抗积碳性.Co本身就是一种活性中心,若将其作为助剂掺杂至催化剂中,也能对影响催化剂的抗积碳性能,Choudhary等[41]研究发现向Ni 基催化剂中添加助剂Co 相当于提供了双活性位,提高了POM 反应活性,同时降低催化剂表面的积碳量.也有研究[42]表明助剂Mo 的添加可以稀释Ni/A12O3催化剂,破坏催化剂表面形成积碳物的活性中心,降低积碳反应的发生,从而阻止形成积碳物.
除此之外,也有少数文献报道过引入非金属助剂,如F、B 等,由于F 的电负性比O 的大,添加F 以后容易吸收四周的电子,降低氧原子周围的电荷密度,减弱金属氧化物M-O 键的键能,促进金属氧化物的还原、分散及使碱度增强,从而提高催化剂的抗积碳性能.张军等[43]制备了方镁石结构的NiMgAlO-F 催化剂,并考察其POM 反应的催化性能,实验结果表明该催化剂表现出较高的催化活性.同时添加F 虽然使比表面积和晶粒度有所下降,但是它的掺杂提高了活性金属Ni 的分散度以及催化剂表面碱性中心,有效地增强了催化剂的抗积碳性能.
以上研究表明,添加助剂后,催化剂的活性组分在载体表面分散更均匀,表面性质得到改善,增强了催化剂表面抵抗积碳物种沉积的能力.另外,有部分碱土金属和稀土金属助剂可以对催化剂中活性金属产生“包埋"作用,牵制活性组分晶粒的聚集,使其还原温度降低,同样也能增强抗积碳性能.因此,研究助剂金属与活性金属之间的相互作用,通过助剂效应是提高催化剂抗积碳的重要途径.
3.3 载体效应传统的POM 反应催化剂载体一般采用不可还原的载体,主要包括Al2O3、SiO2、TiO2、La2O3、ZrSiO 和分子筛等,也有不少文献报道过采用可还原的载体,如CeO2、CeO2-ZrO2复合氧化物等.其中Al2O3是使用最多的载体之一,主要原因在于它是一种多相态的物质,机械强度和热稳定性较好,比表面积较大.载体效应主要表现为载体的结构和活性金属与载体之间相互作用的差异.
Nakagawa 等[44]依据其研究结果发现,选取不同载体制得的Ir 催化剂的抗积碳性能存在明显的区别,其中积碳较严重的催化剂的载体是Al2O3和SiO2,这可能与载体表面较强的酸性有关.王锐等[45]对比考察了Al2O3、SiO2和CeO2为载体负载Rh 催化剂的抗积碳性能,实验结果表明金属与载体间相互作用越强,催化剂的抗积碳性能越强,游离的活性金属容易造成积碳失活,Rh/CeO2样品中Rh 与CeO2的强相互作用使体相中出现了部分氧空穴,促进了表面碳物种的活化,增强了消碳反应的能力,致使Rh/CeO2的抗积碳能力最强.Hu 等[46]也认为载体和活性组分间的强相互作用可以有效阻止积碳的形成,他们在研究NiO/MgO 的性能时,发现MgO 和NiO 形成的固溶体促进了活性金属的分散,提高催化剂的抗积碳性能.杨继海等[47]研究了Ni/La2O3催化剂的POM性能,结果发现NiO 和La2O3高温条件下生成了LaNiO3,使表面氧物种的浓度增加,及时氧化表面碳物种,从而提高了催化剂的抗积碳能力.Seo 等[48]研究了不同载体上负载Rh 和Ni 催化剂的POM 反应性能,结果发现以CeO2为载体的催化剂的活性和稳定性都更高,这可能是由于CeO2中的晶格氧参与了与积碳前驱体的反应,有利于积碳的消除.
载体表面较低的酸度和活性组分与载体间较强的相互作用往往有利于抵抗积碳的生成[49-51],所以对载体进行改性以减少催化剂的酸性中心和增强活性组分与载体间的相互作用是提高抗积碳性能的有效措施.此外,比表面积也是影响催化性能的重要指标,若载体的比表面积较小则容易造成活性组分分散不均匀,反应时容易造成烧结团聚,形成积碳物而失活.因此,开发出热稳定性良好、酸性低、比表面积大、机械强度好的载体是抵抗积碳的另一重要途径.
3.4 催化剂的制备方法李凝等[52]认为不同方法制备的NiO-ZrO2-Al2O3催化剂的表面性能、晶粒尺寸等存在很大的差异,发现以浸渍-沉淀法制得的样品中ZrO2颗粒达到了纳米级别,高度分散在载体表面,CO2在其表面的吸附最强,催化剂的稳定性和抗积碳性最佳.陈娟荣[53]对比了浸渍法和溶胶-凝胶法制备的Ni-Co 双金属催化剂的催化性能,发现由后者方法制备的催化剂中活性组分与载体间的相互作用更强,分散度更高,晶粒度更小,载体的稳定性更高,催化剂的活性和抗积碳性更好.刘树强等[54]研究对比了柠檬酸络合法和直接分解法制备的Cr2O3催化剂上POM 反应性能,结果发现柠檬酸法制备的Cr2O3催化剂的活性和抗积碳性能均比直接分解法的强很多.
季亚英等[55]考察了由不同前躯体制备的催化剂POM 反应积碳性能的影响,经反应后发现,由硝酸镍和醋酸镍制得的催化剂均有积碳,而氯化镍几乎不生成积碳,说明氯化镍的抗积碳性能良好.Quincoces等[42]研究向Ni/Al2O3中添加Mo 助剂,发现先浸渍Mo制得的催化剂抗积碳性能比先浸渍Ni 制得的催化剂要差.邓存[56]也认为催化剂的抗积碳性能与助剂的添加顺序有很大关系,先浸渍MgO 比后浸渍MgO 制得的催化剂的抗积碳能力更强.Yu 等[5]考察了焙烧温度对Co/γ-Al2O3催化性能的影响,虽然比表面积随焙烧温度的升高而有所下降,但催化剂在选择性和稳定性方面均有所提高.
POM 催化剂最常用的方法是浸渍法和共沉淀法,但存在比表面积小、还原不够充分、稳定性不高、易烧结团聚、抗积碳性能差等缺点.近年来兴起的溶胶-凝胶法[35]制得的催化剂在比表面积、粒径、分散度等方面均优于传统方法,因此改变催化剂的制备方法、前驱体的选择、掺杂助剂的先后顺序也有望增强催化剂的抗积碳性能.
3.5 储氧材料的应用最近报道证实,一些具有储氧(晶格氧)功能的催化材料表现出较强的抗积碳能力.CeO2是典型的具有n 型半导体性质[57-58]的物质,容易在高温还原气氛下被还原为Ce3+并产生氧空穴,而这些空穴容易释放出和活性金属结合的自由电子,牵制活性金属的迁移,使活性中心分散更均匀,完全消除催化剂表面的积碳.
石芳丽[59]研究Pd/CeO2-ZrO2/Al2O3催化剂时发现CeO2-ZrO2体相中存在晶格氧缺陷,能够提高消碳反应的活性,从而增强了抗积碳能力.王磊等[60]研究柠檬酸络合法制备的La0.75Sr0.25Mn1-xNixO3+δ系列催化剂中晶格氧对POM 反应的催化活性,结果发现当x=0.5 时样品的晶格氧含量最高,形成了稳定的钙钛矿结构,促进了活性组分的分散,抗积碳性能最好.Salazar 等[61]以复合氧化物为载体负载Pt 催化剂,认为晶格氧催化甲烷部分氧化制合成气反应的活性和稳定性较好,并且掺杂Gd 的样品抗积碳能力更强.Provender 等[62]制备了LaNixFe1-xO3(0≤x≤1)系列催化剂样品,发现该样品具有抵抗活性组分流失的优势,其中x=0.3 时,该催化剂经过高温长时间反应后,在保持活性的同时没有积碳的生成; 而当x≥0.6 时,催化剂易失活,但可以通过煅烧得以再生.李孔斋等[63]研究复合氧化物中晶格氧的POM 反应催化性能,认为晶格氧比较适合用作POM 的氧物种,反应过程中催化剂失去的晶格氧可以通过样品和空气作用实现补充再生,也能保持较高的活性.相对气相纯氧氧化,晶格氧催化在甲烷部分氧化中,具备过程操作简单、抗积碳性高等优点.
4 结束语甲烷部分氧化制合成气已成为推动天然气化工发展的关键,然而该工艺还存在一些问题亟待解决,如反应机理尚不明确,催化剂表面易形成积碳物种而失活等.因此通过对POM 反应机理的深入探讨、活性金属种类和负载量的改变、添加合适的助剂、载体的改性以及制备方法的改进和晶格氧催化甲烷部分氧化等方面的研究设计出具有良好活性与抗积碳性的催化剂体系仍是当前重点研究工作.
| [1] | 余长林, 周晓春. 甲烷催化部分氧化制合成气研究新进展[J]. 天然气化工, 2011, 36(5): 67–72. |
| [2] |
Rostrup Nielsen J R. Production of synthesis gas[J].
Catalysis Today, 1993, 18(4): 305–324. DOI: 10.1016/0920-5861(93)80059-A. |
| [3] |
Hu Y H, Ruckenstein E. Catalytic conversion of methane to synthesisgas by partial oxidation and CO2 reforming[J].
Advances in Catalysis, 2004, 48: 297–345. |
| [4] | 于彦存. 甲烷部分氧化制合成气Ni-CexZr1-xO2催化剂的研究[D].天津:天津大学,2007. |
| [5] |
Yu C L, Weng W Z, Shu Q, et al. Additive effects of alkaline-earthmetals and nickel on the performance of Co/γ -Al2O3 in methanecatalytic partial oxidation[J].
Journal of Natural Gas Chemistry, 2011, 20(2): 135–139. DOI: 10.1016/S1003-9953(10)60175-2. |
| [6] | 王越, 叶季蕾, 段华超, 等. 钡改性的Ni/γ-Al2O3催化剂用于甲烷部分氧化的研究[J]. 燃料化学学报, 2005, 33(6): 750–754. |
| [7] |
Lanza R, Canu P, Jaras S G. Methane partial oxidation over Pt-Rucatalyst: An investigation on the mechanism[J].
Applied Catalysis A, 2010, 375(1): 92–100. DOI: 10.1016/j.apcata.2009.12.021. |
| [8] |
Prettre M, Eichner C, Perrin M. The catalytic oxidation of methaneto carbon monoxide and hydrogen[J].
Transactions of the Faraday Society, 1946, 42: 335b–339. DOI: 10.1039/tf946420335b. |
| [9] | 金荣超, 陈燕馨, 李文钊, 等. 甲烷催化部分氧化制合成气的反应机理[J]. 物理化学学报, 1999, 15(4): 313–318. |
| [10] |
Hickman D A, Schmidt L D. Production of syngas by direct catalyticoxidation of methane[J].
Science, 1993, 259(5093): 343–346. DOI: 10.1126/science.259.5093.343. |
| [11] |
Choudhary V R, Rajput A M, Prabhakar B. None-quilibrium oxidativeconversion of methane to CO and H2 with high selectivityand productivity over Ni/Al2O3 at low temperature[J].
Journal of Catalysis, 1993, 139(1): 326–328. DOI: 10.1006/jcat.1993.1027. |
| [12] | 翁维正, 罗春容, 李建梅, 等. Ir/SiO2上甲烷部分氧化制合成气反应的原位时间分辨红外和原位Raman 光谱表征[J]. 化学学报, 2004, 62(18): 1853–1857. |
| [13] | 郭翠梨. 甲烷部分氧化制合成气La-Ni-O 系催化剂性能的研究[D].天津:天津大学, 2006. |
| [14] |
Silva F A, Ruiz J A C, Souza R K, et al. Partial oxidation ofmethane on Pt catalysts: Effect of the presence of ceria -zirconiamixed oxide and of metal content[J].
Applied Catalysis A, 2009, 364(1-2): 122–129. DOI: 10.1016/j.apcata.2009.05.038. |
| [15] |
Kobayashi Y, Horiguchi J, Kobayashi S, et al. Effect of NiO content in mesoporous NiO-Al2O3 catalysts for high pressure partial oxidation of methane to syngas[J].
Applied Catalysis A: General, 2011, 395(1/2): 129–137. |
| [16] | 张诺伟, 黄传敬, 匡飞平, 等. Mg 助剂对Co/Mg/HZSM-5 催化剂结 构及其催化甲烷部分氧化制合成气性能的影响[J]. 物理化学学报, 2008, 24(12): 2165–2171. |
| [17] |
Wei Y, Wang H, Li Kong Z. Ce-Fe-O mixed oxide as oxygen carrier for the direct partial oxidation of methane to syngas[J].
Journal of Rare Earths, 2010, 28(4): 560–565. DOI: 10.1016/S1002-0721(09)60154-X. |
| [18] |
Helveg S, Lopez-Cartes C, Sehested J, et al. Atomic-scale imaging of carbon nanofibrie growth[J].
Nature, 2004, 427: 426–429. DOI: 10.1038/nature02278. |
| [19] |
Larsen J H, Chorkendorff Ib. From fundamental studies of reactivity on single crystals to the design of catalysts[J].
Surface Science Reports, 1999, 35(5-8): 163–222. DOI: 10.1016/S0167-5729(99)00009-6. |
| [20] | 井强山, 方林霞, 楼辉, 等. CH4/C3H8 部分氧化-CO2 重整反应 的积碳研究[J]. 石油化工, 2008, 37(4): 338–343. |
| [21] | 陈吉祥, 王日杰, 李玉敏, 等. Ni 基气凝胶催化CH4-CO2 重整制 合成气反应的研究ΙΙΙ.影响催化剂积碳性能因素的探讨[J].燃料 化学学报,2002,30(5):448-453. |
| [22] | 史克英, 徐恒泳, 张桂玲, 等. 天然气-二氧化碳-水蒸气-氧转化制 合成气的研究-稀士助剂的作用[J]. 催化学报, 2002, 23(1): 15–18. |
| [23] |
Claridge J B, Green M L H, Tsang S C. A study of carbon deposition on catalysts during the partial oxidation of methane to synthesis gas[J].
Catalysis Letters, 1993, 22(4): 299–305. DOI: 10.1007/BF00807237. |
| [24] | 贾庆超, 高琳, 胡捷, 等. 膜反应器中甲烷催化部分氧化制 合成气Ni/ZrO2 积炭的研究[J]. 河南大学学报:自然科学版, 2007, 37(1): 31–34. |
| [25] | 严前古, 吴廷华, 李基涛, 等. Ni/Al2O3 催化上甲烷部分氧化制合 成气反应积炭的研究[J]. 应用化学, 1999, 16(4): 20–23. |
| [26] | 李春义, 余长春, 沈师孔. CO 在Ni/Al2O3 催化剂上的歧化和氧化 反应[J]. 催化学报, 1998, 19(5): 463–466. |
| [27] |
Bengaard H S, NΦrskov J K, Sehested J, et al. Steam reforming and graphite formation on Ni catalysts[J].
Journal of Catalysis, 2002, 209(2): 365–384. DOI: 10.1006/jcat.2002.3579. |
| [28] |
Nakano H, Kawakami S, Fujitani T, et al. Carbon deposition by disproportion- nation of CO on a Ni (977) surface[J].
Surface Science, 2000, 454: 295–299. |
| [29] |
Fleming P J, Cossutta W, Jackson P J. Carbon deposition in the catalytic partial oxidation of mathane to synthesis gas[J].
Studies in Surface Science and Catalyis, 1994, 81: 321–324. DOI: 10.1016/S0167-2991(08)63888-4. |
| [30] |
Rostrup Nielsen J R, Bak Hansen J H. CO2 reforming of methane over transition metals[J].
Journal of Catalysis, 1993, 144(1): 38–49. DOI: 10.1006/jcat.1993.1312. |
| [31] | 吴延华, 李少斌, 严前古. Ni 与Al2O3 相互作用对甲烷部分氧 化制合成气Ni/Al2O3 催化剂上积炭性能的影响[J]. 催化学报, 2001, 22(5): 501–504. |
| [32] |
Wang H Y, Ruckenstein E. Partial oxidation of mathane to synthesis gas over alkaline earth oxide supported cobalt catalysts[J].
Journal of Catalysis, 2001, 199(2): 309–317. DOI: 10.1006/jcat.2001.3190. |
| [33] | 张翔宇, 李振花. 甲烷部分氧化制合成气催化剂的研究进展[J]. 化 工进展, 2002, 21(12): 903–907. |
| [34] | 尚丽雯, 谢卫国, 吕绍洁, 等. 添加碱金属对甲烷与空气制合成气 的催化性能的影响[J]. 分子催化, 2002, 16(1): 31–34. |
| [35] | 廖卫兵, 曹小华. MgO 助剂对CH4/CO2 重整反应Ni/BaTiO3 催化 10 有色金属科学与工程 2012 年 4 月 剂性能的影响[J]. 化工进展, 2008, 27(5): 724–728. |
| [36] |
Chen L, Lu Y, Hong Q, et al. Catalytic partial oxidatin of methane to syngas over Ca-decorated-Al2O3-supported Ni and NiB catalysts[J].
Applied Catalysis A:General, 2005, 292: 295–304. DOI: 10.1016/j.apcata.2005.06.010. |
| [37] | 王锐. CH4/CO2 重整反应中Rh 基催化剂上CeO2 的助剂作用研 究[D].大连:中国科学研究院研究生院,2007. |
| [38] |
Souza M, Schmal M. Autothermal reforming of methane over Pt/ZrO2/Al2O3 catalysts[J].
Applied Catalysis A:General, 2005, 281(1/2): 19–24. |
| [39] |
Cao L X, Chen Y X, Li W Z. Effect of La2O3 added to Ni/ Al2O3 catalyst on partial oxidation of methane to syngas[J].
Studies in Surface Science and Catalysis, 1997, 107: 467–471. DOI: 10.1016/S0167-2991(97)80378-3. |
| [40] | 刘淑红, 李文钊, 徐恒泳, 等. 助剂CuO 和La2O3 对NiO/α-Al2O3 甲烷催化部分氧化制合成气引发过程的影响[J]. 燃料化学学报, 2009, 37(2): 227–233. |
| [41] |
Choudhary V R, Rajput A M, Prabhakar B. Partial oxidation of methane to CO and H2 over nickel and/or cobalt containing ZrO2, ThO2, UO2, TiO2 and SiO2 catalysts[J].
Fuel, 1998, 77(15): 1803–1807. DOI: 10.1016/S0016-2361(98)00072-6. |
| [42] |
Quincoces C E, Vargas S P, Grange P, et al. Role of Mo in CO2 reforming of CH4 over Mo promoted Ni/Al2O3 catalysts[J].
Materials Letters, 2002, 56(5): 698–704. DOI: 10.1016/S0167-577X(02)00598-0. |
| [43] | 张军, 赵宁, 肖福魁, 等. NiMgAlO-F 催化剂的物化性能 及其在甲烷部分氧化制合成气中的应用[J]. 石油化工, 2010, 39(12): 1319–1325. |
| [44] |
Nakagawa K, Ikenaga N, Suzuki T, et al. Partial oxidation of methane to synthesis gas over supported iridium catalysts[J].
Applied Catalysis A, 1998, 169(2): 281–290. DOI: 10.1016/S0926-860X(98)00020-9. |
| [45] | 王锐, 刘雪斌, 陈燕馨, 等. 金属-载体相互作用对CH4/CO2 重 整反应中Rh 基催化剂抗积炭性能的影响[J]. 催化学报, 2007, 28(10): 865–869. |
| [46] |
Hu Y H, Ruckenstein E. Binary MgO-based solid solution catalysts for methane conversion to syngas[J].
Catalysis Reviews, 2002, 44(3): 423–453. DOI: 10.1081/CR-120005742. |
| [47] | 杨继海, 王一平, 郭翠梨, 等. NiO/La2O3 催化剂上甲烷催化部分 氧化制合成气的研究[J]. 分子催化, 2006, 20(6): 530–534. |
| [48] |
Seo H J, Yu E Y. Partial oxidation of methane to syngas over Rh and Ni catalysts impregnated on CeO2,SiO2,and Al2O3[J].
Journal of Industrial and Engineering of Chemistry, 2005, 11(5): 681–687. |
| [49] | 余长林, 徐恒泳, 陈喜蓉, 等. PtZn-Sn/SBA-15 合成?表征及对丙 烷催化脱氢性能[J]. 燃料化学学报, 2010, 38(3): 308–312. |
| [50] |
Yu C L, Xu H Y, Ge Q J, et al. Effects of Ce addition on the Pt- Sn/γ -Al2O3 catalyst for propane dehydrogenation to propylene[J].
Applied Catalysis, 2006, 315: 58–67. DOI: 10.1016/j.apcata.2006.08.038. |
| [51] |
Yu C L, Xu H Y, Ge Q J, et al. Characterization of the metallic phase of Zn-doped Pt and Pt-Sn catalysts for propane dehydrogenation[J].
Molecular Catalysis A, 2007, 266: 80–87. DOI: 10.1016/j.molcata.2006.10.025. |
| [52] | 李凝, 陈俭省, 蒋锡福, 等. NiO-ZrO2-Al2O3 催化剂的制备方 法对其催化性能的影响[J]. 精细石油化工, 2010, 27(6): 34–38. |
| [53] | 陈娟荣. Ni-Co 双金属催化剂的制备及其在CO2 重整CH4 反应中 的催化性能研究[D]. 南昌:南昌大学, 2006. |
| [54] | 刘树强, 宋月芹, 贺德华, 等. Cr2O3 催化剂上甲烷部分氧化制合成 气[J]. 高等学校化学学报, 2009, 30(1): 106–112. |
| [55] | 季亚英, 李文钊, 徐恒泳. 不同前驱物对Ni 催化剂上甲烷部分氧 化制合成气反应的影响[J]. 催化学报, 2000, 21(5): 415–418. |
| [56] | 邓存. 助剂对负载型催化剂重整活性和抗积炭性能的影响[J]. 燃料化学学报, 2000, 28(2): 124–128. |
| [57] | 邱业君, 陈吉祥, 张继炎. CeO2?CaO 助剂对甲烷部分氧化制合 成气Ni/MgO-Al2O3 催化剂结构和性能的影响[J]. 燃料化学学报, 2007, 35(1): 85–89. |
| [58] | 杨咏来, 徐恒泳, 李文钊. CeO2 和Pd 在Ni/γ-Al2O3 催化剂中的 助剂作用[J]. 物理化学学报, 2002, 18(4): 321–325. |
| [59] | 石芳丽. 铈锆对甲烷部分氧化制合成气钯催化剂催化性能的影 响[D].天津:天津大学,2007. |
| [60] | 王磊, 曾少华, 张丽娟, 等. La0.75Sr0.25Mn1-xNixO3+δ 材料的制备及 其催化甲烷部分氧化性能[J]. 催化学报, 2009, 30(3):247-253. |
| [61] |
Salazar M, Berry D A, Gardner T H, et al. Catalytic partial oxidation of methane over Pt/ceria-doped catalysts: Effect of ionic conductivity[J].
Applied Catalysis A:General, 2006, 310: 54–60. DOI: 10.1016/j.apcata.2006.05.018. |
| [62] |
Provendiera H, Petita C. Stabilization of active nickel catalysts in partial oxidation of methane to synthesis gas by iron addition[J].
Applied Catalysis A:General, 1999, 180(1/2): 163–173. |
| [63] | 李孔斋, 王华, 魏永刚, 等. 铈基复合氧化物中晶格氧用于甲 烷部分氧化制合成气[J]. 燃料化学学报, 2008, 36(1): 83–88. |
 2012, Vol. 3
2012, Vol. 3
