| 高温含水条件下非氧化物材料的反应行为 |
b. 北京科技大学,冶金与生态工程学院,北京 100083
b. School of Metallurgical and Ecological Engineering, University of Science and Technology Beijing, Beijing 100083, China
非氧化物材料由于具有良好的抗腐蚀和耐高温的特性,在高温领域如航空、航天领域,冶金领域等越来越受到重视并得到日益广泛的应用[1-2].在通常条件下,非氧化物材料在高温下使用时会在其表面生成一层致密的氧化物层,这层氧化物层阻碍了氧化的进一步进行,使得材料具有优异的抗氧化性能[3-4].然而在实际应用中,材料常常是在高温含水的环境下使用.例如,在燃烧环境下(如燃气涡轮机、往复式发动机、垃圾焚化炉等)都会产生水蒸汽,尤其在使用生物燃料时,产生水蒸汽的含量更高[5].在冶金工业,炼铁高炉中,通入的煤气裂解同样会产生水蒸汽的环境.在这种条件下,氧化产生的保护性氧化物层会与水蒸汽发生反应,生成具有挥发性的物质,使得材料失去原有的性能[6-9].研究指出当挥发性气体产物的平衡分压≥10-7MPa 时,非氧化物材料的使用寿命会受到影响并引起材料失效[10],因此研究材料在高温含水条件下的反应行为显得十分重要.
针对高温含水条件下非氧化物材料的反应问题,对已有的研究现状进行分析和比较,并结合材料在此种条件下的反应影响因素及反应机理指出了高温含水条件下材料反应研究存在的问题.
1 高温含水条件下非氧化物材料的反应 1.1 热力学研究在纯氧或者空气气氛下,非氧化物材料表面与氧气反应生成一层氧化物层,氧气需通过这层氧化物层才能继续与材料反应.相比之下,非氧化物材料在高温含水条件下的反应则要复杂很多[11-14],由于水蒸汽也可作为氧化剂存在,因此需要考虑反应过程中水蒸汽和氧气与材料发生反应的先后顺序及其反应行为.
Y.Q.Li 和T.Qiu[15]通过热力学计算得出B4C 分别与O2和H2O 的反应Gibbs 自由能的变化,结果如图 1(a)所示.从图 1(a)中可以看出这些反应的Gibbs自由能均为负值,说明从热力学角度这些反应均可能发生,且反应式(1)即材料和氧发生反应的可能性最大.同时他们还指出水蒸汽参与反应与否与其分压有关,当分压≤10-3MPa 时,水蒸汽不参加反应.
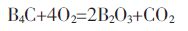
|
(1) |

|
(2) |

|
(3) |

|
(4) |

|
(5) |
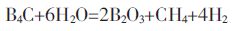
|
(6) |
J.Opila[16]等在研究SiC 的氧化行为时考虑了水和O2对反应的影响,实验结果表明O2和水蒸汽为主要的氧化剂[17].当仅考虑热力学因素时,从图 1(b)中 Gibbs 自由能的变化可以看出.3 个反应都可能发生且反应式(7)即材料和氧发生反应的趋势最大.
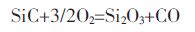
|
(7) |

|
(8) |

|
(9) |
在文献研究的基础上,对BN 和B2O3与水蒸汽反应的热力学数据进行了计算,如图 1(c)所示.可以看出,水蒸汽与BN 反应的Gibbs 自由能差呈正增长的趋势,而与B2O3的Gibbs 自由能差值呈负增长的趋势.说明在反应过程中,水蒸汽与B2O3发生反应的趋势最大.
 |
| 图 1 非氧化物材料与水蒸汽反应的Gibbs 自由能变化 |
经过以上热力学分析,可以看出非氧化物在高温含水条件下的反应要经历如下两个步骤: ①非氧化物先O2发生氧化反应; ②氧化产物再与水蒸汽发生反应.
1.2 反应动力学在热力学分析基础上,研究者针对非氧化物材料(主要集中于对SiC 和Si3N4基材料的研究[7, 18-21])在高温含水条件下的反应机理进行了动力学的研究.结果表明,反应过程受很多因素影响.
J.Opila[17]和Karren L.More[18]等考察了SiC 材料(热压烧结SiC 样块,CVD-SiC) 在高温含水条件下的反应行为,考察了温度(1000~1400 ℃)、水蒸汽分压(1~1.5 atm)及含量(10 %~90 %)等因素对材料反应行为的影响.图 2 是CVD-SiC 在1200 ℃含水条件下反应后产物的扫描电镜图,可以看到,含水蒸汽10 %的情况下,试样表面几乎无气泡产生,随着水蒸汽含量的增加,试样表面出现越来越多的气泡,在含水50 %以上,气泡数量明显增多.说明水蒸汽的含量对试样的反应过程有很大的影响,并且由于水蒸汽的存在产生了易挥发的物质,导致试样表面凹凸不平.
 |
| 图 2 1200 ℃下CVD SiC 在不同水分含量时的电镜图 |
图 3为SiC 在10 atm, 含水蒸汽12 %的条件下测得的不同温度下的热重曲线[7].从图 3 中可以看出,随着温度的升高,曲线的特征出现很大的差异:在温度≤1350 ℃时,由于挥发性物质的产生量很少,试样的反应增重曲线接近抛物线; 而当温度>1400 ℃时,由于氧化产物与水反应产生挥发性物质从而反应曲线有明显的下降趋势,1450 ℃时,反应曲线为完全失重,说明在此温度下氧化产物与水的反应占主导.
 |
| 图 3 不同温度下CVD SiC 热重曲线 |
以上研究表明非氧化物材料在高温含水条件下的反应行为比较复杂,受温度、水蒸汽含量及蒸汽压等因素的影响.然而材料的反应行为除了受上述因素影响外,还受升温速率、氧分压以及反应物形状等因素影响.由于目前研究体系比较分散,工作不系统,很少有文献对这些影响因素进行系统的研究,因此对于非氧化物材料在高温含水条件下的反应机理还没有统一的认识.
1.3 动力学模型非氧化物材料在高温含水条件下的氧化过程是一个增重和失重的混合过程.20 世纪60 年代,Tedmon[23]在研究金属Cr 及Cr-Fe 合金的氧化动力学时首次提出了氧化产物Cr2O3在高温(≥1000 ℃)下的挥发,并给出了一个全新的动力学模型,即抛物线-线性方程:
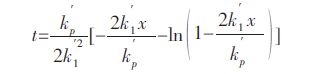
|
(10) |
式(10)中:t 为反应时间,x 为氧化产物层的厚度,kp′为抛物线方程常数,k1′为线性方程常数.随着反应时间的延长,氧化产物层的厚度成为一个常数,其值为 kp′ / k1′ .该模型考虑了产物的挥发对氧化过程的影响,在研究氮化物基非氧化物在高温含水条件下的氧化动力学时,国内外很多研究者采用该模型来处理非氧化物材料在高温含水条件下的反应数据[1, 7, 18, 24-26].
以上模型将反应分数简单的表达为反应时间的关系,只能描述单一曲线,然而实际的反应过程受多种因素影响(温度、压力、水分含量等),该模型无法将这些影响因素同时考虑,因此表达式的参数物理意义不明确,理论研究和实际指导的意义不大.
2 分析与展望根据文献研究,目前对非氧化物材料在高温含水条件下的反应研究还存在一些问题,主要表现在实验和理论两方面.
(1)实验装置方面.实验的关键是精确控制反应气氛中水分的含量,这是探索非氧化物材料在含水条件下反应规律和机理的重要依据.J.Opila 等[17]研究 CVDSiC 在含水条件下的反应动力学时,建立了一套水蒸汽发生装置,如图 4 所示.该装置可以控制水蒸汽的含量.图 4 中第1 部分主要产生水蒸汽,在第2部分水蒸汽达到饱和,再通入反应炉中.图 4 中3 个温度之间的关系是:T3>T1>T2.通过改变T2的温度可得到不同的饱和水蒸汽压值,进而可以算出水蒸汽的含量.这种方法对设备尤其是恒温水浴锅控温精确度要求比较高,另外不能直接测量水蒸汽含量.
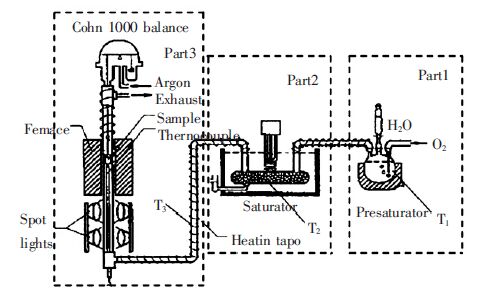 |
| 图 4 水蒸汽条件下反应装置图 |
J.Opila[21]在此基础上对上述实验装置进行了改进,该方法利用蠕动泵控制液态水的流量,控制水出口处温度≥200 ℃,确保液态水流出时直接被汽化.用此方法可以控制水蒸汽的流量,并且设备结构比较简单,但是试验中用卧式炉代替竖式炉,不能利用热天平在线测量试样的重量变化,实验结果的精度存在一定的偏差,另外,该装置中氧气和水蒸汽混合的均匀程度有待考量.
因此,有必要改进现有的设备,建立一套水蒸汽发生装置,使实验中水蒸汽压力和流量及其含量可精确控制,这将是以后深入系统研究高温含水条件下非氧化物材料反应行为的重要条件.
(2)实验研究方面.在实验研究对象的选择方面.SiC 和Si3N4基材料是目前研究工作的重点,但是这类材料的反应温度较高(≥1200 ℃),并且实验受水分和温度的影响比较大,随着水分和温度的变化其反应产物和机理也发生变化,因此在相同的实验条件下实验的重复性差.如J.Opila [21] 观察了1400 ℃下 SiC 在H2O/O2混合气体(含水10 %和含水90 %)中反应的实验结果,发现均符合抛物线规律,并且这一结果在1200 ℃下同样可以观察到,于是他认为1200 ℃以上产物的挥发速率可以忽略不计,动力学曲线符合抛物线方程.然而,Narushima [25] 等认为在1550~1650 ℃下SiC 在H2O/O2中的反应符合抛物线-直线方程.
此外,在实验方面,实验中虽然采用了原位测量手段和技术,如用热重分析(TG) 在线测量试样( 如 SiC、Si3N4等)质量的变化[7, 18]、采用气体质谱仪(MS)手段在线测试试样(如B4C)在反应过程中气体成分的变化等[27],但文献研究的内容比较分散且不系统,尤其对于SiC 和Si3N4基以外的体系更是如此.因此需要进行更全面更完善的实验来研究材料的性状、气体含量、流速等对实验结果的影响,结合热力学计算结果,从而对高温含水条件下非氧化材料反应行为有一个清晰全面的认识.
(3)理论方面.通过以上热力学分析,对高温含水条件下非氧化物材料的反应机理有一个初步的认识,即非氧化物层首先被O2氧化生成一层氧化物层保护膜;在水蒸汽存在的条件下,这层氧化膜与水蒸汽发生反应生成挥发性物质,使得氧化层变薄,从而推进了反应的进一步进行.然而通过实验研究,知道高温含水条件下非氧化物材料的反应受很多因素如水分含量、温度、试样的尺寸等因素的影响,对其反应机理的了解仍需要进行大量的研究工作.
在动力学研究方面,目前文献中大多采用抛物线或者抛物线-直线方程来进行处理,这些模型自20 世纪60 年代沿用至今,将反应分数简单的表达为反应时间的关系,而实际的反应过程受多种因素影响,除了受到水分和温度的影响外,还有样品的形状、气体流速、升温速率等的影响.因此现有的抛物线-线性模型中表达式只能描述单一曲线,无法将这些影响因素同时考虑,参数物理意义不明确.因此,需要建立新的动力学模型,此模型不仅能定量描述材料的反应行为和各种影响因素之间的关系,而且参数的物理意义明确.
3 结束语文章概述了非氧化物材料在高温含水条件下的反应问题的重要性、研究现状及存在的问题.通过前人工作的积累,特别是我国科研工作者近年来的杰出工作,非氧化物材料在高温含水条件下的反应问题已经到了深入研究的破发点.因此,进一步对高温含水条件下非氧化物材料的反应进行深入系统的研究,探讨反应行为和各种影响因素之间的关系,在此基础上建立动力学模型,这将是科研工作者以后的研究重点.
| [1] |
Opila E J, Hann Jr R E. Paaralinear oxidation of CVD SiC in water va- por[J].
J Am Ceram Soc., 1997, 80(1): 197–205. DOI: 10.1111/j.1151-2916.1997.tb02810.x. |
| [2] | 甄强, 李文超. 水平连铸用分离环的研究现状[J]. 耐火材料, 1998, 32(4): 234–237. |
| [3] |
Sheehan J E. Paassive and active oxidation of hot-pressed silicon ni- tride materials with two magnesia contents[J].
J Am Ceram Soc., 1982, 65(7): c111–c113. DOI: 10.1111/jace.1982.65.issue-7. |
| [4] | 张其土. Si3N4 陶瓷材料的氧化行为及其抗氧化研究[J]. 陶瓷学报, 2000, 21(001): 23–27. |
| [5] |
Brady M P, Fayek M, Keiser J R, et al. Wet oxidation of stainless steels: New insights into hydrogen ingress[J].
Corros Sci., 2011(53): 1633–1638. |
| [6] |
Jacobson N, Myers D, Opila E, et al. Interactions of water vapor with oxides at elevated temperatures[J].
J Phys Chem Solids., 2005, 66(2- 4): 471–478. |
| [7] |
Smialek J L, Robinson R C, Opila E J, et al. SiC and Si3N4 recession due to SiO2 scale volatility under combustor conditions[J].
Adv Com- pos Mater., 1999, 8(1): 33–45. DOI: 10.1163/156855199X00056. |
| [8] |
Jacobson N S, Morscher G N, Bryant D R, et al. High - Temperature oxidation of boron nitride: II, boron nitride layers in composites[J].
J Am Ceram Soc., 1999, 82(6): 1473–1482. |
| [9] |
Meschi D J, Chupka W A, Berkowitz J. Heeterogeneous reactions studied by mass spectrometry. I. reaction of B2O3 (s) with H2O(g)[J].
J Chem Phys., 1960, 33(2): 530–533. DOI: 10.1063/1.1731179. |
| [10] |
Opila E J, Jacobson N S, Myers D L, et al. Predicting oxide stability in high-temperature water vapor[J].
J Miner Metal Mater Soc., 2006, 58(1): 22–28. DOI: 10.1007/s11837-006-0063-3. |
| [11] |
Streletskii A N, Permenov D G, Bokhonov B B, et al. Mechanochemistry of hexagonal boron nitride. 2. Reactivity upon interaction with water[J].
Colloid J., 2010, 72(4): 553–558. DOI: 10.1134/S1061933X10040174. |
| [12] |
Ramasamy S, Tewari S N, Lee K N, et al. Slurry based multilayer environmental barrier coatings for silicon carbide and silicon nitride ceramics-II. Oxxidation resistance[J].
Surf Coat Technol., 2010, 205(2): 266–270. DOI: 10.1016/j.surfcoat.2010.07.048. |
| [13] |
Hong Z, Cheng L, Zhang L, et al. Water vapor corrosion behavior of scandium silicates at 1400 ° C[J].
J Am Ceram Soc., 2009, 92(1): 193–196. DOI: 10.1111/jace.2009.92.issue-1. |
| [14] |
Kocjan A, Dakskobler A, Krnel K, et al. The course of the hydroly- sis and the reaction kinetics of AlN powder in diluted aqueous sus- pensions[J].
J Eur Ceram Soc., 2011, 31: 815–823. DOI: 10.1016/j.jeurceramsoc.2010.12.009. |
| [15] |
Li Y Q, Qiu T. Oxxidation behaviour of boron carbide powder[J].
Mater. Sci. Eng., A, 2007, 444(1-2): 184–191. DOI: 10.1016/j.msea.2006.08.068. |
| [16] |
Opila E J, Smialek J L, Robinson R C, et al. SiC recession caused by SiO2 scale volatility under combustion conditions: II, thermody- namics and gaseous - diffusion model[J].
J Am Ceram Soc., 1999, 82(7): 1826–1834. DOI: 10.1111/jace.1999.82.issue-7. |
| [17] |
Opila E J, Nguyen Q G N. Oxxidation of chemically - vapor - de- posited silicon carbide in carbon dioxide[J].
J Am Ceram Soc., 1998, 81(7): 1949–1952. |
| [18] |
More Karren L. Oxxidation kinetics of chemically vapor - deposited silicon carbide in wet oxygen[J].
J Am Ceram Soc., 1994, 77(3): 730–736. DOI: 10.1111/jace.1994.77.issue-3. |
| [19] |
Robinson R C, Smialek J L. SiiC recession caused by SiO2 scale volatility under combustion conditions: I, experimental results and empirical model[J].
J Am Ceram Soc., 1999, 82(7): 1817–1825. DOI: 10.1111/jace.1999.82.issue-7. |
| [20] |
Yin X, Cheng L, Zhang L, et al. Oxidation behaviors of C/SiC in the oxidizing environments containing water vapor[J].
Mater Sci Eng., A., 2003, 348(1-2): 47–53. DOI: 10.1016/S0921-5093(02)00644-5. |
| [21] |
Opila E J. Vaariation of the Oxidation rate of silicon carbide with water-vapor pressure[J].
J Am Ceram Soc., 1999, 82(3): 625–636. |
| [22] |
More K L, Tortorelli P F, Ferber M K, et al. Observations of acceler- ated silicon carbide recession by oxidation at high water - vapor pressures[J].
J Am Ceram Soc., 2000, 83(1): 211–213. DOI: 10.1111/jace.2000.83.issue-1. |
| [23] |
Tedmon Jr C S. Thhe effect of oxide volatilization on the oxidation ki- netics of Cr and Fe-Cr alloys[J].
J Electrochem Soc., 1966, 113(8): 766–768. DOI: 10.1149/1.2424115. |
| [24] |
Fox D S, Opila E J, Nguyen Q G N, et al. Paralinear oxidation of silicon nitride in a water-vapo r/oxygen environment[J].
J Am Cer- am Soc., 2003, 86(8): 1256–1261. DOI: 10.1111/jace.2003.86.issue-8. |
| [25] |
Narushima T, Goto T, Iguchi Y, et al. High - temperature oxidation of chemically vapor - deposited silicon carbide in wet oxygen at 1823 to 1923 K[J].
J Am Ceram Soc., 1990, 73(12): 3580–3584. DOI: 10.1111/jace.1990.73.issue-12. |
| [26] |
Jacobson N, Farmer S, Moore A, et al. High - temperature oxidation of boron nitride: I, monolithic boron nitride[J].
J Am Ceram Soc., 1999, 82(2): 393–398. |
| [27] |
Steinbrück M. Oxxidation of boron carbide at high temperatures[J].
J Nucl Mater, 2005, 336(2-3): 185–193. DOI: 10.1016/j.jnucmat.2004.09.022. |
 2012, Vol. 3
2012, Vol. 3

