| 酸性萃取剂负载Cr (Ⅲ)的碱反萃取研究 |
含铬资源的回收有溶剂萃取、化学沉淀、微生物以及电解等方法,其中溶剂萃取法具有操作简单、易连续操作、分离效率高等优点,广泛地应用于工业生产中.目前,溶剂萃取法回收Cr(Ⅲ)的研究较多,主要集中在酸性萃取剂D2EHPA (P204)[1-3], Cyanex272[4], Cynaex302[5], H2MEHP[6]萃取Cr(Ⅲ)工艺研究,D2EHPA的萃取Cr(Ⅲ)机理[7]及陈化特性[8]研究,Cr(Ⅲ)在萃取剂中的缩合反应[9-12]研究,研究的重点集中在铬的萃取分离,未对负载铬的有机相进行系统的反萃取行为研究;研究过程中采用的反萃取剂均为酸,但酸反萃Cr(Ⅲ)不完全,尤其是负载有机相存放时间越长越难反萃.萃取法回收含镍电镀污泥的生产实践表明,用酸再生负载铬的有机相困难或再生不完全,造成有机相萃取能力下降甚至失效,即使采用高酸反萃,失效的有机相亦不能再生,给企业造成极大的经济损失.
本文根据铬在不同酸性环境中与OH-络合形态的差别,以常用的酸性萃取剂P204和P507为研究对象,进行了碱反萃取负载Cr(Ⅲ)有机相实验研究.
1 实验 1.1 实验原理酸性萃取剂P204, P507是一元弱酸HR,萃取金属元素离子时其中含有的H+基团先被皂化基团替换,皂化基团再被金属元素离子替换,金属元素离子占有原先的H+基团位置.Cr(Ⅲ)易萃,但难反萃,低酸很难达到反萃取效果,即使高酸也难反萃完全.
Cr(Ⅲ)在溶液pH<4时才存在,往Cr(Ⅲ)溶液中加入碱,首先生成灰绿色的Cr(OH)3沉淀,当碱过量时Cr(OH)3沉淀溶解生成亮绿色的[Cr(OH)4]-:

|
Cr(Ⅲ)在含有机膦酸的有机溶剂存在缩合反应[9-10],Cr(Ⅲ)与酸性萃取剂形成Cr(OH)[OP(OR)2O]2萃合物,则用碱反萃取可表示为

|
其中,R代表酸性萃取剂中去除羟基上的H后所有基团.
1.2 试剂50 %硫酸铬[Cr2(SO4)3,分析纯],P204(工业纯),P507(工业纯),正辛醇(分析纯),璜化煤油(工业纯),氢氧化钠(分析纯).
1.3 主要仪器KS型康氏振荡器,江苏中大仪器厂生产.
SHA-C数显水浴恒温振荡器,金坛市白塔金昌实验仪器厂生产.
DSG-Ⅲ型电感耦合等离子体发射光谱仪,上海泰伦仪器股份有限公司生产.
分液漏斗.
1.4 反萃取系统装置反萃取系统装置如图 1.
 |
| 1. SHC-C振荡器;2.分液漏斗;3.水浴池 图 1 反萃取系统装置图 |
1.5 实验方法
有机相负载铬:有机相组成为10 %萃取剂+10 %正辛醇+80 %璜化煤油,皂化剂为10 mol/L NaOH,将硫酸铬溶液与皂化后的有机相按相比(O/A)要求加入分液漏斗中,振荡、静置分相,测定水相铬的浓度,负载铬的有机相浓度由物料平衡计算得到.
负载有机相反萃:取负载铬的有机相,在分液漏斗中加入NaOH溶液,振荡,静置分相,测定反萃液中铬的浓度,计算反萃取率.
萃取分离后的萃余液及反萃取后的反萃液,采用电感耦合等离子体发射光谱仪(ICP-AES)来测定.
2 结果与讨论 2.1 碱浓度的选择常温下,将负载1.53 g/L Cr(Ⅲ)的P204、负载1.08 g/L Cr(Ⅲ)的P507分别用0.5、1、2、4 mol/L的氢氧化钠按相比(O/A)1:1进行反萃,振荡时间10 min,静止分层后,取反萃液化验分析,结果如图 2所示.
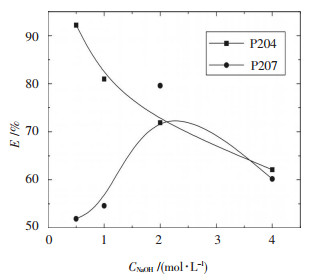 |
| 图 2 碱浓度与反萃取率E的关系 |
实验表明:①氢氧化钠的浓度高达4 mol/L时,铬的反萃取率反而较低,这是因为碱反萃取过程也即形成有机钠皂的过程,碱过量造成有机相深度皂化,过程中易形成油包水乳状液,使部分铬络阴离子被“包裹”于有机相中;②对于P204,反萃取率随氢氧化钠浓度的增加并没有增大,反而下降,当氢氧化钠浓度为0.5 mol/L时,一级反萃取率大于90 %,且反萃后的有机相清澈透明.但并不表明碱的浓度越低越好,实验中发现,当氢氧化钠浓度为0.2 mol/L时,反萃取时发生乳化现象,这主要是因为钠皂使有机相处于一种易于深入水相并易于与金属离子反应状态,皂具有比酸强得多的表面活性,使两相的分散能下降,当碱反萃进行时,反萃下来的铬离子与氢氧根先形成沉淀,当碱浓度低时沉淀溶解缓慢,所形成的固体颗粒便起到了乳化剂的作用;另外,碱浓度低也使有机相与水相比重差减小,不利于油水分相.因此,选择0.5 mol/L左右的氢氧化钠溶液作为负载铬的P204的反萃取剂;③对于P507,随碱浓度增大,反萃取率先升后降呈现峰值,在2 mol/L时达到最高.说明在低碱度条件下,P507负载的铬较P204负载的铬相对难反萃,这与采用酸反萃时P507负载的铬较P204负载的铬相对易反萃的结论刚好相反.因此,选用2 mol/L左右的氢氧化钠作为负载铬的P507的反萃取剂.
2.2 反萃取相比的确定实验分别考查了相比对负载1.27 g/L铬的P204与0.5 mol/L的NaOH溶液的反萃取和负载1.13 g/L铬的P507与2 mol/L的NaOH溶液的反萃取率的影响.负载有机相与NaOH溶液按一定的相比(O/A)加入分液漏斗中,室温,振荡10 min,静止分层,取样分析.结果如表 1所示.
| 表 1 相比与反萃取率的关系 |
 |
| 点击放大 |
由表 1可看出:①P204与P507的反萃取现象与效果相差较大,P507为萃取剂时在实验条件下的反萃取未出现乳化现象;②虽然P507的反萃取剂浓度高,但其反萃取率还是略低于P204为萃取剂时的反萃取率,再一次说明P507负载的铬相对难反萃;③当萃取剂为P204时,相比(O/A)减小,铬的反萃取率增加,但增加幅度不大;相比为3:1和2:1时,发生乳化.从实验结果以及节约成本考虑,反萃取相比O/A为1:1较适宜,其一级反萃取率超过90 %;④当萃取剂为P507时,随相比(O/A)减小,反萃取率先下降后上升,在O/A为1:1时出现低谷,反萃取率只有83.2 %;相比(O/A)越大,即相比O/A由1:1到3:1时,反萃取率越高,但相比太大时反萃液中形成大量的沉淀物,发生乳化不利于分相以及连续操作;相比越小,即相比O/A由1:1到1:3时,反萃率相反地增大,但反萃率提高的不明显;尽管相比为1:1时反萃取率最低,但分相快,因此选择相比O/A为1:1,此时,一级反萃取率也超过80 %.
2.3 温度对反萃取的影响不同温度下,负载铬1.52 g/L的P204和0.5 mol/L的氢氧化钠溶液,负载铬1.19 g/L的P507和2 mol/L的氢氧化钠溶液,分别按相比(O/A)1:1加入分液漏斗,振荡10 min,静止分层后,取反萃液化验分析,结果如表 2所示.
| 表 2 温度与反萃取率的关系 |
 |
| 点击放大 |
结果显示:①温度对反萃取反应产生一定的影响,随着温度的升高,反萃取率下降,说明碱反萃取过程可能放热,低温有利于反萃取反应的进行,综合考虑,萃取剂的再生以及负载物铬的回收安排在常温下进行;②相同或相近温度条件下,P507为萃取剂时的反萃取率要低于P204为萃取剂时的反萃取率.
2.4 反萃取时间的影响室温下,0.5 mol/L的氢氧化钠溶液与负载铬1.28 g/L的P204,2 mol/L的氢氧化钠溶液与负载铬1.18 g/L的P507,分别按相比(O/A)1:1加入到分液漏斗中,振荡一定时间后,静止分层,取反萃液化验分析,结果如图 3所示.
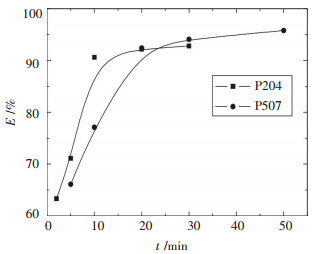 |
| 图 3 时间与反萃取率E的关系 |
图 3显示,随时间增加,反萃取率增大;当反萃取反应进行10 min以后,P204为萃取剂时的反萃率变化很小,说明碱反萃取负载铬的P204进行10 min即达到平衡,0.5 mol/L的氢氧化钠一级反萃取率可以达到90 %左右.而萃取剂为P507时,一级反萃取率达到90 %以上的反萃取反应时间则需20 min以上,该结果也说明表 2中P507为萃取剂时的反萃取率相对低的原因是反萃取时间不够造成的.
2.5 碱反萃取串级实验分别对负载Cr(Ⅲ)的P204和P507进行了碱反实验.负载铬1.39 g/L的P204,氢氧化钠溶液浓度为0.5 mol/L,相比O/A=1:1,振荡10 min,四级逆流反萃取;负载铬1.19 g/L的P507,氢氧化钠溶液浓度为2 mol/L,相比O/A=1:1,振荡20 min,四级逆流反萃取;结果如表 3所示.由表 3可见,经四级逆流反萃取后,铬的反萃取率均可达到98 %以上.
| 表 3 四级逆流反萃取Cr(Ⅲ)实验结果 |
 |
| 点击放大 |
3 结论
以氢氧化钠碱溶液为反萃取剂,对负载三价铬的P204和P507进行反萃取条件实验,获得了优化实验条件.
(1)碱反萃取P204负载铬有机相条件:0.5 mol/L氢氧化钠,相比O/A=1:1,常温,反萃取反应时间为10 min,四级逆流反萃取,反萃取率达到98.3 %.
(2)碱反萃取P507负载铬有机相条件:2 mol/L氢氧化钠,相比O/A=1:1,常温,反萃取反应时间为20 min,四级逆流反萃取,反萃取率达到98.8 %.
| [1] |
霍小平, 秦炜, 孙晓玮, 等. D2EHPA萃取回收Cr(Ⅲ)的研究[J].
高校化学工程学报, 2007, 21(5): 849–852.
|
| [2] |
祝万鹏, 杨志华. 溶剂萃取法回收电镀污泥中得有价金属[J].
给水排水, 1995, 21(2): 16–18.
|
| [3] |
祝万鹏, 叶波清. 溶剂萃取法提取电镀污泥氨浸出渣中的金属资源[J].
环境科学, 1998, 19(3): 35–38.
|
| [4] |
Pandey B D, Cote G, Bauer D. Extraction of Chromium (Ⅲ) from Spent Tanning Baths[J].
Hydrometallurgy, 1996, 40(3): 343–357. DOI: 10.1016/0304-386X(95)00006-3. |
| [5] |
Yu K, Peter S, Xue L Z. Extraction of Zinc and Chromium(Ⅲ) and Its Application to Treatment of Alloy Electroplating Wastewater[J].
Sep. Sci. Technol., 2003, 38(2): 405–425. DOI: 10.1081/SS-120016582. |
| [6] |
Khwajadbbp A R, Singh R, Tandon S N. Mono(2-ethylhexyl) Phosphoric Acid as an Extractant for Cr(Ⅲ) and Its Application to Industrial Waste[J].
Sep. Sci. Technol., 2000, 25(3): 447–455. |
| [7] |
Senthilnathan J, Mohan S, Palanivelu K. Recovery of Chromium from Electroplating Wastewater Using Di 2-(ethylhexyl)phosphoric Acid[J].
Sep. Sci. Technol., 2005, 40(10): 2125–2137. DOI: 10.1081/SS-200068492. |
| [8] |
秦炜, 薛亚卓, 霍小平, 等. 二(2-乙基已基)膦酸萃取Cr(Ⅲ)的陈化特性[J].
化学学报, 2009, 60(9): 2221–2225.
|
| [9] |
Nannelli P, Gillman H D, Block B P. Inorganic Coordination Polymers (XI): A New Family of Chromium(Ⅲ) Bis(phosphinate)polymers, [Cr (OH) (OPRRO)2]x[J]. J. Polym. Sci. Pol. Chem., 1971, 9(10): 3027-3038.
|
| [10] |
Finholt J E, Thompson M E, Connick R E. Hydrolytic Polymerization of Chromium (Ⅲ) (Ⅱ): A Trimeric Species[J].
Inorg. Chem., 1981, 20(12): 4151–4155. DOI: 10.1021/ic50226a024. |
| [11] |
Lanagan M D, Ibana D C. The Solvent Extraction and Stripping of Chromium with Cyanex 272[J].
Miner. Eng., 2003, 16(3): 237–245. DOI: 10.1016/S0892-6875(03)00006-2. |
| [12] |
大连理工大学无机化学教研室.
无机化学(第4版)[M]. 北京: 高等教育出版社, 2001: 531-533.
|
 2011, Vol. 2
2011, Vol. 2

