| Mo(W)-H2O系溶液化学行为研究 |
由于钨钼的原子半径、化学价态等物理化学性质极其相似,钨钼高效、深度分离已成为当前钨钼冶金迫切研究的瓶颈问题,同时也是钨钼冶金工业的一大难题.长期以来, 人们对钨钼分离进行了大量的研究,几乎当前所有的分离方法如沉淀法、溶剂萃取法、离子交换法、活性炭吸附法、液膜分离法等[1-3]均已用于钨钼的研究,但由于现有除钼工艺难以经济、高效地处理该类高钼资源,从而导致我国有相当比例的钨资源因含钼高而不能用作冶炼原料,大大缩短了我国钨钼资源的服务年限.本文在298 K温度下,通过W-H2O及Mo-H2O系电位-pH图的绘制,在一定pH水溶液中,分析MoO42-与WO42-溶液的化学行为.
1 Mo-H2O电位-pH图与W-H2O电位-pH图通过理论计算,绘制不同pH条件下的电位分布,从而可直观地分析钨钼在水溶液中化学反应的方向与可能性,以及生成物、生成物活度所组成的热力学方程,可直观地反映钨酸、钼酸以及同多酸杂多酸在不同pH条件下的热力学稳定区即优势区的存在形态.
1.1 热力学计算结果根据温度为298 K条件下Mo (W)-H2O体系中主要反应组份的热力学数据(文献[4-7]),归纳出体系中主要存在的电化学反应,并根据相关电化学公式导出了εT和pH的计算式,如表 1所示.
| 表 1 Mo-H2O和W-H2O体系中的化学反应及热力学平衡方程式 |
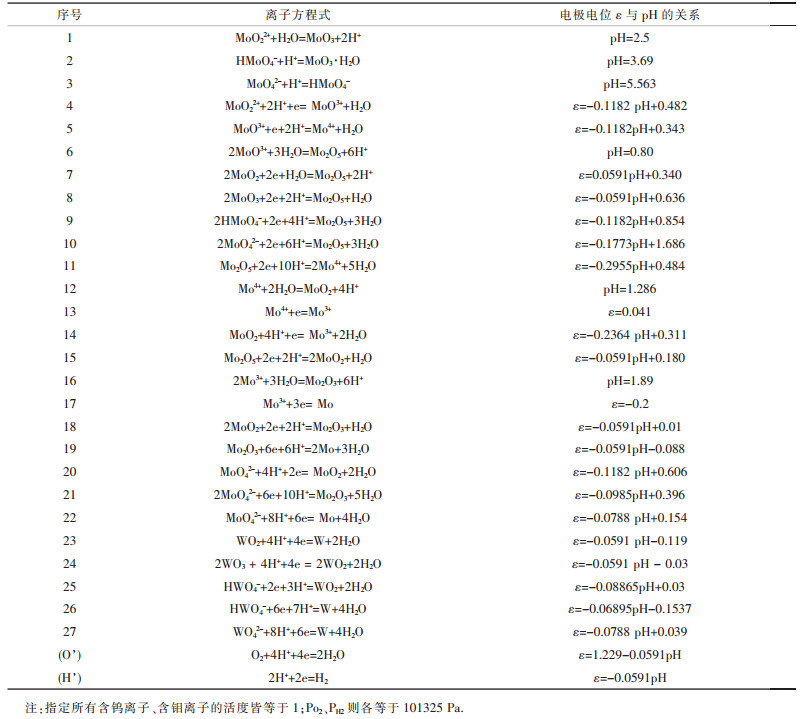 |
| 点击放大 |
1.2 Mo-H2O电位-pH图
根据表 1中主要的反应平衡式及电极电位计算式,可以作出如图 1所示的Mo-H2O系在温度为298 K下的电位-pH图.
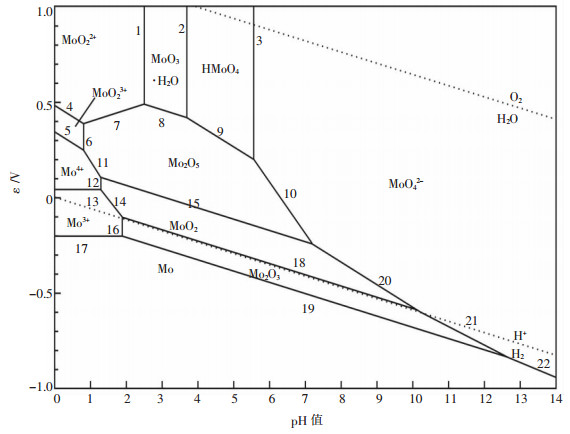 |
| 图 1 Mo-H2O系电位-pH图 |
1.3 W-H2O电位-pH图
根据表 1中主要的反应平衡式及电极电位计算式,可以做出如图 2所示的W-H2O系在温度为298 K下的电位-pH图.
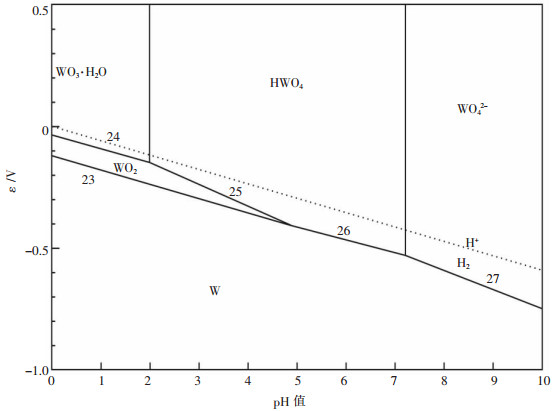 |
| 图 2 W-H2O电位-pH图 |
2 MoO42-与WO42-氧化性理论分析
在298 K的温度下,图 1可明确在常温时,在不同pH值和电位条件下钼体系水溶液中主要存在的可能离子形态,同时对钼同多酸以及杂多酸在酸性体系下各种形态有一个较为系统的说明.由图 1可知:
(1) 对钼酸盐溶液体系进行酸化,钼酸根将发生相应的转变过程.
文献[8]指出,在酸性溶液中MoO42-的聚合过程及与pH的关系可用图 3说明:
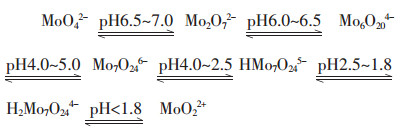 |
| 图 3 MoO42-的聚合过程的示意图 |
在图 1中,由于基本热力学数据的缺乏,平衡式1、2、3简化了图 3所示的MoO42-离子聚合过程,但对于钼酸盐溶液体系的酸化工艺仍有一定的指导意义.
(2) 对钼酸盐溶液体系进行还原,在不同的pH值条件下,还原的结果和难易程度不尽相同.
在碱性条件下,钼以MoO42-离子形态存在.由于其电位较低,因而其还原的难度最大,需要还原能力较强的还原剂才有对其进行还原的可能性.而且在还原时,分别在不同的pH值下以及采用不同还原能力的还原剂,得到如下各反应所示不同的还原产物:
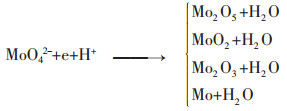
|
而在酸性条件下,钼以MoO22+离子形态存在.由于其电位较高,因而其还原的难度最低,还原能力较低的还原剂即可对其进行还原.在还原时,采用不同还原能力的还原剂,得到如下各反应所示不同的还原产物:
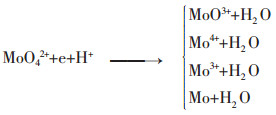
|
这说明,为了使还原过程能够顺利进行,同时使还原后的溶液产出符合要求的离子,必须事先选定好适当的pH值.
图 2可明确在常温时,在不同pH值和电位条件下钨体系水溶液中主要存在的可能离子形态.由图 2可知:
(1) 对钨酸盐溶液体系进行酸化,钨酸根将发生相应的转变过程.
文献[9]指出,将WO42-溶液进行酸化时,它的聚合过程及与pH的关系可用图 4说明:
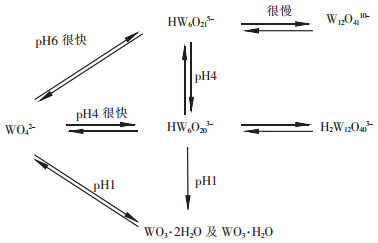 |
| 图 4 WO42-的聚合过程的示意图 |
在图 2中,由于基本热力学数据的缺乏,WO42-溶液的酸化过程简化了图 4所示的离子聚合过程,但其仍符合钨酸盐溶液酸化过程的基本规律.
(2) 随着酸化的进行,钨的离子形态发生相应变化,其电位呈逐步上升趋势.
在碱性条件下,钨以WO42-离子形态存在.由于其电位较低,因而其还原的难度最大,需要还原能力较强的还原剂才有对其进行还原的可能性.还原产物以W单质为主.而在酸性条件下,钨以沉淀物H2WO4形态存在.由于其电位较高,因而其还原的难度有所降低,依据还原剂还原能力的不同,还原产物以钨的各级氧化物以及W单质为主.
(3) 与Mo-H2O体系电位-pH图比较,W-H2O体系总体电位值低于Mo-H2O体系电位值.
这说明,在相同的溶液体系条件下,W-H2O体系比Mo-H2O体系更难还原,即六价钼比六价钨更容易被还原为低价态,从而可利用其性质的差异,选择适当的还原剂对W-H2O体系和Mo-H2O体系进行有差别的选择性还原,最终达到钨钼分离的目的.
3 结论通过热力学相关计算,归纳出相关的热力学数据与Mo-H2O系、W-H2O系反应平衡式及其εT和pH的计算式,并做出了Mo-H2O系与W-H2O系的电位-pH图.从而可直观的分析钨、钼在水溶液中化学反应的方向与可能性,以及各种形态物质在不同pH条件下的热力学稳定区,明确在不同pH值、电位条件下Mo-H2O系、Cu-H2O系相互作用的可能性以及相互作用后水溶液中主要存在的可能离子形态.主要结论有:
(1) 随着水相pH值的降低(酸化过程),钨、钼的离子形态都发生相应的聚合变化,其电位都呈现出逐步上升趋势,而其还原的难易度呈下降趋势.
(2) W-H2O体系总体电位值明显低于Mo-H2O体系电位值.即W-H2O体系比Mo-H2O体系更难还原,从而可利用其性质的差异,选择适当的还原剂对钨钼进行有差别的选择性还原.进而可利用还原态Mo盐区分于钨酸盐的物理化学性质,实现钨钼高效分离.
| [1] |
钟竹前, 梅光贵.
化学位图在湿法冶金和废水净化中的应用[M]. 长沙: 中南工业大学出版社, 1987.
|
| [2] |
李洪桂.
稀有金属冶金学[M]. 北京: 冶金工业出版社, 1990: 5.
|
| [3] |
刘旭恒, 孙放, 赵中伟. 钨钼分离的研究进展[J].
稀有金属与硬质合金, 2007, 35(4): 42–45.
|
| [4] |
吴维昌, 冯洪清, 吴天治, 等.
标准电极电位数位手册[M]. 北京: 科学出版社, 1991.
|
| [5] |
梁英教, 车荫昌.
无机热力学数据手册[M]. 沈阳: 东北大学出版社, 1993.
|
| [6] |
莫似浩.
钨冶炼的原理和工艺[M]. 北京: 轻工业出版社, 1984: 110-112.
|
| [7] |
傅崇说.
有色冶金原理(第2版)[M]. 北京: 冶金工业出版社, 1984: 11.
|
| [8] |
李洪桂.
有色金属提取冶金手册-稀有高熔点金属(上)[M]. 北京: 冶金工业出版社, 1999: 9-10.
|
| [9] |
马荣骏.
离子交换在湿法冶金中的应用[M]. 北京: 冶金工业出版社, 1991: 40-41.
|
 2011, Vol. 2
2011, Vol. 2
