| 乙二胺四乙酸络合滴定法连续快速测定高品位矿样中的铅锌 |
铅是对人体有害的元素, 因工业废水、汽车尾气等污染了环境, 影响了人的健康。因此有必要对环境水、生物样品中铅的含量进行快速分析。
用EDTA络合滴定法(乙二胺四乙酸简称为EDTA)测定高品位矿样中的铅, 需要将铅沉淀成PbSO4与其他元素分离, 分析手续较长, 在野外现场测试有些困难[1]。现介绍采用不经分离而加多种掩蔽剂的办法消除干扰, 在一份溶液中连续测铅和锌。KCN不络合Pb2+, 而络合Cd2+、Cu2+、Co2+、Hg2+、Ag2+等, 故可用KCN掩蔽这些离子; FE3+被抗坏血酸还原后被KCN掩蔽; 用NaF掩蔽Ca2+、Mg2+、Ag3+、Ti3+、Sn4+、FE3+等; 用三乙醇胺掩蔽Bi3+、Ti4+、Al3+、FE3+等。当EDTA滴定铅后, 被KCN掩蔽的Zn2+与KCN络合不稳定, 加入甲醛溶液, 氰根与甲醛生成氰醇, Zn2+被解蔽而释放出来, 其他离子中只有Cd2+和Ni2+也被解蔽, 再用EDTA滴定锌。该法适用于含Cd、Ni少的铅锌矿。样品中, Ca、Mg比较高, 加NaF生成CaF2和MgF2沉淀, 对Pb有吸附, 使铅的结果偏低, 同时, 锰在抗坏血酸还原时, 生成Mn2+, 它不被上述掩蔽剂掩蔽, 而干扰测定。此时, 可不加NaF, 先用EDTA滴定Ca、Mg、Pb、Mn的合量, 在甲醛解蔽锌, EDTA滴定锌之后, 加BAL或TGA置换Pb-EDTA中的EDTA再用Mg2+回滴。铅用EDTA滴定, 因铅的分子量大而灵敏度较低, 滴定铅要适当增加待测溶液的量。用EBT做指示剂, 与铅生成紫蓝色, 滴定终点为绿色, 终点不太好判断, 可以改用百里酚酞络合剂为指示剂, 它与铅生成红色, 终点接近无色, 容易判断, 但只适用于单独测铅, 不适用于连续测锌, 因为百里酚酞络合剂与锌的络合能力较强, Zn-百里酚酞络合剂中的Zn2+不易被解蔽而释放出来, 用EDTA滴定锌, 结果偏低。样品比较复杂, 使铅沉淀成PbSO4与其他杂质分离, 测定结果更为可靠[2-3]。一般的铅锌矿中, Cd、Ni、Mn等含量甚微, EDTA连测铅、锌仍为简单方便的方法。该方法适用于0.X%~ X%铅样品的测定。
1 实验部分 1.1 试剂铅标准贮存溶液:准确称取0.200 0 g铅粉, 加入(1+2)硝酸10 mL, 加热溶解, 移入100 mL容量瓶中, 用水稀释至刻度, 此溶液1mL相当于2 mg铅, 也可用光谱纯的Pb(NO3)2配制;
铅标准溶液:准确移取10.00mL铅标准贮存溶液于1L容量瓶中, 用水稀释至刻度, 此溶液1mL相当于20 μg铅;
锌标准贮存溶液:准确称取0.200 0g纯锌片, 加入10mL(1+1)盐酸, 加热溶解, 移入100 mL容量瓶中, 用水稀释至刻度, 此溶液1 mL相当于2 mg锌;
锌标准溶液:准确移取10.00 mL锌标准贮存溶液于1L容量瓶中, 用水稀释至刻度, 此溶液1mL相当于20 μg锌;
铬黑T(EBT)指示剂:称取0.5g EBT粉末溶于50 mL三乙醇胺中, 使用时取1mL加水9 mL, 混匀;
pH为10的缓冲溶液:称取7g NH4Cl溶于水, 加浓氨水57mL, 稀至100mL; 三乙醇胺溶液(1+4);
100g/L KCN溶液:称取10g KCN, 加几粒KOH固体, 溶于100 mL水中;
200 g/L酒石酸钾钠;
甲醛溶液(1+1):取甲醛溶液10 mL, 加甲醇10 mL, 混匀;
100 g/L氟化钠溶液;
100 g/L氢氧化钾溶液;
1g/L甲基红指示剂;
100 g/L硫代乙醇酸(TGA):取2 mL硫代乙醇酸加18 mL乙醇, 混匀;
1 g/L EDTA溶液;
0.2 g/L EDTA溶液。
EDTA的标定:准确移取10.00 mL锌标准溶液3~5份, 加入pH为10的缓冲溶液1 mL, EBT指示剂2滴, (1+4)三乙醇胺2滴, 200 g/L酒石酸钾钠2滴, 用1 g/L EDTA滴定至红色退去为终点, 记下EDTA体积V, 取几份测定的平均值, 计算EDTA对Zn的滴定度:
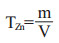
|
式中:TZn为1g/L EDTA对Zn的滴定度, mg/mL; m为吸取锌标准溶液所含锌的量, mg; V为测定时滴定所消耗1g/L EDTA标准溶液的体积, mL。1g/L EDTA对Pb的滴定度(TPb1):TPb1=TZn×3.169 2(mg/mL)(3.169 2是铅和锌原子量的比值)。
0.2 g/L EDTA对Pb的滴定度(TPb2):将上述滴定度TPb1除以5即可得。
1.2 实验步骤准确称取0.200 0 g矿样于100 mL烧杯中, 加盐酸5mL, 加热蒸至近干, 再加王水5 mL, 加热蒸干, 取下, 加10 mL盐酸加热溶解盐类, 将溶液转入50 mL容量瓶中, 用水稀释至刻度, 澄清。分取清液0.5 mL于10 mL小烧杯中, 加甲基红指示剂一滴, 100 g/L氢氧化钾中和至黄色, 加固体抗坏血酸约0.03 g, 200 g/L酒石酸钾钠3滴, (1+4)三乙醇胺3滴, 加缓冲溶液1mL, 100 g/L的氰化钾3滴, 摇匀, 将小烧杯于60~80℃水浴加热5 min, 使黄色褪去, 取下, 补加缓冲溶液0.5 mL, 100 g/L氟化钠溶液1滴, EBT指示剂2滴, 用0.2 g/L EDTA滴定至溶液蓝紫色变为绿色, 记下EDTA的体积V1。再加入甲醛3滴, 摇匀, 溶液转红以后, 快速用1 g/L EDTA滴定至红色褪去, 记下EDTA体积V2。
2 结果与讨论 2.1 结果计算:
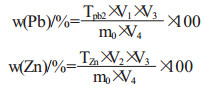
|
式中:w(Pb)/%为Pb的质量分数; w(Zn)/%为Zn的质量分数; TPb2为0.2 g/L EDTA对Pb的滴定度, mg/ mL; TZn为1 g/L EDTA对Zn的滴定度, mg/mL; m0为称取矿样重量, mg; V1为测定时滴定所消耗0.2 g/L EDTA标准溶液的体积, mL; V2测定时滴定所消耗1 g/L EDTA标准溶液的体积, mL; V3为样品分解后定容的体积, mL; V4为分取待测溶液的体积, mL。
2.2 抗坏血酸用量的影响实验结果表明, 加入10 mg抗坏血酸足够, 或配成10 g/L的溶液加5滴, 过少滴定无终点。
2.3 甲醛用量的影响实验结果表明, 应加入(1+1)甲醛0.1~0.4 mL为宜, 如果甲醛量加入太少, Zn2+置换不出来。
2.4 缓冲溶液用量的影响实验结果表明, 加入的缓冲溶液用量以1~2 mL为宜, 加热时NH3易挥发, pH降低, 氰化钾也易挥发, 故加热后需补充缓冲溶液和氰化钾。含钴、镍较多时, 氰化钾要多加几滴。
2.5 温度的影响加热温度一般控制在70℃左右为宜, 低于60℃滴定铅无终点。加热时间以黄色褪成无色为佳。
2.6 共存离子的影响在测定条件下, 共存离子的允许量为:Ag+、Cd2+、Ti4+ 25mg; FE3+、Ni2+、Ba2+ 5 mg; Hg2+、Ca2+、Mg2+、Bi3+ 10 mg; Co2+、V5+ 2 mg; Cu2+ 12 mg; Ti4+、Sr2+ 3 mg; Sn4+、As5+、Al3+ 15 mg; In3+ 3 mg不干扰测定。
3 样品分析利用上述方法, 对铅锌矿中的铅、锌分别进行了测定, 并与推荐值进行了对比, 相对标准偏差均在10%以内(结果参见表 1), 可满足野外现场快速测试的要求。
| 表 1 5种铅锌矿样品中铅锌的测定结果 n=4, w/% |
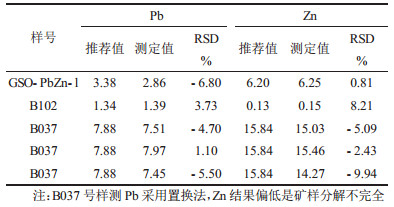 |
| 点击放大 |
4 小结
(1) 镍、镉也能被甲醛解蔽, 但解蔽的速度较慢, 甲醛解蔽锌后, 尽快滴定。
(2) 铅分子量较大, EDTA滴定的灵敏度较低, 可多分取溶液测定。Pb-EBT形成紫蓝色, 滴定终点为绿色, 终点不太好观察, 以空白溶液作参考确定终点, 或者改用百里酚酞络合剂为指示剂, 终点由红色褪至无色, 但不能测锌, 只能单独测铅。多分取溶液测定铅时, 用1g/L EDTA滴定。
(3) 钙、镁、锰较高时, 铅也可采用回滴法:取溶液滴定时, 不加氟化钠, 先用1g/L EDTA滴定至红色褪去, 滴定Ca、Mg、Mn、Pb合量, 可不计数。加甲醛解蔽锌, EDTA滴定锌后, 以百里酚酞络合剂为指示剂, 用50μg/mL的Mg2+滴定溶液至红色, 络合过量的EDTA可不计数, 加10%硫代乙醇酸5滴(或用BAL-二巯基丙醇), 置换Pb-EDTA络合物中的EDTA, 再用Mg2+滴定至红色为终点。滴定消耗镁的微克数乘8.525即为待测溶液中铅的微克数。(8.525为铅、镁原子量的比值)。
(4) 干扰元素较多时, 可采用溶矿时再加(1+1) H2SO410mL, K2SO42g, 加热冒烟, 沉淀PbSO4· K2SO4复盐, 加10mL乙醇促使复盐沉淀, 过滤, 用10g/L H2SO4、10g/L K2SO4混合溶液洗涤7~8次, 沉淀用pH为5.4的乙酸-乙酸钠缓冲溶液溶解, 二甲酚橙为指示剂, 1g/L EDTA滴定至亮黄色为终点, 单独测铅。
| [1] |
岩石矿物分析编写小组.
岩石矿物分析[M]. 北京: 地质出版社, 1991.
|
| [2] |
化学分离富集方法及应用编委会.
化学分离富集方法及应用[M]. 长沙: 中南工业大学出版社, 2000.
|
| [3] |
张孙伟, 吴水生, 刘绍璞.
有机试剂在分析化学中的应用[M]. 北京: 科学出版社, 1981.
|
 2007, Vol. 21
2007, Vol. 21
