| 草酸钴中钴的快速测定—电位滴定法 |
草酸钴是湿法冶炼钴纯度较高的产品之一,杂质含量低微,Co2+:C2O42-为1:1,在约80℃的3%~5% H2SO4溶液中,KMnO4与C2O42-定量反应:
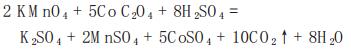
|
钴和共存微量杂质不影响测定,由于测定系统回路电阻基本不变,滴定至等当点时,电位和电流同时有较大而又明显的突跃,也可用自行组装的简易电流滴定计代替电位滴定仪,因此对该方法进行试验和制定相应的测定方法具有实际意义。目前常用在柠檬酸存在的氨性溶液中K3Fe(CN)6与Co2+定量反应的电位滴定法:
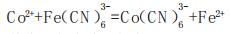
|
其标准电极电位E0Co和E0Fe分别为-0.83和+0.36V[1],在此氧化还原反应中,为防止Co2+被氧化,采用Co2+标准溶液反滴定过量的K3Fe(CN)6,其电极电位E遵守E=E0+0.0591 lg [氧化态]/[还原态]方程式,等当点前,E受[Fe(CN)63-)]/[Fe2+]控制,等当点后,E受[Co(CN)63-]/[Co2+]控制。因此试液含Co2+量愈大,电位突跃值愈小直至看不清,反之,突跃值增大,但取样品量少,这二者都会增大测定误差。
实验以测定C2O42-的量间接测知钴的量,电位(电流)在滴定的初始与结束,平稳地在等当点时出现突跃的前后,因为等当点前,Co2+、C2O42-、Mn2+及共存的微量杂质产生的导电电流很小,等当点后,控制电极电位(电流)是[Mn7+]/[Mn2+]的形成而产生较大的突跃后,再加入少许的Mn7+,突跃值的变化必然很小,从而达到实验预期的效果。
1 实验部分 1.1 主要仪器和试剂仪器:ZD-2型电位滴定仪(上海雷磁仪器厂),也可用自行组装的简易电流滴定计(见图 1)。
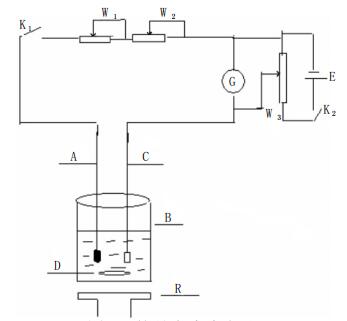 |
| 电位器—W1 470kΩ 1W、W2 50kΩ 1W、W3 100kΩ 1W;K1、K2—开关;G—检流计;灵敏度≈10-8A/格;A—甘汞电极217型;C—铂电极213型;B—烧杯;D—磁铁转子;R—电磁搅拌器;E—干电池1号,1.5V 图 1 简易电流滴定计 |
试剂:Na2C2O4(基准物质)。
KMnO4标准溶液:称取AR级KMnO4 9.48g,溶解于经煮沸冷却后的1L水中,混匀,干滤于棕色瓶中,避光放置两天。
标定:称取于105℃烘1h置于干燥器冷却至室温的Na2C2O4 0.4020g两份,分别置于300mL烧杯中,各加100mL 4% H2SO4溶液,加热至约80℃,趁热用KMnO4标准溶液滴定至微红色即为终点。
计算KMnO4标准溶液对Na2C2O4的滴定度(双份结果的平均值)TNa2C2O4,单位为mg/mL;对Co的滴定度TCo=TNa2C2O4× 0.4398mg/mL
1.2 实验方法称取经105℃烘干1.5h的CoC2O4·xH2O 0.5000~1.0000g于300mL烧杯中,加5% H2SO4溶液50mL,加热(勿沸)至完全溶解,加30mL水,加热至约80℃,插入电极,趁热用标准KMnO4溶液滴定至电位(电流)突跃即为终点。
2 结果与讨论 2.1 滴定曲线按1.2实验方法,KMnO4与C2O42-开始反应较慢,但随Mn2+的增加而加快,图形清晰(见图 2和图 3)。
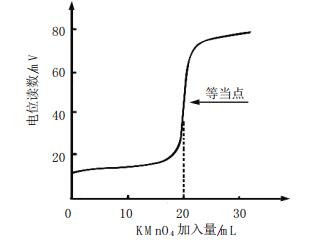 |
| 图 2 电位滴定曲线 |
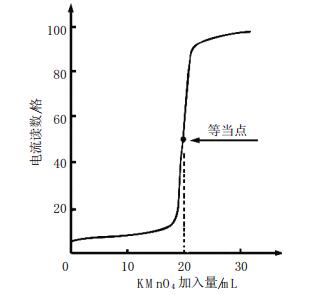 |
| 图 3 电流滴定曲线 |
试验表明,图形平稳清晰,突跃大,不受大量钴存在的影响。
2.2 最佳测定条件试验证明:试液含H2SO4低于1%,温度低于60℃时,KMnO4与C2O42-反应速度变慢。试液含H2SO4为3%~5%,温度为80~90℃最佳。
基准Na2C2O4不宜溶于水配成标准溶液后备用,当使用至瓶中充满空气的空间较大时,放置约一周后,浓度会略有降低,且随放置时间的增加会继续有稍微降低,这可能是与空气中的O2缓慢作用生成Na2CO3的缘故。
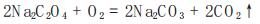
|
因此,标定KMnO4溶液浓度时应用固体Na2C2O4。
CoC2O4·xH2O中结晶水系数x是否恒为2,尚未见确切报道,经初步试验得知,同一批产品的化验样品在120℃烘1~2h,钴的含量无变化,随着温度的升高,钴的含量也升高,当温度达200℃时,钴的含量达40%,接近于CoC2O4的理论值,如果CoC2O4·xH2O中x=2,钴的含量应为32.22%,而有的产品Co含量会出现超过此数值,这可能是产品在烘干过程中x值的不稳定性所致。
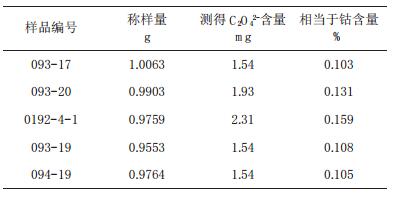
2.3 干扰情况CoC2O4产品中含As3+、Sb3+、Fe2+、Sn2+等甚微,含Cl- < 2mg对测定无明显影响,其吸附和残留于其中的C2O42-情况见表 1。
| 表 1 残留于产品中的C2O42-影响情况 |
 |
| 点击放大 |
残留的C2O42-是加水于产品中浸取后经过滤水洗而得,其中可能有该产品解离出来的微量的C2O42-,表 1表明,从总钴含量中扣除0.1%加以校正,则残留C2O42-产生的测定误差可以忽略不计。
3 样品分析与1.2实验方法的操作相同。
按下式计算钴的百分含量:
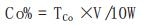
|
式中:TCo—KMnO4对Co的滴定度,mg/mL;
V—滴定消耗KMnO4标准溶液体积,mL;
W—试样量,g。
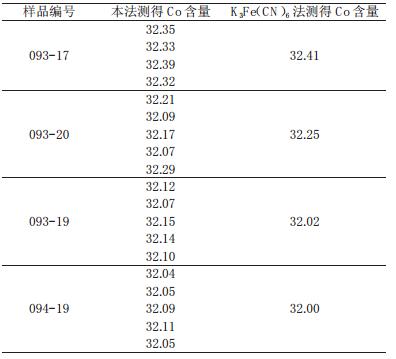
样品测定结果见表 2。
| 表 2 样品测定结果% |
 |
| 点击放大 |
4 结论
草酸钴产品中,Co2+:C2O42-为1:1,在约80℃的3%~5% H2SO4溶液中,KMnO4与C2O42-定量反应,Co和微量杂质元素不影响测定,方法简便灵敏,准确快速,适用于草酸钴中钴量的测定。
| [1] |
余志英.
普通化学常用数据表[M]. 北京: 石油工业出版社, 1959: 54-56.
|
 2006, Vol. 20
2006, Vol. 20
