| 镍酸锂前驱体——球形Ni(OH)2的制备工艺研究 |
2. 赣州逸豪优美科实业有限公司,江西 赣州 341000
2. Ganzhou Yuhao Youmeike lndustry Co., Ltd, Ganzhou 341000, Jiangxi, China
在近些年的锂离子电池的正极材料研究中,LiNiO2以其较高的比容量,较便宜的镍资源,对环境的友好等优势成为取代LiCoO2的最具发展前景的替代材料之一。其中球形氢氧化镍在镍酸锂的合成和改性上发挥了自身的优点,作为合成镍酸锂的前驱体,它合成的好坏直接影响镍酸锂做为锂离子电池的正极材料的电性能。Ni(OH)2有α-Ni(OH)2和β-Ni(OH)2之分,虽然α-Ni(OH)2具有比β-Ni(OH)2更大的理论放电比容量,但其稳定性和体积比容量还远未达到应用要求[1]。当前作为活性物质的主流产品仍是β-Ni(OH)2。而以氨水作为络合剂的液相沉淀法又是制备β球形氢氧化镍的主要方法。与普通氢氧化镍不同,球形氢氧化镍具有堆积密度高、物料放电利用率高、体积比容量大、循环特性好、使用寿命长等优点[2]。由于球型氢氧化镍在电池材料中的重要性,它的制备一直成为该领域的研究热点。
球形Ni(OH)2的制备工艺过程主要包括合成、陈化、洗涤、干燥4个阶段。由于球形Ni(OH)2的性能受各阶段的条件影响较大,获得性能优良的球形Ni(OH)2的条件比较苛刻,因而探索合适的制备条件显得非常重要[3-4]。本研究主要考察反应温度、反应物浓度,干燥温度等对球形Ni(OH)2制备的影响,探索获得球形Ni(OH)2的合适条件。
1 实验 1.1 制备方法配制一定浓度的NiSO4溶液、NaOH溶液和氨水溶液,其中NiSO4和NaOH是反应物,氨水起络合剂的作用。在反应器内加入一定量的底液,控制一定的水浴温度。控制反应体系的pH值在10.5~11.5之间[5],将NiSO4溶液、NaOH溶液和氨水分别以一定的滴加速度加入反应器内,控制搅拌器的转速,通过Ni+与OH-的反应生成氢氧化镍沉淀。反应完成后将得到的样品用布氏漏斗进行抽滤。然后在一定温度下,将其置于干燥箱中干燥12h,取出研磨,即可得球形氢氧化镍。
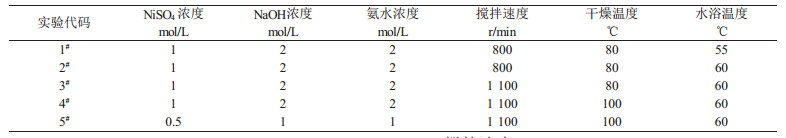
为了确定合成球形Ni(OH)2的合理工艺参数,本研究进行了系列实验。根据前人研究成果,首先将反应体系的pH值确定在10.5~11.5之间, 然后分别对反应温度、搅拌速度、反应物浓度及干燥温度等因素对合成球形Ni(OH)2的影响进行优化。各实验对合成条件的选择见表 1所示,1#样品为实验早期确定的参数,而2#~5#样品的相关实验参数是在逐一总结前实验不足的基础上,对其进行有效的改进而确定的。
| 表 1 制备球形Ni(OH)2合成条件的选择 |
 |
| 点击放大 |
1.2 主要测试仪器
采用XL30W/TMP扫描电镜检测样品的形貌,用Miniflex X射线衍射仪进行晶相分析。
2 实验结果与讨论 2.1 反应温度制备1#样品的反应温度为55℃,合成Ni(OH)2的形貌如图 1所示,从图中可看到Ni(OH)2颗粒呈类球形,但是颗粒相互粘连,结团严重,分散性差。为了避免颗粒的聚团现象,在制备2#样品的过程中,将反应温度提高至60℃,如图 2所示。从图 2可知,2#样品的分散性比1#样品要好,但是颗粒的均一性不理想。这是因为随着反应温度的提高, Ni(OH)2粉末活性提高,晶体表面附近离子运动加快,晶核形成速度加快,小晶粒的形成速度增大。由于温度升高,质点运动速度增加,也抑制了颗粒间的聚团现象。温度升高,Ni(OH)2颗粒的晶面发育不充分,晶格排列不规整,晶体的完整性变差,晶格缺陷多,这样得到的晶体比表面积增大,造成颗粒的致密度也减小。但是反应温度不可一味地提高,由于溶液的过饱和是结晶过程的驱动力,反应温度过高,降低溶液过饱和度,也随之降低了颗粒成核结晶速度,抑制结晶的形成和晶体的长大,同时造成颗粒堆积密度低。由于结晶是放热过程,反应温度高不利于晶体析晶。实验得出的最佳反应温度应控制在60℃。
 |
| 图 1 1#样品的SEM图 |
 |
| 图 2 2#样品的SEM图 |
2.2 搅拌速度
1#和2#样品在制备过程中均采用800 r/min的搅拌速度,合成的Ni(OH)2试样抽滤速度慢,说明样品的流动性和分散性均不理想。为此,制备3#样品时将搅拌速度提高到1 100 r/min,样品的流动性和分散性得到了改善。图 3为3#样品的SEM形貌照片,从该图可看出3#样品的结晶颗粒较2#样品均匀。因此,搅拌速度控制在1 100 r/min左右。在此种条件下,形成的颗粒约10μm。如果搅拌时转速过快会引起设备磨损快和溶液溅出而造成损失。
 |
| 图 3 3#样品的SEM图 |
2.3 反应剂浓度
虽然通过控制反应体系pH值、反应温度、搅拌速度能改善粉体的球形形貌,减小粉体的聚团现象,但还不能完全消除。因此,必须进一步通过控制反应物浓度加以解决。在以往系列实验中,反应物NiSO4的配制浓度相对较高,如1#、2#、3#、4#样品中NiSO4的浓度为1mol/L,NaOH的浓度是2mol/L,氨水的浓度是2mol/L,结果所制备的Ni(OH)2颗粒球形形貌发育不够完善,还有不同程度的团聚。为了解决这一问题,必须将NiSO4的浓度继续降低。因此,在制备5#样品时,将NiSO4的浓度控制在0.5mol/L,NaOH的浓度1mol/L, 氨水的浓度1mol/L,结果实验效果非常显著,如图 4、图 5所示。从图中可看出,Ni(OH)2颗粒的球形比较理想,而且分散性好。因此, 反应物浓度对球形Ni(OH)2的形成是有影响的。适当调低反应物的浓度, 也减小了生成物Ni(OH)2颗粒在溶液中的质量浓度, 使Ni(OH)2颗粒在溶液中的碰撞几率减少,形成团聚的机会也减小, 在搅拌的作用下也更容易形成规则球形。从图中可看出, 形成的Ni(OH)2颗粒粒度均匀,粒径在5~10μm之间。
 |
| 图 4 4#样品的SEM图 |
 |
| 图 5 5#样品的SEM图 |
对5#样品进行XRD检测,其测试分析结果如图 6所示。从图中可以看出在衍射角2θ为20°、35°、40°、60°附近有比较明显的Ni(OH)2特征峰出现。通过定量分析得出Ni(OH)2的含量为94%,其纯度较高,成分也比较稳定,且还有少量w(NiO)=6%,其原因是Ni(OH)2干燥脱水时小部分转变成NiO。
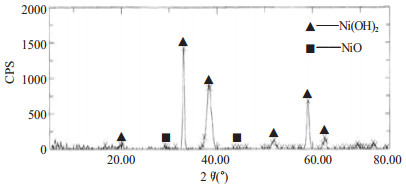 |
| 图 6 5#样品的XRD图 |
干燥球形Ni(OH)2的目的是为了除去其产物中的自由水和吸附水[5], 消除颗粒之间的软团聚,增强颗粒的分散性和流动性,有利于下一阶段在焙烧中与LiOH·nH2O进一步的反应。如1#、2#、3#样品的干燥温度为80℃,干燥后产物的流动性较差,为此,将4#、5#样品的干燥温度提高至100℃,其分散性和流动性有明显改善。可见,干燥温度在处理样品的过程中的作用不可忽视。实验表明,干燥温度应控制在100℃。
3 结论通过以上实验及其结果讨论,可以得出以下的结论:要制备形貌和性能良好的球形Ni(OH)2,其反应体系的pH值应控制在10.5~11.5的范围内,水浴温度控制在60℃;而作为反应物的NiSO4的浓度为0.5mol/L,NaOH的浓度为1mol/L,氨水的浓度是1mol/L,搅拌速度为1 100r/min;样品的干燥温度为100℃。
| [1] |
冷拥军, 刘兵, 王凤军, 等. 铝取代氢氧化镍制备、结构与电化学性能——I电化学性能[J].
电源技术, 2000, 24(2): 77–80.
|
| [2] |
李蓉. 氢氧化镍的物理和电化学性能[J].
电池, 1998, 28(4): 73–76.
|
| [3] |
陈腾飞, 龚伟平, 贺万宁, 等. 制备条件对球形Ni(OH)2物理性能的影响[J].
云南冶金, 2002, 173(4): 46.
|
| [4] |
支红军. 高密度活性氢氧化镍的研究[J].
新疆有色金属, 2003, 26(1): 25–27.
|
| [5] |
安晓君, 焦红忠, 李志. 制备条件对球形Ni(OH)2电化学性能的影响[J].
宁夏工程技术, 2005(6): 137.
|
 2005, Vol. 19
2005, Vol. 19
