| 有机溶剂萃取法在钨冶炼中的研究进展 |
溶剂萃取法是现代分离和提取物质的最先进的方法之一,现在越来越多的金属生产都采用了这种技术。溶剂萃取法应用于钨冶金工艺始于60年代前后,当时美国的碳化物公司和西尔韦尼亚工厂进行了工业规模的生产,随后,苏联、西德、加拿大等国进行了大规模的研究,认为这是钨的湿法冶金的新方向,日本东京钨公司当时的生产工艺由钨酸钠到钨酸铵这段也准备采取萃取法。我国从70年代采用这种技术。如今在萃取工艺和萃取设备方面都进行了较为广泛的研究。
萃取工艺用于钨的生产主要是用以从纯Na2WO4溶液中制取(NH4)2WO4溶液(其工艺流程[1]如图 1),以替代经典工艺中的沉淀人造白钨、人造白钨酸分解、钨酸氨溶等工序,具有收率高,设备简单,流程短的优点,克服经典工艺沉淀结晶过程固液分离多阶段操作的缺点,此外, 萃取法还用于钨酸钠溶液净化除钼和净化除磷、砷。其基本应用大致分为三种:一是在酸性条件下将纯的钨酸钠溶液经萃取转型变成高含量钨的钨酸铵溶液,此法缺点是萃取前需先除杂;二是在碱性钨酸钠溶液中直接萃取钨,使钨酸根进入有机相,杂质留在萃余液中,再反萃有机相中的钨。三是利用钨钼性质上的差异选择适当的有机萃取剂进行钨钼分离。
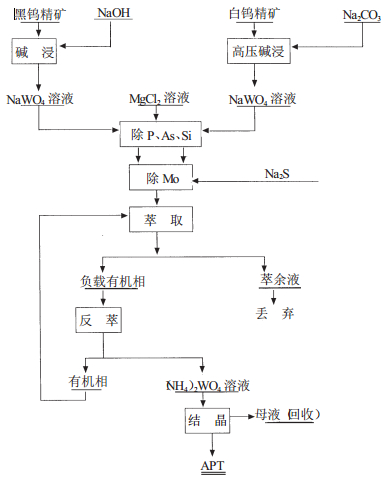 |
| 图 1 溶剂萃取制取APT原则流程示意图 |
1 用萃取法从钨酸钠溶液制取钨酸铵溶液
此法是先将碱浸所得的钨酸钠溶液除去P、As、Si、Mo后选用适当的萃取剂,将其转型为钨酸铵溶液,以进一步制取APT,其主要方法如下。
1.1 叔胺萃取法[2]目前国内外在工业上用萃取法将钨酸钠溶液转型成钨酸铵溶液基本上都是利用叔胺作萃取剂, 迄今已有30多年的历史。苏联用三辛胺(TOA),美国用阿拉明-336(Alamine-336),我国常用N235。
用叔胺作萃取剂的工艺是将Na2WO4用经典方法除磷、砷、硅、钼后, 将纯钨酸钠溶液调整酸度至pH2.5~4 (一般用硫化物沉淀除钼后的溶液其pH已为2~3),然后与已酸化的有机相混合进行萃取,萃余液含少量叔胺及其他有机物和硫酸盐等经处理后排放。负载钨的有机相经水洗后,用2~4mol/L的NH4OH溶液反萃得(NH4)2WO4溶液,反萃后的有机相经水洗并用硫酸酸化后返回萃取过程。
萃钨过程属阴离子交换过程,大致分为三步:
(1) 叔胺首先在酸化过程中转化为胺盐;
(2) Na2WO4溶液在酸化至pH2~4时,钨酸根离子聚合成[HW6O21]5-和[W12O39]6-、[H2W12O40]6-;
(3) 有机相与水相混合,发生阴离子交换反应。
使偏钨酸根与有机相胺盐的SO42-或HSO4-发生交换,钨形成萃合物进入有机相,通过控制有机相成分,调节pH值,料液浓度,相比等条件,经过三级萃取,萃取率可达99.5%。
负载有机相用水多级洗涤除去杂质,特别是除Na+后,用2~4mol/L的氨水进行反萃,从而钨酸钠溶液转型为钨酸铵溶液。
曾有报道用三元胺Alamine336作为萃取剂可以从单一组分和二元组分水溶液中提取Mo和W[3]。在二元水溶液中pH为1左右可能实现萃钨而钼留在水相,但此时溶液形成沉淀不能实现钨钼分离。在单一组分的溶液中,pH在6以上钨不能被萃取,因为经酸化预处理的Alamine336再与碱性溶液接触时变成了游离的R3NA从而失去了萃取能力。pH在6以下钨能被完全萃取。而且从单一组分的溶液中萃取速度要快于混合溶液。用高浓度的氨水作为配位剂抑制钨钼形成复杂多核配位体进行反萃,钨以仲钨酸铵结晶析出从有机相分离。
虽然叔胺萃取效果比较好,但都限于低浓度范围。用工业混合叔胺N235-TBP-煤油体系将较高浓度Na2WO4溶液转化成高浓度(NH4)2WO4溶液的萃取工艺,能耗低且提高了设备的利用率。年产100t WO3的半工业实验表明,强化反萃取过程的传质和降低酸浓度是克服反萃取过程中形成APT的有效方法。工艺过程连续稳定,金属收率高,产品质量好[4]。
叔胺萃取的缺点是仅能实现Na2WO4溶液转型成(NH4)2WO4溶液,萃取过程不能同时除去P、As、Si和Mo等杂质,同时钨酸钠溶液调酸和叔胺的酸化都需耗用大量试剂,这将恶化劳动环境并造成萃余液酸性排放的环保治理费用增加。
1.2 伯胺萃取法伯胺N1923也是一种良好的萃钨试剂。顾功凯等研究了在N1923添加硫酸肼作为还原剂,EDTA为抑萃剂使钼不被萃取,而钨萃入有机相,然后用氨水反萃。得出最佳实验条件为:水相料液含WO3小于50g/L,pH为3.5。有机相配比:10%N1923,12%仲辛醇,其余为煤油。反萃剂氨水l mol/L。萃取、反萃取级数均为2。有机相与水相体积比为0.5。对分离高含量钨和微量钼,有明显效果[5]。产品WO3含量大于99.90%,钼含量由0.015%下降到0.0029%(平均值)。张启修, 黄蔚庄等研究了用伯胺N1923异辛醇体系萃取钨,发现其效果及分相性能良好,且异辛醇无不良的臭味,劳动条件较好。并对其进行了连续运转实验研究,料液WO3浓度为105g/L,有机相组成为10%N1923+20%异辛醇+70%磺化煤油,试验时最低室温23℃,最高室温28℃。结果分相良好,连续运转情况正常,萃余液、萃洗液含钨完全达到排放标准,成功的实现了常温反萃。反萃液WO3含量达300g/L,反洗液含钨低。此体系对工业料液的适应性较强,允许料液有较高的WO3浓度和较高的pH值,完全可以满足生产合格APT的要求[6]。薛生晖和陈洲溪[7]研究了用伯胺N1923从高钨浓度的碱性工业钨酸钠溶液中萃取分离磷砷。指明了伯胺N1923主要靠氢键作用按溶剂化机理萃取磷钨和砷钨杂多酸。他们在试验室规模进行了成功的试验。用伯胺N1923作萃取剂,在弱碱性条件下优先萃取工业粗Na2WO4溶液中的P-W、As-W、Si-W等杂多酸,可以使工业粗Na2WO4溶液中的P、As、Si等杂质元素达到彻底的分离。单级磷砷的萃取率达99.5%以上。单级萃取后萃余液含P < 0.001g/L,As < 0.001g/L,SiO2 < 0.05g/L;萃取液经单级反萃即可把磷、砷、硅和共萃取的钨反萃下来完全达到净化要求并大大低于化学沉淀法的净化水平,能满足制取高纯产品的要求。
伯胺萃取通过萃取剂组成和萃取工艺的调整,可分别实现除Mo和除P、As、Si, 相对于叔胺萃取来说,工艺上是前进了一步,但除Mo和除P、As、Si不能同时进行。除Mo和除P、As、Si只能选择一种工艺,依然需保留化学沉淀法除P、As、Si或者保留化学沉淀法除Mo,且除钼的效果也不理想。产品不能达到国标0级品标准。同时Na2WO4溶液萃取前仍需调酸。
1.3 季铵盐萃取法除用叔胺和伯胺外, 国外亦有用季胺盐作萃取剂的, 其特点是可在较宽的pH(如2~8)范围内萃取。且因它本身带有可交换的阴离子, 故不需像叔胺一样要预先酸化,但价格较贵, 一般少用。
季铵盐可用于钨钼分离。龚柏凡等[8]研究了季胺盐萃取分离钨钼、即在粗钨酸钠溶液中添加S2-或HS-,使钼生成硫代钼酸盐,基于硫代钼酸络离子对季铵盐之亲和势远高于钨酸根离子,采用国产N263作萃取剂,钨酸盐溶液中的钼被优先萃取。单级萃取钼之分配比DMo为10以上,而DWO3甚低,其分离因素βMo/WO3可达1000以上,具有相当好的分离效果。该工艺已经半工业性运转成功,运转可靠,适应性强,有较好的工业应用前景。顾珩等[9]研究了在不加络合剂条件下,在硫酸体系中用N263萃取分离钨钼工艺。将有机相用一定浓度的NaOH处理后,水洗,硫酸化,使氯化季胺盐转化为羟基季胺盐。串级试验的有机组成为:N263 20%,B50 10%,余为煤油,原料Na2WO4溶液含WO3 54.11g/L,Mo 1.02g/L,pH为6。经6级萃取,2级反萃后,反萃液(NH4)2W04中Mo/ WO3比为0.0058%,WO3萃取率为98.7%。黄尉庄[10]等研究了用N263-TBP-煤油萃取体系萃取硫代钼酸盐分离钨钼的工艺,水相为经除P、As、Si后的工业钨酸钠溶液,含WO3为95g/L左右,Mo/WO3为0.05%,用盐酸调溶液的pH,加入适当的硫化碱进行处理,有机相组成为1.0%N236+20%TBP-煤油,相比为1:1,经六级萃取三级萃洗,单级三段反萃和四级反洗的工业试验,萃余液中Mo/WO3≤0.01%,WO3的损失率小于0.5%。李菁华[11]在萃取分离钼钨时在N263中添加少量羧酸,此举加强了硫代钼酸根优先进人有机相,使萃取体系达到平衡时间短,提高了分离因数,分相快而清晰,萃取剂性能稳定。钨产品含Mo < 5×l0-4%。
季胺盐还可用于钨磷分离。在碱性条件下用氯化季胺盐甲基三烷基铵(N263)作为萃取剂分离钨磷,控制水相Cl-、S042-等阴离子的含量,用浓度40% N263+10%癸醇,在pH8~12的钨磷混合溶液中多级逆流萃取钨,钨磷的分离因数可达20以上。用0.5mol/L的NH4Cl或NaCl做反萃剂,单级反萃率可达70%以上[12~13]。
与伯胺萃取相比,季胺萃取实现了深度除钼的目标。其萃取前Na2WO4溶液的调酸pH也较高。但依然不能同时除去Mo和P、As、Si。
1.4 其他萃取方法R.A.Guedes De Carralho等[14]研究了烷基胺-HCl和烷基胺-H2S04这两种体系,在不同pH(2、7和12)和不同浓度的NaCl (1和5mol/L)、Na2SO4 (1.36mol/L)或Na2CO3(0.05%、0.1%、l%、5%和25%)条件下,于煤油和异癸醇(9:1)混合物中使用伯胺(Primene JM-T)、仲胺(Amberlite LA -2)、叔胺(A1amine 336)和一种季铵盐(Aliquat 336)的氯化物及硫酸盐溶液,初始的[胺]有/[钨]水之比在0~14范围内对0.01mol/L钨酸钠水溶液的萃取。胺与钨之比均为摩尔比。结果在pH2条件下,较低的[胺]有/[钨]水比,即能达到萃取率100%,而较高pH值则不能;pH7和12时,各种胺的萃取效率有所不同。当[胺]有/ [钨] 水比值低时,A1iquat336是最有效的萃取剂,但在比值较高时,却成为最低效的萃取剂。在相同操作条件下,烷基胺-硫酸体系比烷基胺-盐酸体系有较高的E值。NaCl对烷基胺-盐酸体系的影响比起Na2SO4对烷基胺-硫酸体系的影响更大一些;在这几个pH值中NaCl的存在对这四种胺盐酸体系的萃取都产生不利的影响。使用Aliquat336萃取,在pH2时E值最高,但在pH7和12时,其E值为所有胺中最低的。在pH7时,Alamine 336的萃取率受NaCl影响最小,在pH7时,SO42-离子对伯胺和叔胺萃取率影响稍有增加。对于仲胺和季铵,则萃取率较低。pH l2时,SO42-对萃取率的影响比pH7时更为不利;Na2CO3的存在也对两种体系的萃取产生不利的影响。但即使[CO32-]=25%时用Aliquat336萃取仍是可能的;无论是哪一种胺。用NaCl和NH4Cl溶液反萃取,其E′值(反萃率)都是低的。对于A1iquat336,用NH4OH溶液反萃取E′值低,但对其他的胺则E′值较高。对所有的胺而言,等摩尔的NaCl+ NaOH溶液E′值都高。对于伯胺、仲胺和叔胺NaOH、NH4OH、Na2CO3和(NH4)2CO3溶液是很好的反萃取剂,其次是等摩尔的NH4OH+NH4Cl溶液,但对于A1iquat336,反萃取效果则不太好。
钨还可以磷钨杂多酸被萃取,磷钨杂多酸的萃取一般认为可以用含氧萃取剂在酸性介质中进行,Lakshmanan等研究了TBP对12-磷钨酸等杂多酸的萃取,V.Yatirajam等用正戊醇和MIBK (甲基异丁基酮)萃取磷钨酸[15]。
对于钨的溶剂萃取还有其他一些体系报道。胡习茹等人以苯胺为萃取剂,以3.5g WO3为反应原料,在pH为4的HAC-NaAC缓冲溶液中萃取Mo。用10mL硫酸肼为还原剂,20mL EDTA掩蔽Mo,灼烧温度为600℃。结果可使原料中Mo含量降低95%以上[18~19]。WO3的纯度达到化学分析纯试剂标准,该法萃取容量大,无乳化现象,分层快;苯胺可回收循环使用;仪器简单,操作方便,易于工业化。缺点是苯胺具有毒性。李全民等[20]研究了用1.5×10-4mol/L水杨基荧光酮,3.5g硫酸铵,3.0ml乙醇做为萃取体系在pH=2时能使钨(Ⅵ)与常见过渡元素离子Fe (Ⅲ)、Cu(Ⅱ)、Co(Ⅱ)、Ni(Ⅱ)、Mn(Ⅱ)得到很好的分离,该体系与传统的有机溶剂萃取分离方法相比,具有挥发性小,无毒。平衡时间短,相分离界面清晰,无三相乳化现象,快速简便,均相萃取-异相分离等特点。李伟宣,张礼权[21]研究了用5%TRPO-MIBK-煤油作为萃取剂,在[WO3]=46.4g/L,[Mo]=6g/L的料液中,温度为25℃,pH=1.5,震荡1min的液-液萃取工艺,负载有机相用NaOH在室温下反萃,反萃率为100%。该萃取剂无毒性、成本低、来源方便、性能良好。整个工艺流程经济效益高,分离、反萃取效果均很突出;无须加入有害元素磷以助分离。苏联开发出在化学上活性很强的固体萃取剂(TB3KC)苯乙烯及对二乙烯苯粒化的共聚物并研究成功了深度分离钨钼的方法,该方法是用中性有机磷萃取剂或季胺盐从含有过氧化氢的酸性溶液中优先萃取钼[22]。该方法能够有效地从含过氧化氢的钨酸钠溶液中深度分离钼和钨。在同样实验条件下,用固态萃取剂萃取时,钼的分配系数值差不多,比液体萃取剂萃取时高1/3。用含38%二异辛基甲基磷酸酯的固态萃取剂在动态条件下从混合溶液中选择性萃取钼在比负荷1/h的条件下,可由含Mo 1.125g/L,WO3 95g/L,NaNO3 100g/L,H2O2:∑(Mo+W)=2:1,pH=0.85的原始钨酸钠溶液获得含Mo 0.022g/L,WO3 90g/L的萃余液。静态条件下(错流),用含38%二异辛基甲基磷酸酯的固态萃取剂从原液含Mo 1g/L,W 50g/L,NaNO3 100g/L,H2O2:∑(Mo+W)=2:1中萃取时,经4级获得的萃余液pH=0.9,含Mo 0.006g/L,W 40g/L。同样用该固体萃取剂在动态条件下从钨酸铵生产母液含Mo 5g/L,WO3 87.0g/L,Si 0.3g/L,H2O2 :∑(Mo+W)=2 : 1,pH=0.85中除钼。99.95%的Mo和l0%的W会转移到萃取物中,萃余液中的Mo/WO3 < 0.02%([Mo]= 0.015g/L,[W]=76.0g/L)。用20%NaNO3溶液(pH=1)选择性的反萃钨,固态萃取剂中原含量90%的W和15%的Mo会进入反萃取液。当用10%NH3溶液+10%NH4NO3溶液进一步反萃取钼时;残留在固态萃取剂中所有的钼和钨实际上都转移到反萃取液中,钼的反萃取液含Mo 4.2g/L,W 1.1g/L。
2 从钨矿苏打浸出液中直接萃钨俄罗斯科学院西伯利亚分院, 在工业试验规模研究成功了直接从钨酸钠的苏打溶液中萃钨分离磷、砷、硅杂质的工艺。其特征为采用碳酸氢盐型季铵盐作萃取剂,NH4HCO3为反萃剂, 克服了现行酸性介质萃取需先用化学法除杂的缺点.萃余液返回浸出钨矿, 其与酸性萃钨工艺相比在保持相同萃取率的条件下即节约了电耗又减少了废液排放量,在萃取转型时同时除杂质,磷、砷、硅除去率达97%以上。其工艺流程见图 2。
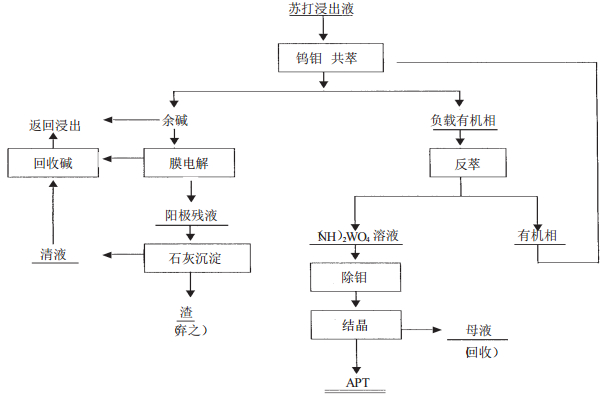 |
| 图 2 钨矿苏打浸出液直接萃钨工艺 |
张启修[1]等人研究了直接从钨酸钠的苛性钠溶液中萃钨的方法,其原则流程示于图 3。
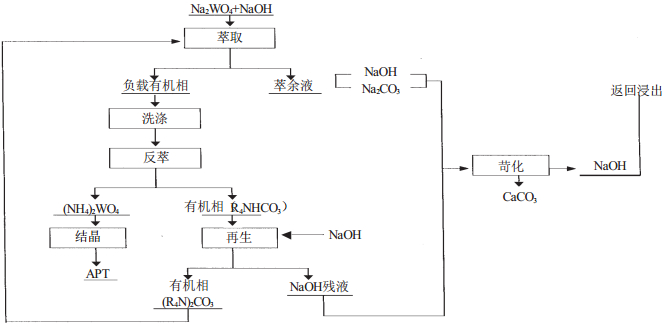 |
| 图 3 从苛性钠溶液中直接萃钨原则流程 |
该工艺存在两个闭路循环系统,即水相闭路循环和有机相闭路循环。浸出液中的碱可回收返回使用。整个工序既无酸耗且几乎没有废液排出;萃取同时除去了阴离子杂质P、As、Si、F等,使其在回收碱的过程中以沉淀渣的形式排出而与钨分离。与传统萃取工艺相比,该工艺废水排放量小,环境污染低,同时缩短了工艺流程,减少了酸碱等试剂的消耗。
从以上两种直接萃钨的工艺可以看出,这两种萃取工艺的共同点是:可在碱性体系萃钨,这不但可节约调酸试剂,且可减少酸废液的排放,前者在萃钨的同时可除去P、As、Si。同时碱性萃钨工艺,为从萃余液中回收碱创造了条件。这两种方法的不同之处是,第一种可以处理含钨钼的混合料液,而第二种只处理含钨的料液。
3 用萃取法从钨酸钠溶液中除钼溶剂萃取法分离钨与钼主要是利用有机试剂对某些钨化合物和钼化合物可萃取性的差异来进行。一般来说有以下几种萃取体系[2]。
(1) Mo+6、W+6/H2O2/TBP体系:该工艺基于H2O2能破坏钨钼杂多酸离子,使钨钼分别生成相应的过氧阴离子。由于钼的过氧阴离子稳定性比钨的大得多,故TBP仅选择性萃取钼,钨则主要留在溶液中,钨钼分离系数达40,过程的最佳技术条件为:加入H2O2摩尔量为钨、钼摩尔量的1.5~2.0倍、pH0.5~2.0一般钼的萃取率达96%~98%,可从含钼0.3%~0.5%的钨酸中制得含钼小于0.005%的APT。
该体系的缺点是H2O2消耗量过大,同时钼的分配比严重地受溶液中碱金属盐的浓度的影响,当碱金属盐的浓度由25g/L增至100g/L,则分配比由2.11降到0.83,为此A.H.节里克曼等人研究用甲基膦酸烷基酯(DAMP)代替TBP。试验证明,在硫酸盐体系中,在pH 0~4范围内DAMP萃钼的分配比为TBP萃钼的2~3倍,在硝酸体系中则为3~5倍,此法现已用于工业生产。
(2) Mo6+、W6+/EDTA/D2EHPA萃取体系:该技术基于在弱酸性介质中(pH < 3)钼的同多酸根离子及钨钼杂多酸根离子发生部分解聚,钼部分转化为MoO22+,即溶液中有部分MoO22+平衡存在。而钨基本上保持为聚合阴离子,因此采用阳离子交换萃取剂则可将溶液中已有的MoO22+选择性的萃取到有机相,从而使溶液中的解聚反应继续进行,继续产生MoO22+,并进而被萃取到有机相,直到完全解聚,钼基本上被完全萃取为止。一般萃取剂用(二-2-乙基己基磷酸)(D2EHPA或P204)。反应过程速度缓慢,一般认为钨钼杂多酸中的钼解聚为MoO22+的步骤为过程的控制性步骤,为加快此过程,可加入EDTA作解聚剂。EDTA与钼的摩尔比为2,在40%TBP-10%仲辛醇-50%煤油体系中,经多级逆流萃取,钼的萃取率达96%~98%,而钨的萃取率小于1%。
(3) Mo6+、W6+/NaHS/季胺盐体系:基于在弱碱性介质中钼对S2-的亲和力较钨大,加入一定量的S2-则优先形成MoS42-,然后用季胺盐萃MoS42-,而钨则留在水相中,采用碱性次氯酸钠溶液作反萃剂,钼反萃到溶液中同时有机相还原。
一般硫化物加入量为按钼计算的理论量的200%~500%,在控制pH为8.4~8.6,再用季胺盐在烷基苯中的溶液作有机相进行萃取,有机相中季胺盐的浓度为1%~5%。此时钨钼的分离系数达1100~5 000,在单级萃取中,钼的萃取率达90%以上。
4 结论以上有关钨的萃取方法有些还只是实验室研究,还未实现工业化,而有的不同程度在工业上得到了应用。总体上溶剂萃取法在钨冶炼方面的研究已取得了较大的进展,但各工艺和方案在实践中仍存在不少问题,因此需要进一步发展完善。碱性萃钨工艺以及萃钨过程同时实现除Mo、P、As、Si的工艺研究是今后的研究方向而研究新型高效的萃取剂可能是解决上述问题的关键。
| [1] |
张启修.
冶金分离科学与工程[M]. 北京: 科学出版社, 2004.
|
| [2] |
李洪桂.
稀有金属冶金学[M]. 北京: 冶金工业出版社, 1990: 64-66.
|
| [3] |
佐野诚, 钟晨. 用Alamine336萃取钼和钨[J].
国外稀有金属, 1989(6): 17–23.
|
| [4] |
李家杰. Na2WO4的溶剂萃取转化[J].
稀有金属, 1989(5): 379–383.
|
| [5] |
顾功凯, 马秀英. 用伯胺N1923萃取分离钨中微量钼[J].
广州化工, 1991(4): 52–55.
|
| [6] |
张启修, 黄蔚庄, 周志孝. N-1923异辛醇体系萃取钨的研究[J].
稀有金属与硬质合金, 1989(6): 16–21.
|
| [7] |
薛生晖. 钨湿法冶金过程中的杂多酸及其萃取[J].
稀有金属与硬质合金, 1989(3): 5–8.
|
| [8] |
龚柏凡, 张启修. 基于硫代钼酸盐分离钨钼的研究小结[J].
中国钨业, 1995(8): 10–14.
|
| [9] |
顾珩, 汪剑岭, 王继民, 等. 高钼酸钠溶液萃取分离钨钼的研究[J].
稀有金属与硬质合金, 1997(6): 7–11.
|
| [10] |
黄尉庄, 龚柏凡, 张启修. 溶剂萃取硫代钼酸盐分离钨钼[J].
中国有色金属学报, 1995(1): 45–47.
|
| [11] |
李菁华. N263萃取分离钼钨的硫代盐[J].
稀有金属, 1989(4): 206–300.
|
| [12] |
李大任, 苏元复. N263分离W、P[J].
稀有金属, 1991(1): 6–9.
|
| [13] |
Landquist A Q.Extracting tungsten from ores and concentrates[P].US:Patent: 4, 168, 296, 1979-09.
|
| [14] |
Gar GRA, 黄宗良. 在烷基胺-盐酸和烷基胺-硫酸体系中钨的溶剂萃取[J].
湿法冶金, 1991(4): 11–18.
|
| [15] |
陈昌, 张礼权. 磷钨杂多酸的萃取[J].
华东化工学院学报, 1989(1): 33–39.
|
| [16] |
王晓兵, 胡国强. 磷酸三丁酯萃取磷钨酸的研究[J].
辽阳石油化专学报, 1995(9): 42–45.
|
| [17] |
李大任, 苏元复. 溶剂萃取法分离钨、磷的研究[J].
化工学报, 1990(1): 43–49.
|
| [18] |
胡习茹. 用苯胺萃取法分离三氧化钨中的钼[J].
黎明化工, 1996(2): 27–28.
|
| [19] |
Chaney.Process for the extraction of tungsten from aqueous solution[P].US: Patent: 3316058, 1967-04.
http://www.freepatentsonline.com/3316058.html |
| [20] |
李全民, 耿新华, 张志洁. 硫酸铵-水杨基荧光酮-乙醇体系萃取分离钨[J].
稀有金属, 2001, 25(2): 154–156, 160.
|
| [21] |
李伟宣, 张礼权. 从酸性溶液中选择萃取分离W、Mo[J].
稀有金属, 1990(4): 251–255.
|
| [22] |
泽里 A H, 杨雨浓. 利用聚合物作载体的萃取剂分离钨钼[J].
稀有金属与硬质合金, 1991(6): 57–60.
|
 2005, Vol. 19
2005, Vol. 19
