| 镧热还原氧化钐过程动力学控速环节的探索 |
镧热还原氧化钐制取金属钐的方法,是20世纪50年代Danner[1]等人首次报道的,其制取工艺是在高温真空条件下进行2La(l)+Sm2O3(s)=2Sm(g)+La2O3(s)的化学反应。
由于钐具有高的蒸气压,而镧、氧化钐、氧化镧的蒸气压相对很低,还原出来的金属钐蒸气迅速蒸发排出,反应的动力学条件比较好。镧热还原氧化钐制备金属钐的方法,可以获得纯净的金属钐,同时金属钐收率也比较高,是目前制取金属钐的主要手段。但目前对实际生产过程中各反应环节所开展的研究较少,尤其对镧热还原氧化钐过程影响控速环节因素的研究比较缺乏。通过镧渣分析和金属钐制备试验,改变传统的固定配料的方法,对生产工艺条件进行优化,达到提高金属钐收率,降低生产成本的目的。
1 还原过程的动力学环节 1.1 反应的类型及环节反应为气一固一液多相反应,由以下几个环节组成:
(1)液态金属镧穿过固态氧化镧产物层,扩散至固态氧化钐与固态氧化镧界面。
(2) 在固态氧化钐与固态氧化镧界面进行结晶化学反应,反应产物金属钐与金属镧生成镧一钐合金[2]。
(3) 金属钐由镧一钐合金中蒸发,变为气态,气态金属钐穿过反应物料层的扩散。
由上可知,镧热还原氧化钐过程的反应环节主要有三个,镧的扩散、镧与氧化钐的反应、金属钐蒸气的蒸发和扩散。当反应处于低温时,过程处于动力学区,界面化学反应为控速环节。当反应处于高温时,扩散为控速步骤[3]。环节(1)(3)的扩散有相似之处,也有不同之处。
相似之处是二者均为流体的孔扩散过程。但反应环节(1)的扩散流体为液态金属镧,而反应环节(3)的扩散流体为气态金属钐,液态金属镧的扩散路径要比气态金属钐的扩散路径短得多。气态金属钐须扩散离开料块(料块一般压制成圆饼状,直径和厚度为数厘米),而液态金属镧(镧屑粒度一般为1~ 5mm)只是扩散至与周围的氧化钐接触。
反应环节中的(3)是钐蒸气的蒸发和扩散相互交错的一个过程。气态金属钐扩散过程中,如果与液态金属镧接触,会再次生成镧一钐合金,将重新开始蒸发和扩散过程。
1.2 反应控速环节的确定在制备金属钐温度下反应的表观活化能为36.8kJ/mol[4]。根据其大小,判断反应处于扩散控制,但镧热还原氧化钐的扩散环节有两个,即反应物液态金属镧的扩散和反应产物气态金属钐的蒸发一扩散。
镧热还原法一般用于稀土金属钐、铕、镱、铥的制备,其动力学过程类似,都包括还原剂金属镧的扩散和产物金属蒸发一扩散环节。产物金属的蒸气压决定了其蒸发-扩散速度,假设镧热还原制备上述金属的控速环节为金属镧的扩散,由于铕和镱的蒸气压高于钐,那么铕和镱的蒸发-扩散速度就应快于钐蒸发-扩散速度,而在相同条件下,镧热还原制备金属钐、铕、镱的反应速度应是很接近的。但这种推论与实验结果[5]相矛盾,实践表明镧热还原制备钐、铕、镱、铥的反应速度的快慢顺序为镱、铕、钐、铥,与金属蒸气压的高低顺序一致,由此可以推断镧热还原氧化钐的控速环节为反应产物金属钐的蒸发-扩散。
根据上述讨论可知,提高金属钐蒸气的扩散速度的关键在于缩短它的扩散路径和增大反应物料的孔隙率。
2 试验部分 2.1 试验取样反应物料的质量配比:氧化钐:金属镧=1:0.8, 是根据化学反应方程式的理论配比。
反应物料的纯度:金属镧大于99.0%;氧化钐大于99.9%。
反应物料的粒度:氧化钐1~5μm; 金属镧0.5mm×1mm×5mm镧屑)。两者混匀后压制成尺寸为Φ70mm×28mm的料饼(本文计算均忽略其他杂质质量,以下同。)。
坩埚装料方式及镧渣取样情况见图 1,本次实验共取样3个,其中1、3号试样取自压制的圆饼块,2号试样取自同样条件下压制的圆饼块捻碎后的小块(料直径一般为1%5mm)。
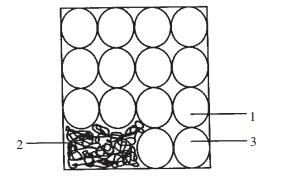 |
| 图 1 坩埚装料及取样示意图 |
2.2 试验仪器
还原反应在SL63-7B型真空碳管炉中进行。热重分析采用A & D公司的GF-200型精密电子天平称量。化学成分分析采用美国热电公司的Icisad-vantage等离子光谱仪测定。最后根据实验结果,在包头伟明稀土厂进行优化试验。
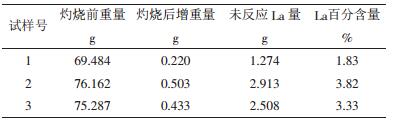
2.3 试验步骤、结果及讨论 2.3.1 热重法1~3号试样经试样袋密封后称重,再粉化后灼烧,最后得到各试样增重数据。由于灼烧后试样增重量即为氧量,则可计算各试样中的未反应的金属镧量,进而可得出谰的质量百分含量C,各试样所得数据见表 1。
| 表 1 备试样热重涪数据 |
 |
| 点击放大 |
2.3.2 化学分析法
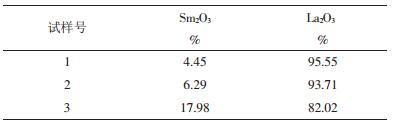
1~3号试样灼烧称重后化学成分分析(Sm2O3、La2O3的质量百分含量),各试样分析数据如表 2所示。
| 表 2 备试样化学成分分析数据 |
 |
| 点击放大 |
结合表 1和表 2数据,可通过以下推导计算出各取样点的氧化钐反应率(可视为金属钐收率)。
设灼烧前试样中的La2O3质量百分含量为X,Sm2O3质量百分含量为Y,La的质量百分含量为(已知)。灼烧后的化学成分分析试样中设La2O3质量百分含量为A,Sm2O3质量百分含量为B(两者均己知,如上表 2所示)。又设由未反应金属La经灼烧转变的La2O3质量百分含量为X1,则X1与C的关系式可由以下方程式推导出。
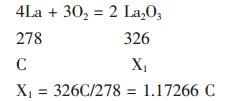
|
由灼烧前和灼烧后所设各试样成分质量百分含量可列下面两方程式:
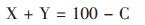
|
(1) |
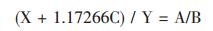
|
(2) |
解(1)、(2)方程组得到X、Y计算表达式如下:
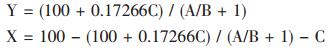
|
氧化钐反应率(金属钐收率)计算方法如下:
设物料中反应的Sm2O3为X2,氧化钐反应率(金属钐收率)为Y2。
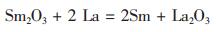
|
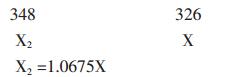
|
则氧化钐反应率(金属钐收率)Y2= X2/(Y+X2)= 1.0675X/(Y+1.0675X)× 100%
代入相应数据,得各试样Y2如表 3所示。
| 表 3 各试样金属钐收率 |
 |
| 点击放大 |
从表 3可知,3号物料的金属钐收率较低,其原因是坩埚底部物料受上部物料的压力作用及烧结作用致使反应物料的孔隙率降低,造成液态金属镧与固态氧化钐接触状况及金属钐蒸气扩散能力变差,最终导致金属钐收率降低。而2号小块料的金属钐收率比同一层的3号饼块料的金属钐收率高许多。分析结果表明:在不影响单炉次装料量的条件下,采用在坩埚底部装一层经过压制的小块料能减缓坩埚底部物料的受压状况,増大了底部物料的孔隙率,増加了金属钐蒸气的扩散途径,同时缩短了金属钐蒸气向外扩散的路径,创造了较好的反应动力学条件,最终提高了单炉次金属钐收率。
3 结论(1) 镧热还原氧化钐过程反应的控速环节是气态金属钐的蒸发和扩散。
(2) 试验表明,在不影响单炉次装料量的条件下,采用在坩埚底部装一层经过压制的小块料能创造较好的镧热还原氧化钐反应动力学条件,提高单炉次金属钐收率。
| [1] |
Danne A H, Dennison D H, Spedding F H. Reduction of samarium oxide with metaⅡic Ianthanum[J].
Amer. Chem. Soc, 1953, 75: 2272. DOI: 10.1021/ja01105a526. |
| [2] |
吕恩保, 刘兴山. 谰热和怖热还原法制取金属铃影响因素的研究[J].
江西有色金属, 1990, 4(4): 9–13.
|
| [3] |
莫鼎成.
冶金动力学[M]. 长沙: 中南工业大学出版杜, 1987: 304-306.
|
| [4] |
张长参, 张新.
稀土冶金原理与工艺[M]. 北京: 冶金工业出版杜, 1997: 6.
|
| [5] |
Kazuyoshi Shimakage, Kazuhiko Endo, Tadao Sato. Reduction Kinetics and Mechanism of Rare Earth 0xide (Sm2O3, Eu2O3, Tm2O3 and Yb2O3) with MetaⅡic Lanthanum[J].
Japan. Inst. MetaIs, 19950, 54(1): 17–24. |
 2005, Vol. 19
2005, Vol. 19
