| 稀土氧化物中氯量的快速测定研究 |
随着稀土的广泛应用, 市场对稀土氧化物的需求不断增加, 对其质量要求也不断提高, 氧化稀土中氯杂质的多少直接影响其质量。目前, 稀土氧化物中氯的测定虽有标准加入法[1], 但由于氧化物中氯含量波动较大, 品位不易估计, 采用标准加入法测定比色范围较窄, 方法又较繁琐, 不能满足样品快速测定的要求, 为此进行了对稀土氧化物中氯量的快速测定方法研究, 以满足实际生产需要。
1 仪器与试剂试验主要仪器与试剂如下:
(1) 721分光光度计。
(2) 硝酸(1+3):先将硝酸煮沸除尽氮氧化物, 再进行配制。
(3) 硫氰酸汞乙醇溶液(3.5g/L):称取0.7g硫氰酸汞, 加200mL无水乙醇溶解。
(4) 硝酸铁溶液(150g/L):称取30g硝酸铁, 加10mL硝酸(1+3), 加190mL水溶解。
(5) 氯标准贮存溶液:准确称取在400~450 ℃灼烧过的氯化钠1.6485g, 加水200mL溶解, 移入1L容量瓶中, 以水稀释至刻度, 混匀, 此溶液每毫升含氯1mg。
(6) 氯标准溶液:准确称取10.00mL氯标准贮存溶液于1L容量瓶中, 用水稀释至刻度, 混匀, 此溶液1mL含氯10μg。
(7) 稀土基体溶液:①选用单一稀土氧化物Y2O3(4N)样品用硝酸分解制成每毫升含Y2O3 4mg的基体溶液。②选用单一稀土氧化物Nd2O3(2N)样品用硝酸分解制成每毫升含Nd2O3 4mg的基体溶液。③选用单一稀土氧化物La2O3(4N)样品用硝酸分解制成每毫升含La2O34mg的基体溶液。④选用单一稀土氧化物Dy2O3(4N)样品用硝酸分解制成每毫升含Dy2O3 4mg的基体溶液。
2 实验部分 2.1 方法原理在酸性介质中, 氯根与硫氰酸汞作用, 生成稳定的氯化汞, 游离出的硫氰酸根与三价铁形成红色硫氰酸铁络合物, 借此进行比色测定。
2.2 分析步骤的拟定在试验方法研究中, 关于波长及试剂硝酸、硫氰酸汞、硝酸铁的条件试验在国标GB/T12690.18-90中已验证过, 这里不再重复, 分析步骤拟定如下。
准确称取0.2000~1.0000g试样于250mL锥形瓶中, 加入硝酸(1+3) 20mL, 盖上塑料盖, 低温加热至试样全溶, 取下, 冷却至室温, 将溶液移入50mL容量瓶中, 用水稀释至刻度, 混匀。移取部分试液于25mL比色管中, 加入3.5mL硫氰酸汞(0.35%)、2.5mL硝酸铁溶液(15%), 用水稀释至刻度, 摇匀, 放置10min后, 以试样空白为参比, 用3cm比色皿于波长460nm处测定其吸光度(若溶液有颜色, 则应做补偿溶液, 扣除其颜色干扰)。
2.3 稀土基体对氯的影响试验由于测氯时不分离稀土, 因此稀土元素的存在对氯的显色有无干扰非常重要。
吸取氯标准溶液0.0, 1.0, 2.0, 3.0, 4.0, 5.0, 6.0, 7.0mL于一列25.0mL比色管中, 加入2.0mL硝酸(1+3)溶液、3.5mL硫氰酸汞溶液、2.5mL硝酸铁溶液, 用水稀释至刻度, 混匀, 显色10min后, 用3cm比色皿于460nm处测其吸光度。
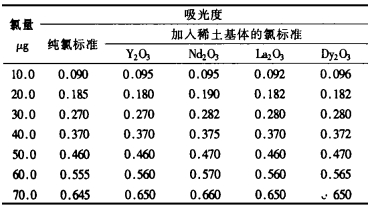
由于各稀土氧化物的颜色和性质有一些差别, 故选取有代表性的Y2O3、Nd2O3、La2O3、Dy2O3共4种稀土氧化物作稀土基体溶液, 在氯标准溶液中加入5.0mL的稀土基体溶液作标准曲线, 与纯氯标准曲线比较, 数据见表 1。
| 表 1 稀土基体对氯的影响 |
 |
| 点击放大 |
从表 1中的数据可看出, 稀土基体对氯的测定基本无影响。
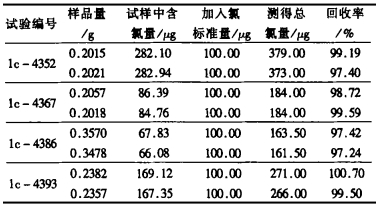
2.4 标准回收率试验在已知含量的样品中加入氯标准溶液, 按分析方法进行操作, 标准回收率见表 2。
| 表 2 标准回收实验数据及结果 |
 |
| 点击放大 |
从表 2可以看出, 标准回收率在97%~101%之间, 回收率较好, 能满足分析要求。
2.5 精密度试验选取实际样品1c-4654, 按所拟定的分析步骤测定样品中氯含量, 计算了标准偏差和相对标准偏差[2], 数据及结果见表 3。
| 表 3 精密度试验 % |
 |
| 点击放大 |
由表 3可知, 试验方法的的标准偏差和相对标准偏差都较小, 方法精密度高, 能满足分析要求。
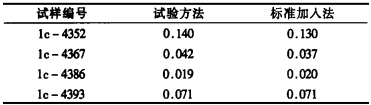
2.6 结果对照将若干样品按照国标GB/T 12690.18-90的分析步骤进行测定, 所得结果与试验方法比较, 数据见表 4。
| 表 4 方法结果对比 % |
 |
| 点击放大 |
从表 4可看出, 试验方法的结果与标准加入法的结果基本一致, 误差较小。
3 结论通过实验, 建立了氧化稀土中氯量快速测定的方法, 该方法快速、简便、准确且成本低, 准确度与精密度均较好, 完全能满足分析要求。
| [1] |
北京有色金属研究总院.
稀土金属及其氧化物化学分析方法[M]. 北京: 中国标准出版社, 1991.
|
| [2] |
武汉大学.
分析化学[M]. 第二版. 北京: 高等教育出版社, 1982.
|
 2001, Vol. 15
2001, Vol. 15
