| 空气-乙炔火焰原子吸收法测定钙的化学干扰机理及其消除 |
原子吸收分光光度法, 是建立在辐射光辐射到自由原子蒸气后, 入射光I0与透射光I 之比值, 来计算被测元素基态原子浓度N而求出被测元素的含量:
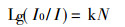
|
(1) |
被测元素基态原子浓度N的大小, 决定了该方法的灵敏度。为了能获得较多的基态原子, 必需设法提高雾化效率, 而雾化效率的提高, 却又与许多因素有关, 如雾化器的性能、试液的性质、试液的浓度、雾滴的大小、火焰的温度、被测物所生成的分子键能以及火焰的气氛等。
对于在雾化中雾滴的生成, 有人提出如下的经验公式〔1〕:
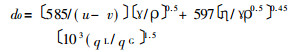
|
(2) |
式中:d0—为平均直径(μm);
u—为气体速度(m/s);
v—为液体速度(m/s);
γ—为表面张力(×10-5N/m);
ρ—密度(g/cm3);
η—为粘度(g/cm·s-1);
qL—为液体流量(cm3/min);
qG—为气体流量(cm3/min)。
由式(2)可知, 当流量小时, 第1项起主导作用; 当流量大时, 第2项对d0起主导作用。可以设想有一小雾滴, 其半径为r, 公式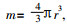
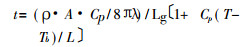
|
(3) |
式中:t—雾滴在火焰中脱溶剂的时间;
ρ—溶液密度;
A—雾滴表面积;
λ—溶液导热系数;
Cp—等压热容;
L—雾滴蒸发热;
T—火焰温度;
Tb—溶液沸腾温度。
当溶液介质确定之后, 唯有r是变数, 其余均为常数, 且当雾滴直径增大时, 雾滴在火焰中脱溶剂的时间t势必要延长, 则原子化效率也必然随之而降低。另外, 原子化效率还与被测元素M在火焰中的行为有密切关系。被测元素在火焰中的解离可用以下平衡式表示:
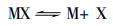
|
(4) |
空气-乙炔火焰反应机理较复杂, 半分解产物也比较多。若解离出来的被测元素M能与火焰中的成分起反应, 也将影响原子化效率, 即平衡式(4)中右边的M减少了, 这就明显降低了被测元素的灵敏度。
引起化学干扰的原因是待测元素不能从它的化合物中全部解离出来, 离解或生成了与吸收无关的分子的现象。一般来说, 氧化物在强还原性火焰中易于电离, 但氧化物离解能大时, 火焰的温度也有影响。共存元素与待测元素生成难挥发的化合物时, 也会产生干扰, 有铝、钛、硅、磷等共存时, 碱土金属的吸收强度下降。
1 溶剂的选择即使一个较好的雾化器, 其对试液的雾化效率一般来说仅5%~15%, 而其中原子化效率又只有5%~10%。当被测元素的化合物雾化后, 雾滴要在10-3~10-4s时间中完成脱溶剂、熔融、蒸发、解离等一系列复杂过程, 不选择物理性能好的试剂作为溶剂, 是难于达到提高原子化效率与分析灵敏度之目的。
在原子吸收分光光度分析中, 对试样的分解通常是采用无机矿物酸作为溶剂, 所用无机酸一般为盐酸、硝酸、氢氟酸、氢溴酸、过氯酸、磷酸和硫酸。据资料〔1〕介绍, 无机酸阴离子对钙的负作用依次为:
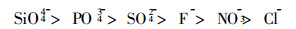
|
在上述酸中, 盐酸、硝酸、氢氟酸具有较小的表面张力, 粘度和密度也较小, 为此多被采用。
2 原子吸收分光光度分析中的干扰原子吸收分光光度分析中的干扰, 尽管相对于化学分析、极谱分析及发射光谱分析来说, 要少得多, 然而实践证明, 原子吸收分光光度分析中的干扰, 尤其对钙元素而言, 不仅明显存在, 甚至有时表现很严重。由于原子吸收分析法的显著特点之一, 就是在一般情况下, 不需分离共存元素, 将试样分解后, 制备成一定酸度, 就可直接喷雾原子化。下面简述几种阳离子对测定钙的干扰情况。
2.1 阳离子Al3+、Fe3+对钙的干扰机理试验证明, 在测定钙时, 阳离子的干扰主要是Al3+、Fe3+、Co3+、Ni3+、Ti4+、Nb5+、Ta5+、W6+、Mo6+等, 在这些阳离子的干扰中, 可分为凝相干扰和气相干扰, 前者为主要干扰, 后者为次要干扰。在Air-C2H2火焰中, 有着诸多的半分解产物, 如CO、CH、OH、O、H………等, 尤其在富燃火焰中, 这些半分解产物较丰富, 提供了良好的还原气氛。在火焰中, 整个反应受H+O2 →HO+O的控制, 而OH恰恰能与Ca生成Ca(OH)2, 其离子半径为0.099nm, 电荷较小, 库仑力也较小, 生成热△H =-986kJ/mol, 故在此火焰中较容易解离出来。
2.1.1 Al3+的干扰在1.5%(v/v)盐酸和0.5%(v/v)的硝酸混合介质中, Ca2+含量为10μg/mL, 加入不同量的Al3+, 测定其吸光度, 见表 1。
| 表 1 Al3+对Ca2+的影响 |
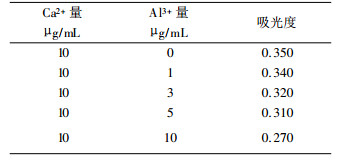 |
| 点击放大 |
表 1说明, 随Al3+量的增加, Ca2+的吸光度明显下降, 其原因可能是在火焰中, Al与Ca生成了nCaO·mAl2O3混合晶体, 降低了Ca的基态原子浓度。
(1) 生成CaO晶体。在Air-C2H2火焰中, Ca的4S2电子被激发到3d轨道, 而3d轨道未充满电子可以与O未成对的2个P电子进行杂化, 形成了d-π键, 其键距为0.24nm。因此, Ca在火焰中易生成CaO晶体, 其键能为4.1eV, 生成热为-627kJ/mol〔2〕, 熔点为2600℃, 沸点为2850 ℃, 而Air-C2H2火焰的燃烧速度为160cm/s, 其最高温度为2300℃〔1〕, 故所生成的CaO晶体, 在此火焰中的原子化效率小于0.07。
(2) 生成Ca、Al混合晶体。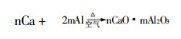
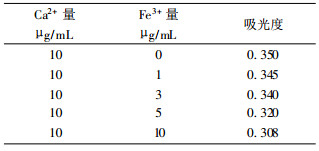
在1.5%(v/v)的盐酸及0.5%(v/v)的硝酸混合介质中, Ca2+含量为10μg/mL, 加入不同量的Fe3+, 测定其吸光度, 见表 2。
| 表 2 Fe3+ 对 Ca 的影响 |
 |
| 点击放大 |
由表 2可知, 随Fe3+量的增加, 对Ca2+的影响也加大, 一则生成了CaO晶体, 二则在火焰中Ca与Fe也生成了与Al相类似之混合晶体, 其晶格能5.6eV, 对热也很稳定, 但Al3+对Ca的干扰较Fe3+严重。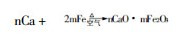
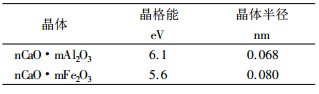
晶格能与晶体半径也较相近, Ca与Al、Fe形成的晶体主要物理性能〔2〕, 见表 3。
| 表 3 Ca与Al、Fe形成的晶体主要物理性能 |
 |
| 点击放大 |
2.1.3 其他阳离子干扰
阳离子Co3+、Ni3+、Ti4+、Si4+、V5+、Nb5+、Ta5+、W6+ Mo6+等在Air-C2H2火焰中对Ca的干扰也很严重, 其机理基本与Al3+、Fe3+相似, 故在此不再重述。
2.2 阴离子PO43-、SO42-、NO3-、Cl-对Ca的影响在50mL试液中试验, 试样经HNO3、HCl、H2SO4分解后, 蒸干至SO3冒尽, 分别转化为H3PO4、H2SO4、HNO3、HCl介质, 其酸度均为4%(v/v), 分别测量吸光度, 见表 4。
| 表 4 阴离子PO43-、SO42-、NO3-、C l-对Ca的影响μg/mL |
 |
| 点击放大 |
在上述4种阴离子中, 前两者喷雾量小, 吸光度显著下降, 影响大小依次为PO43-、SO42-、NO3-、Cl-, 其原因可能是HCl、HNO3的物理性能较好, HNO3与Ca可能生成了单氧化物〔CaO、Ca(NO3)2〕, HCl能与Ca生成蒸气压较大的CaCl2, 而H3PO4和H2SO4则与Ca生成Ca3(PO4)2和CaSO4, 这4种化合物的有关物理性能〔2〕列于表 5。
| 表 5 Ca3(PO4)2、CaSO4、Ca(NO3)2、CaCl2主要物理性能 |
 |
| 点击放大 |
从表 5可知, 这4种化合物在火焰中的热稳定性依次为Ca3(PO4)2 >CaSO4 >Ca(NO3)2 > CaCl2。它们在火焰中被解离后, 唯有CaCl2没有火焰中的成分〔O〕, 有利于分解反应的进行, 其在火焰中的解离度可达7%。
3 原子吸收分析中化学干扰的消除如前所述, 无论是阳离子的干扰还是阴离子的干扰, 其关键问题都是生成了高温难熔盐。通过试验, 阴离子的干扰, 在分解试样时, 只要选用物理性能好的酸, 如盐酸、硝酸, 而不引入如磷酸、硫酸等物理性能差的酸, 即使引入了, 也要尽量消除之, 这就解决了阴离子的干扰问题, 为此, 在对试样中钙的测定时, 一般是采用盐酸和硝酸作为介质。
在空气-乙炔火焰中, 由于还原气氛及火焰温度的限制, 产生了严重的化学干扰。为了消除这类干扰, 主要是利用温度效应、火焰的气氛等。另外, 在试液中适当加入释放剂、保护剂、助熔剂等, 或者改善雾化器的性能、预先分离干扰元素, 视具体情况而论。
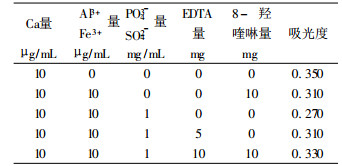
3.1 加入保护剂消除上述干扰较好的保护剂有EDTA和8-羟基喹啉。在酸性介质中, EDTA能与Ca2+生成络合物, 形成稠环, 使Ca2+不与干扰元素接触, 从而避免了生成高温难熔盐晶体, 而〔CaEDTA〕2-络合物表面带有两个负电荷, 能排拆PO43-、SO42-等阴离子; 8-羟基喹啉能与Al3+、Fe3+等阳离子生成络合物, 将干扰元素保护起来。
加入保护剂消除干扰情况见表 6。
| 表 6 加入保护剂效果 |
 |
| 点击放大 |
由表 6可知, 尽管在50mL体积的试液中, 加入了一定量的保护剂, 虽然不能完全消除Al3+、Fe3+、PO43-、SO42-等的干扰, 但有一定效果, 若再补加适量释放剂, 效果可能会更好。
3.2 加入释放剂有资料介绍, 较好的释放剂有锶盐, 因为锶较钙更容易与干扰元素生成更耐热的化合物:
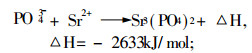
|
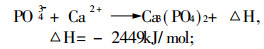
|
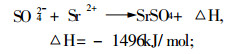
|
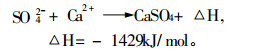
|
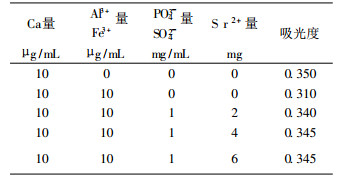
加入释放剂消除干扰情况见表 7。
| 表 7 加入释放剂效果 |
 |
| 点击放大 |
表 7说明, 在试液中加入适量锶盐, Al3+、Fe3+、PO43-、SO42-等的干扰基本可消除。
3.3 利用温度效应消除干扰不少资料介绍, 测定试液中的钙, 最好采用C2H2-N2O火焰, 因为N2O在700~1350℃即分解出N2和O2。
在反应中, 其分解速度是相当快的, 可达180cm/s, 相当于O2-C2H2火焰。氧-乙炔火焰燃烧速度为1130cm/s, 最高温度可达3060℃, 对生成的高温难熔盐在此温度下可解离出大量Ca基态原子, 另一方面, 在反应过程中还生成了许多半分解产物, 如NH、CN、C等, 又可提供良好的还原气氛, 均能夺取CaO中的O。
因条件所限, 未对C2H2-N2O火焰进行试验, 无法提供实验数据。
| [1] |
武内次夫, 铃木正已.
原子吸收分光光度分析[M]. 北京: 科学出版社, 1975: 31, 48, 80.
|
| [2] |
周振华译.
物理化学数据简明手册[M]. 北京: 科学出版社, 1962: 15, 46, 80, 90, 156.
|
 1999, Vol. 13
1999, Vol. 13
