| 富氧浸出机理及其在氰化提金中的应用 |
在当前的氰化法中,加速金的氰化浸出和降低氰化物消耗是影响氰化工艺技术和经济效果的两大关键因素,后者曾有许多系统研究论文,提出降低氰化物消耗途径和提高氰化指标的方法措施。金氰化浸出效果,主要取决于磨矿粒度、浸出pH、矿浆有效搅拌和适宜的氧化条件。实际上,金在氰化过程中的有效氧化是实现浸金的先决条件,但以氧作氧化剂时,其浓度受到水溶液中溶解度限制。因此,金氰化浸出是缓慢的动力学过程,其原因之一是由于溶液中氧的低浓度所致,而氰化总反应常受到氧的有效供给和有效利用率的影响,因而对提高溶解氧浓度和改善供氧条件的课题,受到人们的普遍关注。本文将系统地研讨富氧浸出机理及其在强化氰化工艺中的应用,旨在利用富氧浸出以加快浸金速度和提高金浸出率。
1 金氰化反应和氧在提金工艺中的重要作用[1~2]金化学性质稳定,某些单酸(盐酸、硝酸等)对金不起作用,金的溶解通常利用一种合适的氧化剂和配位体进行氧化-配位反应,使金氧化后形成稳定的配合物进入溶液而溶解。而某些单酸(如HOCl)、卤素气体(Cl2、Br2)和碘能很好溶金,是由于它们既是溶金的氧化剂,又能形成配位体与金生成稳定的配合物。在氰化法中,氧化剂可以是氧,而氰根(CN-)即为配位体。
金的氰化反应,早在1846年,Elsner通过实验提出下列反应式:
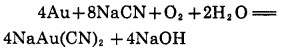
|
(1) |
Bodlander(1886)研究金氰反应认为是通过下列两个阶段进行的,并探测到溶液中有H2O2存在:
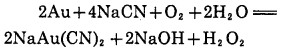
|
(2) |
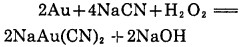
|
(3) |
后来一些研究人员(Barsky等人测定了Au(CN)2-配位离子自由能,并用于计算上述反应自由能变化,证明三个反应在热力学上是可行的。事实上(2)与(3)式合并即为反应式(1)。
按Osseo-Assare等人的现代电化学反应理论,金表面存在阳极区和阴极区,溶解时金从其表面阳极区中失去电子,与此同时,氧从金表面阴极区得到电子,电化学过程为:
阳极反应:
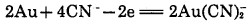
|
(4) |
阴极反应:
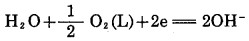
|
(5) |
或
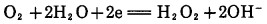
|
(6) |
上述反应中,若将(4)与(5)式合并,配平系数则为Elsner式(1), 而(4)与(6)式合并得到Bodlander(2)。因此,金的氰化溶解反应,其本质乃是电化学腐蚀反应,反应总方程式为Elsner式(1)。反应的自由能ΔG298=-190.6kJ/mol。根据Lnk=-ΔG/RT=33.38, 得k=2.4×1033, 显示其反应非常彻底,金溶解过程是一个不可逆过程,总反应式(1)应一直向右进行,直至溶解氧和氰化物耗尽为止。由此可见,要提高金的浸出率,就要有足够的氰化物和氧浓度,从金氰反应平衡常数,按式(1)为:
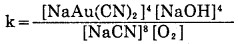
|
(7) |
在氰化生产中,假定[NaCN]和[OH-]基本保持恒定,则溶金产物浓度可表示为:
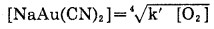
|
(8) |
说明氰化反应程度与溶解氧浓度的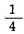
金的氰化反应是一个多相化学反应,当金表面积一定时,多相反应速度主要取决于反应物和生成物的扩散速度。Habasi基于上述反应的动力学过程, 利用式(2)以菲克(Fick)定律导出表达金氰化溶解的速度方程式:
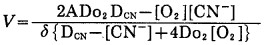
|
(9) |
表明金氰化速度(V)与水相相接触的金总表面积(A)、CN-和O2的扩散系数(Do2和DCN)、CN-和O2在反应溶液中的浓度([CN-], [O2])和扩散层厚度(δ)有关。
方程式(9)在实践中的应用讨论如下:
a.当[CN-]较低时,可将(9)式简化为式(10), 表明氰化物浓度较低时,金氰化溶解速度仅取决于[CN-],并成直线关系:
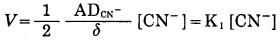
|
(10) |
b.当[CN-]较高时,则(9)式简化为式(11), 表明V随[O2]成正比:
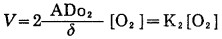
|
(11) |
c.当[CN-]与[O2]最佳匹配时,V最大,此时V既由CN-扩散控制,又受O2扩散控制,此时,式(10)和(11)均可描述氰化过程,即
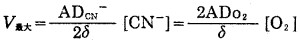
|
(12) |
式(12)代入CN-和O2平均扩散系数值(18~27℃)后得到:
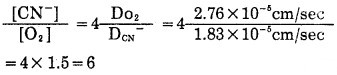
|
(13) |
表明V最大(极限速度)时,[CN-]与[O2]最佳比值为6, 与实验结果一致。古映莹[3]通过式(9)从数学上用微分方法找到V极大值,得到与式(13)相同的结果,认为该法数学处理严谨。Kndry和Kellogg(1954)[4]进行过类似工作,但他们根据式(1)推导出类似的速度方程式,得到稍微不同的[CN-]/[O2]比值,即:
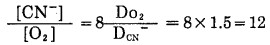
|
(14) |
大多数金氰化是在室温和大气压下为空气所饱和,此时相应溶解氧浓度为8.2mg/L, 因此,极限溶金速度时,NaCN浓度按式(13)或按式(14)计算为0.01%或0.02%。这为目前黄金生产中氰化物浓度一般控制在0.03%~0.12%之间的理论依据。
金氰化溶解反应是一个动态过程,是一个不断耗氧过程,耗氧反应越强烈,水或矿浆中溶解氧浓度越难饱和,因此,当[CN-]/[O2]达到临界值后,金电化学腐蚀反应耗氧速度常大于空气氧向水中溶解速度,溶液常处于缺氧状态,因而迫切需要利用富氧(包括充气、充氧、加压、加过氧化物等)以补偿和提高溶液中氧浓度,富氧浸出是强化氰化工艺的重要方法和手段。
2 富氧浸金机理及其应用 2.1 氧在水溶液中的溶解度及其氧化特性[5]利用空气中氧(或纯氧)氰化浸金,主要在液相内进行固液反应,因此,气体氧在液相中的溶解度是氰化浸金的关键因素。在一般情况下,氧在水中溶解度较小,当气体(空气和水蒸气)总压力为0.1MPa时,空气中的氧在水中的溶解度随着温度而变化,温度为0℃、10℃、20℃、30℃时氧的溶解度分别为:10.19ml/L、7.9ml/L、6.94ml/L、5.8ml/L。
根据亨利定律,在平衡条件下,气体在液相中的溶解度与其在气相中的分压成正比,当氧化过程在水溶液中进行时,在一定温度下,气相中水蒸气的分压占有一定比例,故总压力(P总)可看成,气体氧化剂分压(P气)与水蒸气分压(P水)之和。若过程是在密闭条件下进行的,气体总压力一般为0.1MPa, 气体氧化剂所占比例为(0.1-P水)MPa, 随着温度的升高,气相中的P水迅速增加,P气相应减小,相对变化情况如表 1。
| 表 1 P水与(0.1-P水)MPa随温度相对变化情况 |
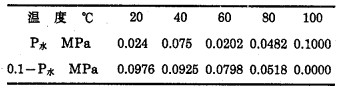 |
| 点击放大 |
由此可见,要提高温度来获得必须的氧化速度,则应创造系件,使系统同时保持足够的氧分压。为此人们一开始就采用富氧空气,进而采用工业氧气,以致采用高压氧气,将溶液沸腾温度提高到100℃以上。
水中酸、碱、盐对氧的溶解度影响较大,通常,当温度和氧分压一定时,苛性碱、强酸及盐类使氧溶解度下降,而弱酸碱可提高氧在水中的溶解度,因此,反应试剂的低浓度和低温度是使氧参加湿法冶金化学反应的重要条件。
在黄金湿法冶金中,氧的作用机理比火法过程复杂得多,在火冶或焙烧处理时,高温产生的能量易使氧双键O=O破裂,创造了原子氧直接参与反应的条件,而在湿法提金中,利用空气是根本不能实现的。这样,就只依靠众多的均质和非均质的氧化还原体系的生成,各种平衡反应进行湿法浸出,以及利用过氧试剂在碱性氰化液中放氧过程产生活性原子氧以改善氧化条件。
2.2 氧的氧化能力在室温下,氧气在酸性或碱性介质中显示出一定氧化性,有关反应方程和标准电极电位如下:
酸性溶液中:
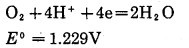
|
(15) |
碱性溶液中:
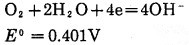
|
(16) |
当利用只有一个电子的还原剂(如离子H+等)时,中间产物为HO2-,下述反应电极电位如下:
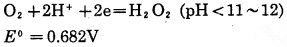
|
(17) |
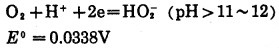
|
(18) |
动力学研究表明,式(15)这样高的E0值未能实践证明反应进行的可能性,由此可见,氧气的实际氧化能力是很低的。在氰化法中,利用碱性中氧的氧化反应足于溶解金,是由于溶液存在NaCN, Au+与CN-形成稳定的Au(CN)2-配位离子,使Au+/Au标准电位E0降低(由1.71V降低到-0.61V)而发生溶金反应。在湿法冶金中,利用高压氧(以纯氧形态或压缩空气方式)并非提高它的氧化能力,而是借助于它解决过程动力学问题。
氧以溶解形式参与化学反应,按照亨利定律,它在溶液中的浓度与其分压(PO2)成正比。在氰化浸金中,无论在动力学过程或静态过程中,改善供氧工艺条件,以保证氧在溶液中极度饱和显得特别重要。
由于气体氧在水溶液中溶解度低及其反应能力不高的局限,在实际浸金中还受到盐效应、矿物中耗氧、耗氰组份的干扰影响。因此,在金矿浸出中,常利用沉淀、配位、催化等反应以消除或减弱有害杂质的干扰,如碱预浸除Fe、As等,氨浸除Cu、Co、Ni等杂质干扰,以确保和提高分子氧的氧化效率。
2.3 充空气氧化浸金 2.3.1 充空气常压氰化浸金常规氰化利用搅拌卷入空气的氧扩散溶解于水中速度,常小于氰化时氧的消耗速度。图 1为金精矿充空气氰化浸出率、溶解氧浓度与浸出时间的关系。从图 1表明,充空气氰化由于使矿浆溶解氧浓度高于常规机械搅拌的溶解氧浓度,使接近氧饱和状态,因而氰化速度明显加快。我国研制的氰化浸金反应器[6], 以充空气加搅拌装置,结合流体和空气力学原理设计制造,能使气固液三相充分接触,使氧迅速扩散到矿物表面,因而提高反应速度和浸出率。经小型试验对金浸出率达97%, 浸出时间1.5h。
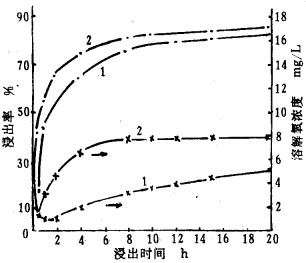 |
| 1.常规氰化; 2.充气氰化. 图 1 金精矿充气氰化的浸出率、溶解氧与浸出时间的关系 |
2.3.2 充空气加压氰化浸出
图 2是水溶液中溶解氧浓度与空气压力关系。随着压力提高,溶解氧浓度成比例增加。常压下充空气氰化因氧分压仅0.0213MPa, 无论充空气量多大,溶解氧浓度只能接近空气中的溶解度值,只能补偿氧消耗,不能提高氧浓度,而加压才可大幅度提高氧浓度。利用密闭体系加压空气,由于提高氧浓度,因而提高金浸出速度和浸出率。西德Lurgi公司[7]曾利用超压5MPa、温度至120℃于高压釜中对易浸金矿氰化,反应完全时间为10min(常规氰化为24h), 该法已在南非用于难浸锑和砷精矿。
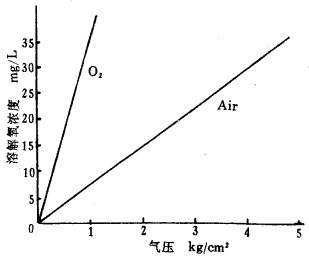 |
| 图 2 空气压力与水溶液中溶解的关系 |
2.4 充氧气氰化浸出 2.4.1 密闭体系下充氧氰化浸出
密闭体系中所接触的气体氛几乎全部是氧,氧分压与气体氛总压相等,如表 2可知,根据亨利定律,氧溶解度与氧分压成正比。当氧压为0.1013MPa(20℃)时,水与氧接触达平衡时,所测氧溶解量比水与空气接触时所测氧溶解量高达4.8倍,该比值几乎和气相中氧分压的比值相同。
| 表 2 20℃下氧的溶解度 |
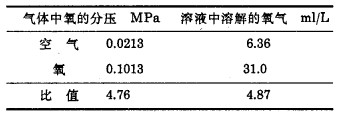 |
| 点击放大 |
Finkelstein(1972)对金氰化过程速度控制问题讨论中指出:当[CN-]/[O2]比值超过一临界值后,金溶解速度正比于氧浓度,而与氰化物浓度无关。美国氰胺公司报告表明,在NaCN浓度10g/L溶液中,金溶解速度与氧浓度成正比。
图 3是某金矿样在氧加压和大气压下氰化浸出率与浸出时间的关系。充入氧压2.026MPa, 氰化浸出完全仅30min, 而大气压下需耗时26h。可见由于氧压成倍增加,使氧浓度成倍增加,从而使浸出速度成倍增加。
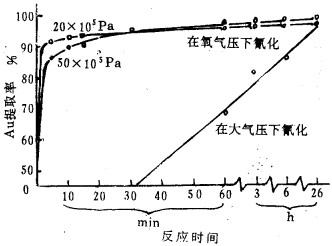 |
| 图 3 在高氧压下金的浸出率与浸出时间的关系 |
2.4.2 开放体系中充氧氰化浸出
从图 4可知,当氧气用量为0.4m3/t时,充入氧气刚好抵消氧的消耗;用量大于0.4m3/t时,溶解氧浓度迅速增加;而氧用量大于3.86m3/t以后,溶解氧浓度增加缓慢,新增加的氧大都逸出了,因此,开放体系充入少量的氧气以补偿浸金反应等的消耗,并提高了氧在矿浆中的溶解度。
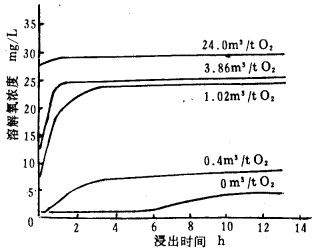 |
| 图 4 原矿不同充氧量下溶解氧浓度与浸出时间的关系 |
在开放体系下充氧气,矿浆处于空气和氧气之间。即:
a.从矿浆(液-固-气)和空气接触界面上,矿浆表面的氧气分压是0.0213MPa, 无论充氧多少,改变不了大气层中氧组份浓度(由于对无穷大的大气层)。b.从矿浆-氧气界面上看,界面接触气相为100%是氧,如通入氧气0.1013MPa, 从表 2可知,矿浆与氧接触界面上氧溶解度高于与空气接触界面上的4.8倍,如耗氧速度较小,此时溶解氧浓度达35mg/L, 氰化速度快4倍左右。
充氧浸出工艺(CIG)试验证明,对氧化矿的金浸出率提高1%, 而对硫化矿可提高4%, 工厂生产能力超过设计规模的65%。东坪金矿采用CIG工艺后,加快浸出速度,设备处理能力由300t/d提高到643t/d, 每吨矿节约NaCN约0.27kg[8]。乳山金矿工业试验结果,金浸出率提高5.64%, NaCN单耗降低0.5kg/t[9]。充氧炭浸工艺(CILO)由于活性炭对氧强烈吸附,使氧气活化,并使溶解氧含量由原来7×10-4%提高4~5倍,从而加快浸金速度和提高金浸出率。
2.5 加过氧化物氰化浸出过氧化物如H2O2、Na2O2、CaO2和H2SO5等这类氧化剂,目前应用较多的是H2O2、Na2O2、CaO2。
2.5.1 加H2O2的氰化浸出根据反应式(3), 加H2O2于氰化溶液中有利于浸金,已成为氰化提金助浸工艺方法(称PAL法),在国内外得到广泛研究与应用[10~11]。H2O2具有很强的氧化还原性。在酸性介质中是一种强氧化剂(E0=1.776V), 在氰化碱性条件下。按反应:
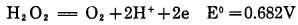
|
(19) |
式(19)分解放氧过程中产生活性原子氧(H2O2=H2O+[O],2[O]=O2),随pH增加有利于放氧过程。在碱性氰化溶液中,H2O2易与金表面接触加速分解,增加金表面含氧量,活性氧均匀分布充分弥散于氰化溶液中,较好解决了压缩空气或纯氧气体供氧问题,加速浸金以优化氰化工艺。据报导:当加入少量H2O2(500~1000g/t矿)氰化浸出时间由24~48h缩短到2~6h, 浸出率达96%。应用H2O2的主要优点:加速动力学过程,降低氰化物用量,提高金回收率以及节省投资费用[12]。如山西某矿[13]投产10多年来一直沿用混汞-氰化-锌置换流程,金总回收率在70%左右,改用H2O2代替压缩空气后,不用混汞,一次氰化浸出率在90%以上。陕西某矿选金氰化厂[14],以每吨矿石加0.14kgH2O2助浸,仅6h达到常规氰化24h的浸出效果,预计生产能力由500t/d提高到1200t/d矿石,节约投资162万元。再如一家工厂,原先用氧作氧化剂,溶解氧以3.0×10-3%条件浸出最佳,而使用PAL工艺后,矿浆含氧仅保持1.2×10-3% (即降低了),但金浸出率却比充气工艺提高7%[15], 证明使用H2O2时,活性氧利用率更高。H2O2也可用于炭浸氰化工艺,收到相同效果。
2.5.2 加其他过氧化物的氰化浸出在碱性条件下,其他过氧化物通过生成中间产物H2O2,如方程式(20)到(23), 产生活性原子氧,高锰酸钾通过分解也产生原子氧,如方程式(24)。
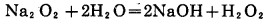
|
(20) |
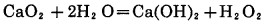
|
(21) |
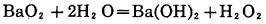
|
(22) |
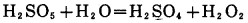
|
(23) |
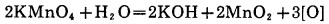
|
(24) |
过氧化物分解产物原子态氧或氧气,补偿了耗氧反应造成的供氧不足,提高矿浆溶解氧浓度(高达30mg/L),提高幅度虽不大,但其中原子氧直接与金表面接触,优化供氧和有效氧化,因而提高浸出速度和浸出率收到显著效果。
常用过氧化物主要是H2O2和CaO2, 研究放氧规律表明[16], CaO2在高pH环境下比较稳定,pH11以后放氧速度趋于均速放氧,缓慢均匀放出原子氧或分子氧,具有缓和氧化作用,比H2O2产生副反应减少,因而CaO2更为适用。试验证明:以CaO2代替H2O2,NaCN单耗为0.98kg/t矿石,比原工艺节约30%, 而CaO2耗量(0.098kg/t矿石)也比H2O2耗量(0.2~0.5kg/t矿石)降低32%左右。
3 结语金氰化反应在热力学上是极为彻底的,而动力学缓慢过程决定金溶解速度,与氧扩散和低浓度有关,当[CN-]/[O2]达到临界值后,根据菲克定律,金浸出速度与溶解氧成正比,氧在氰化反应中起着极为重要作用。
常规氰化机械搅拌,由于自吸空气量较小,不能抵消金氰反应和其他副反应的氧耗,以致严重缺氧,因而在实践中改善供氧条件进行富氧浸出显得特别重要。通过补偿氧消耗或提高氧浓度或两者兼用,以提高浸出速度和金浸出率。
充常压空气主要通过补偿氧消耗提高浸出速度;充氧和加压(空气或纯氧)氰化工艺,则通过提高氧浓度以提高浸出速度,而后者提高浸出速度的幅度较大。而利用供氧体氧化剂,即加过氧化物氰化工艺,虽然氧浓度提高不大,但产生活性氧直接与金接触有效氧化,改善有效氧供给和利用率,大大提高浸金速度,这从热力学计算结果所证实,应用前景看好。
| [1] |
张兴仁. 氧在金矿石氰化浸出过程中的重要作用[J].
矿产综合利用, 1994(2): 18–24.
|
| [2] |
Haque K E. The role of oxygen in Cyanide leaching of gold ore[J].
CIM Bulletin, 1992(9): 31–38. |
| [3] |
古映莹. 金氰化过程氰根与氧气浓度的最佳比值[J].
黄金, 1994, 15(6): 50–52.
|
| [4] |
赵捷, 乔繁盛.
黄金冶金[M]. 北京: 原子能出版社, 1988: 8.
|
| [5] |
毛月波, 祝明星. 富氧在有色冶金中的应用. 冶金工业出版社, 1988. 56
|
| [6] |
张静轩, 李志勤. 高效氰化反应器[J].
黄金, 1992, 13(10): 63.
|
| [7] |
Pieth H B, et al. pessure leaching of ores Contai-ning precious metals[J].
Ertmecall, 1983, 36: 261–265. |
| [8] |
李文建. 金泥氰化富氧浸出的应用[J].
黄金, 1955, 16(8): 28–30.
|
| [9] |
陈天贵, 王吉青. 纯氧在金浸出过程中的应用[J].
黄金, 1992, 13(7): 41–43, 47.
|
| [10] |
用H2O2溶液增加金和银氰化浸出率. 国外黄金参考, 1993, (8): 22~26
|
| [11] |
张兴仁. 提金工艺中H2O2的应用研究[J].
矿产综合利用, 1992(3): 21–27.
|
| [12] |
张兴仁. 试论过氧化氢在提金工艺中的应用[J].
采金技术, 1992(3): 27–31.
|
| [13] |
张金叶, 王晓飞, 陈金武. H2O2在氰化法浸金中的应用[J].
黄金, 1991, 12(2): 42–44.
|
| [14] |
李晓文. H2O2助浸新工艺的试验研究[J].
吉林冶金, 1993(4): 15–17.
|
| [15] |
张兴仁. 强化氰化工艺, 提高浸金效果[J].
矿产综合利用, 1994(6): 35–41.
|
| [16] |
金镜官, 蔡殿忱, 邱万忠. 过氧化物助浸剂放氧规律的研究[J].
黄金, 1995, 16(3): 29–34.
|
 1996, Vol. 10
1996, Vol. 10
