| 分光光度法测定铜电解液中高含量铜 |
2. 长沙有色金属专科学校, 长沙 410012
2. ${affiVo.addressStrEn}
铜电解液中高含量铜的测定,已报导的有碘量法、光度滴定法及离子选择电极法。由于铜电解液中含有大量其他共存元素,分光光度法的研究相对较少。
为了便于过程自动分析,本文对环己二胺四乙酸(CDTA)光度法进行了研究。重点研究了Ni、Fe等的干扰及消除方法。拟定的分析方法简便、快速,经试样分析表明,方法准确度及精密度均好。
1 实验部分 1.1 仪器与试剂分光光度计 721型;
酸度计pH S-2型;
铜标准溶液:1.000mg/ml, 以硫酸铜配制:
环己二胺四乙酸:3%, 称3gCDTA, 滴加30% NaOH溶解后,以HCl(1 + 1)调至中性,水稀至100ml。
缓冲溶液:pH 2.5, 将50ml 0.2mol/L邻苯二甲酸氢钾与36ml 0.2mol/L HCl混合,水稀至200ml。
所用试剂均为分析纯。
1.2 试验方法分取1.000mg/ml铜标准溶液2.50ml于50ml容量瓶中,加入3% CDTA 1.5ml, 用1 mol/L NaOH及1 mol/L HC1调至pH2.5, 加缓冲溶液l0ml, 以水稀释至刻度。以水为参比用3cm比色皿于700nm处进行测定。
2 结果与讨论 2.1 吸收光谱Cu、Fe、Ni与CDTA配合物的吸收光谱如图 1所示。表明Cu-CDTA配合物的λmax= 7 00 nm, 在此波长下,Fe-CDTA, Ni-CDTA也有吸收,对Cu的测定有干扰,其最大吸收波长均小于390nm, 在690~700 nm范围吸光度最小且基本不变。
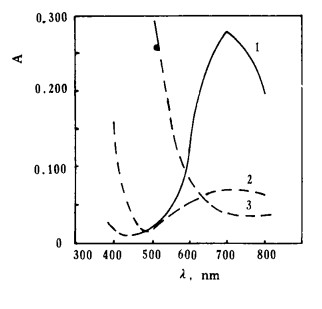 |
| 1—Cu-CDTA; 2—Ni-CDTA; 3—Fe-CDTA, 图 1 吸收光谱 |
2.2 显色条件
研究表明,该显色体系的最佳酸度范围为pH2~3。缓冲溶液用量在5~20ml范围。3%CDTA的加入量大于lml。显色体系的吸光度即达最大且为定值。本文选择显色条件如下:显色酸度为PH2.5, 缓冲溶液加入量为10ml, 3%CDTA加入量为1.5ml。在该条件下,显色反应迅速,且48h内不变。本文选择在显色5min后进行测定。显色剂用量对吸光度的影响见表 1。
| 表 1 显色剂用置对吸光度的影响 |
 |
| 点击放大 |
2.3 线性浓度范围
本选定的显色条件下,Cu含量在0~4 mg/50ml范围内呈线性。标准曲线的回归方程为Y = 0.l099x-0.0064。相关系数为0.9992。根据标准曲线计算,其表观摩尔吸光系数为1.15×102。
2.4 干扰及消除方法 2.4.1 Ni的干扰试验进行了不同量Ni (Ⅱ)对2.5mg/50mlCu的影响,结果绘于图 2, 表明Ni有负干扰。本文进一步测定了不同量Ni(Ⅱ)与CDTA配合物的吸光度见图 3, 表明Ni在5~25mg/50ml范围内的吸光度与Ni(Ⅱ)量成正比。由此可知,Ni的负干扰是由于Ni(Ⅱ)与CDTA配合能力较强,致使Cu(Ⅱ)与CDTA配合不完全造成的。为此进行了加大CDTA用量试验,表明3%CDTA的加入量大于6ml时,两者的吸光度具有加和性。
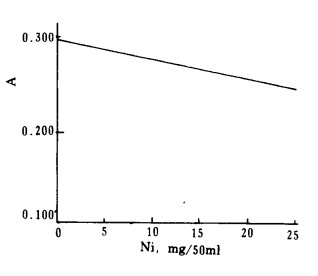 |
| 图 2 Ni对Cu-CDTA吸光度的影响 |
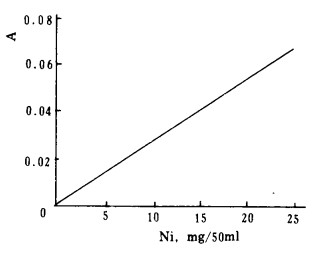 |
| 图 3 Ni-CDTA的吸光度与Ni量的关系 |
2.4.2 Fe的干扰
同样试验了Fe(Ⅲ)的影响。在3%0CDTA加入量大于6ml时,Fe(Ⅲ)-CDTA与Cu(Ⅱ)-CDTA的吸光度亦具有加和性。
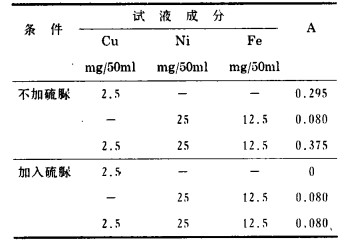
2.4.3 Ni和Fe干扰的消除试验进行以硫脲掩蔽Cu进行差减的方法消除Ni、Fe的干扰。结果表明,在10ml 3% CDTA存在时.对于含有2.5mgCu(Ⅱ)、25mgNi(Ⅱ)及12.5mgFe(Ⅲ)的试液体系,加入10ml 15%硫脲可使Cu(Ⅱ)完全掩蔽,仅Ni(Ⅱ)、Fe(Ⅲ)仍与CDTA定量配合见表 2, 以此可以通过差减消除其影响。
| 表 2 硫脲掩蔽效果 |
 |
| 点击放大 |
2.4.4 其他共存元素的影响
根据铜电解液中其他共存元素的最高量.试验了对测定Cu的影响。在选定的显色条件下,表明1.5 mgAs(Ⅲ). 0.5mgBi(Ⅲ), Sb(Ⅲ), 0.15 mgTe(Ⅳ)及0.05mgSe(Ⅳ)对2.5mgCu不干扰。
3 试样分析 3.1 分析步骤移取铜电解液2份于两个50ml容量瓶中,其中1份加入l0ml 15%硫脲,然后均加入10ml 3%CDTA, 以下按试验方法进行。以2份试液的吸光度差偵,根据标准曲线求出Cu的含量。以此计算铜电解液中Cu的含量。
标准曲线绘制:分取铜标准溶液系列按试验方法进行,3%CDTA加入量为10ml。
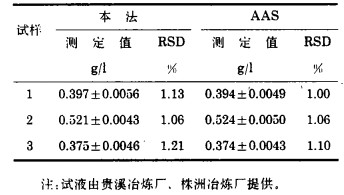
3.2 分析结果的准确度及精密度利用本法分析了冶炼厂铜电解净化液,并与AAS法结果对照见表 3, 表明结果准确度及精密度均符合要求,可用于生产现场快速分析。
| 表 3 铜电解净化液中铜的分析结果 |
 |
| 点击放大 |
4 结论
本法使用仪器简便、方法快速,准确度、精密度好, 为控制铜电解生产过程提供了一种现场快速监测方法。
 1995, Vol. 9
1995, Vol. 9
