| 关于钨矿物原料氢氧化钠分解的几个理论问题的浅见 |
氢氧化钠分解法为当前工业上分解钨矿物原料的主要方法之一,但由于有关基础研究还不够,因此对某些基本理论问题尚没有严格的统一的说法。现根据某些实验结果及热力学资料谈谈本人的浅见。
1 关于分解的基本反应 1.1 黑钨矿关于黑钨矿用NaOH分解时的反应,人们的看法不尽一致,许多学者〔1〕认为铁锰是变成氢氧化物,即反应为:
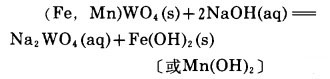
|
(1) |
也有些学者认为铁锰变成相应的氧化物,即
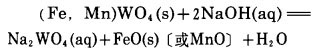
|
(2) |
两者的分歧在于铁锰生成物的形态。其实生成氢氧化物或氧化物决定于两者的相对稳定性,例如对铁而言决定于以下反应的标准自由焓变化。
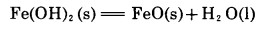
|
(3) |
根据文献〔2〕的数据进行热力学计算得反应(3)的标准自由焓变化ΔG(3)0与温度的关系如表 1所示:
| 表 1 ΔG(3)°与温度的关系 |
 |
| 点击放大 |
从表 1可知,在标准状态下,当温度低于102℃, 则反应向生成Fe(OH)2的方向进行,Fe(OH)2稳定化合物;高于102℃则向生成FeO的方向进行,FeO稳定。同时应当指出,在实际碱分解体系中,水是处于溶液状态,其活度小于1,因而有利于反应向生成FeO和H2O的方向进行,故反应(3)的平衡温度将低于102℃。
至于Mn(OH)2与MnO之间的平衡,由于目前缺乏有关Mn(OH)2的标准生成自由焓与温度关系的准确方程式,因此难以准确确定下反应:
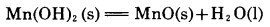
|
(4) |
在标准状态下的平衡温度,但多方面的资料表明,该温度在220℃以上,主要依据为:
a. L.G.Berg〔3〕测得当Mn(OH)2离解为固体MnO和液体水时,其25℃反应的标准自由焓变化ΔG2980为62.9kJ/mol, 标准熵变化为151.6J/mol·K,根据上述数据,近似求出反应(4)的平衡温度为442℃,高于442℃则反应向生成MnO的方向进行,MnO稳定。
b. 根据J.C.Bailar〔4〕的介绍,Mn(OH)2在25℃的标准生成自由焓为-621.6kJ/mol, 标准熵为96.6J/mol·K,结合文献〔5〕的数据,求出反应(4)的平衡温度为246℃。
c. T.Dupuis 〔6〕用热谱法对Mn(OH)2进行了热分析,指出220℃时Mn(OH)2离解为MnO和水蒸气。看来T.Dupuis的结果与J.C.Bailar等的数据十分接近。
考虑到工业上黑钨精矿NaOH分解的温度均在180℃以下,因此在没有氧化剂存在的条件下,锰的生成物主要是Mn(OH)2 (有氧化剂存在的条件下,Mn(OH)2可能进一步氧化成Mn3O4)。
综上所述,在没有氧化剂存在的条件下,工业上NaOH分解黑钨精矿时(温度均高于l02℃),主要反应为:
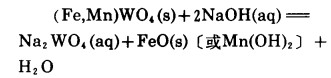
|
白钨矿用NaOH溶液分解的反应式一般写成:
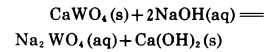
|
(5) |
根据反应前后物质的物理化学性质,在通常的分解温度范围内(100~180℃)和液固比不太小的条件下无疑是对的,但由于Na2WO4在NaOH溶液中的溶解度随NaOH浓度的升高而急剧降低,例如根据我们的测定,l00℃时Na2WO4在40g/L的NaOH溶液中的溶解度为675.5g/L, 而在480 g/L NaOH溶液中的溶解度仅为76.0g/L,因而当液固比较小而残余的NaOH浓度较大时,则生成的Na2WO4可能过饱和以致部分以固体钨酸钠形态存在,即Na2WO4不完全是水溶液形态存在,这种情况对研究过程的热力学、动力学以及研究其工艺过程应充分予以考虑。
2 关于反应的热效应 2.1 黑钨矿NaOH溶液反应的热效应有的作者认为工业上黑钨矿NaOH分解过程为放热过程,其主要依据是根据热力学计算,反应的生成物与反应物的标准热洽之差为负值,例如对下反应而言
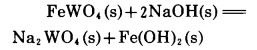
|
(6) |
其在25℃和100℃的ΔH°分别为-72.65kJ和-74.97kJ, 对反应
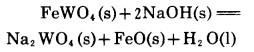
|
(7) |
而言,其在150℃时的ΔH°为-55.59kJ。
但是理论分析和实际测定都表明上述说法是不恰当的。
从理论上来分析,在实际分解过程中NaOH是处于水溶液状态而不是上述计算中所用的固态,由于固体NaOH溶于水是一个强放热过程,其溶解热效应远大于Na2WO4, lkg固体NaOH溶解成不同浓度的NaOH溶液时所放出的热量如表 2所示。从表 2可知,固体NaOH在溶解成NaOH溶液时,已放出大量热,即NaOH溶液的热給远比固体NaOH小,相应地使分解反应的ΔH°增大,根据文献〔2〕数据算出,当反应(6)中NaOH为水溶液,则25℃和100℃时的ΔH°值分别为+ 10.15kJ和+ 27.59kJ, 当反应(7)中NaOH为水溶液,则150℃时ΔH°为+ 61.7kJ, 即都是吸热反应。
| 表 2 固体NaOH的溶解热与生成的NaOH溶液浓度的关系〔7〕 |
 |
| 点击放大 |
在实践中我们曾多次测定不同成分的黑钨精矿和中矿用NaOH分解时的升温曲线,试验在密闭反应器中进行,钨矿及NaOH和水预先加入反应器,然后控制一定的加热功率进行加热升温,测温用的热电偶通过密封管伸入矿浆内,以直接测得升温过程中温度与时间的关系,其中四次的典型曲线如图 1所示。
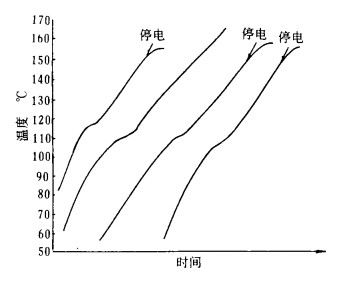 |
| 图 1 黑钨精矿与NaOH溶液反应的升温曲线 |
从图 1可知,在黑钨矿与NaOH溶液急剧反应的温度范围内(110~120℃), 升温速度明显减小,显然这是反应吸热所致,经过20~30min后,大部分矿已反应完全,反应速度慢,单位时间内反应吸热量迅速减少,因而恢复原有的升温速度。
2.2 白钨矿与NaOH溶液反应的热效应热力学计算表明,当白钨矿与固体NaOH反应生成固态Ca(OH)2和Na2WO4时,也是放热反应,其在50℃、1Q0℃、150℃时的ΔH°值分别为-51.9, -52.1,-52.4kJ, 这方面与黑钨矿十分相似。
对白钨矿与NaOH溶液的反应,即
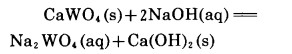
|
而言,我们系统测定了其在不同温度下的平衡常数,并进而根据等压方程计算出其在70 ~90℃时的ΔH°为30.40kJ,90~130℃时AH。为36.56kJ, 130~150℃时ΔH°为39.65kJ, 因此为吸热反应。
综上所述,不论是黑钨矿或白钨矿,其与固体NaOH的反应为放热反应,而在湿法分解过程中,即当与NaOH溶液反应时,其过程为吸热反应。
3 关于在工业条件下能否用NaOH溶液分解白钨矿许多学者根据热力学计算得出,反应(5)的平衡常数Ka很小,约为10-3~10-4我们通过实验具体测定其平衡常数亦为10-3±, 例如在70℃、90℃、130℃和150℃时分别为1.00×10-3,1.8×10-3,6.00×10-3,10.5×10-3,因此过去许多国内外学者认为要保证反应(5)向右进行,则NaOH应大大过量,以致远远超过工业上所能接受的限度,故得出结论为NaOH分解工艺不可能分解白钨矿,甚至用该工艺处理黑钨精矿时,只有当其中钙(白钨)含量小于1 %左右才能保证足够的分解率。
上述观点是不够全面的,其实平衡常数仅表征反应平衡时生成物与反应物的活度商,而实践中直接用以控制过程、决定反应效果的是物质的浓度,直接决定反应剂(如NaOH)额外消耗(指按化学计算消耗量以外的消耗)量的也是其反应后的剩余浓度,因此用反应平衡后的浓度商Kc来研究反应过程更有实际意义。
Kc的定义及其与Ka的关系可用下式表示,以反应(5)为例:
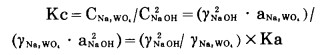
|
式中 CNa2WO4, 、CNaOH——分别为平衡时,Na2WO4和NaOH的浓度;
γNa2WO4、γNaOH——分别为Na2WO4和NaOH在溶液中的活度系数。
因此Kc值不仅与Ka有关,而且与Na2WO4和NaOH在溶液中的活度系数有关,Ka在一定温度下为常数,但γ值却随溶液的浓度及其它物质的存在而变,因而控制适当的条件仍可设法提高γNaOH以提高Kc值,相应地使反应向有利于分解方向进行。
而NaOH溶液的特点是其平均活度系数随其浓度的增加而迅速增加,其70℃的平均活度系数与浓度的关系如表 3所示。
| 表 3 NaOH溶液的平均活度系数(70℃)〔8〕 |
 |
| 点击放大 |
因此提高NaOH浓度,相应地提高其活度系数是提高Kc的有效措施之一,当然添加适当的添加剂同样能达到此目的。我们的实测表明:在150 ℃时,当NaOH浓度由2.54mol/L增加至3.191mol/L时,Kc值由1.3×10-2增至1.6×10-2比Ka值增大60%以上,因此只要控制适当的条件,在工业条件下用NaOH分解白钨矿是完全可能的。我们在多个工厂进行了多种白钨精矿和白钨细泥NaOH分解的试验,并正式投入工业生产,其结果如表 4所示。从表 4可知,用NaOH分解白钨精矿或白钨中矿,其效果是令人满意的。
| 表 4 NaOH分解白钨矿的技术经济指标(工业试验数据) |
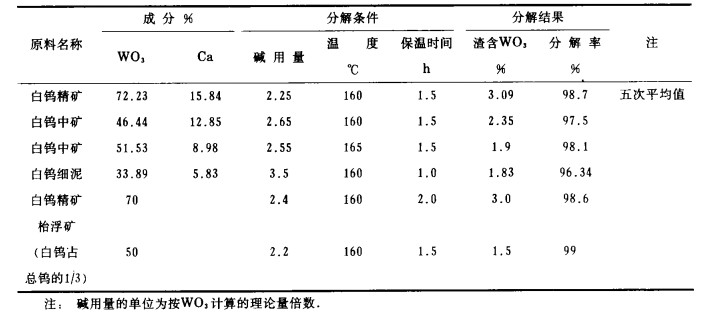 |
| 点击放大 |
4 关于钨矿物与NaOH反应的机理
有不少学者在其著作中指出,由于在黑面,阻碍了反应的进行,或者说反应的控制步骤为通过生成物膜的扩散过程,这些学者对上述说法并没有提出充分的实验依据,唯一的是发现在NaOH分解黑钨矿的过程中,钨矿NaOH分解过程中生成Fe(OH)2 (或Mn(OH)2)要求将矿进行细磨,使90 %左右能小于Mn(OH)2)膜,它包覆在未反应矿粒的表面, 阻碍了反应的进行, 或者说反应的控制步骤为通过生成物膜的扩散过程, 这些学者对上述说法并没有提出充分的实验依据, 唯一的是发现在NaOH分解黑钨矿的过程中, 要求将矿进行细磨, 使90 %左右能小于44μm, 才能保证得到高的分解率。
我们对〔9, 10〕黑钨矿及白钨矿的NaOH分解过程的机理进行了较全面的研究,得出的结论与上述观点有所不同。
对黑钨矿而言,我们将被NaOH部分分解的颗粒进行电子扫描微区分析,发现部分分解后的黑钨颗粒中铁、钨、锰的成分分布如图 2所示。从图 2可知,整个矿粒断面上铁、钨、锰的比例基本不变,在靠近表面层并没有单独的铁锰化合物层,说明反应生成的铁锰化合物已从矿粒表面脱落,更谈不上形成致密膜以阻碍反应的进行了。另外我们进一步测得70~105℃黑钨矿NaOH分解过程的表现活化能为77.37kJ/mol, 更证明在工业上通常的分解温度范围内,当搅拌速度足够快以致外扩散不成为控制步骤时,控制步骤不是通过生成物膜的内扩散,而是化学反应过程。
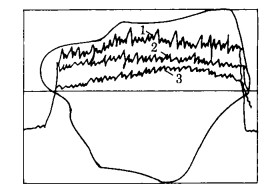 |
| 1-钨;2-锰;3-铁。 图 2 部分浸出后黑钨矿的电子探针微区分析 |
对白钨矿而言亦得出类似结论,70~ 105℃范围内其NaOH分解过程的表现活化能为58.83kJ/mol, 因此亦属于化学反应控制。
总之,在搅拌足够快(外扩散速度足够快)时,当前工业上钨矿物的NaOH分解是化学反应控制,强化过程总速度的关键在于强化化学反应速度,例如提高温度及对物料进行活化,加大物料的比表面积等,当前对矿的细磨主要是加大其比表面积,而不是减少生成物膜的厚度。
总的看来,尽管钨矿物NaOH分解工艺已在国内外广为采用,在工业上已比较成熟,但有关理论研究却远远落后于生产实践,对许多实际问题的解释缺乏严谨的理论依据,有的仅凭臆测,而在本工艺已发展到目前这样较高水平的情况下’要进一步提高则仅靠实践经验或一些简单的参数研究是不够的,因此有必要加强较深层次的基础理论研究,以便指导实践,使之提高到一个新水平。
| [1] |
Зeликмaн A. H. и Дpy: Meтaллyprия Рeдкиx Meтaллов, Mocква: Meтaллyprия, 1991. Ctp. 33.
|
| [2] |
相显万, 等.
高温水溶液热力学数据计算手册[M]. 北京: 冶金工业出版社, 1983: 218.
|
| [3] |
Berg L G. Gmelin's Handbuch der anorganischen Chemie 56 Teil C 1 380
|
| [4] |
Bailar I G. Comprehensive Inorganic Chemistry oxford 1973. 799.
|
| [5] |
O. 库巴谢夫斯基等著. 邱竹贤等译. 冶金热化学. 北京: 冶金工业出版社, 1985. 3b6
|
| [6] |
Dupuis T. Gmelin. Handbuch der anorganischen Chemie 56 Teil C 1 382
|
| [7] |
北京石油化工工程公司编.
氯碱工业理化常数手册[M]. 北京: 化学工业出版社, 1988: 87-89.
|
| [8] |
朱元保, 等.
电化学数据手册[M]. 长沙: 湖南科技出版社, 1984: 50.
|
| [9] |
李军, 李洪桂, 刘茂盛, 等. 氢氧化钠与黑钨反应动力学研究[J].
中南矿冶学院学报, 1985, 4: 128–135.
|
| [10] |
李运姣, 李洪桂, 刘茂盛. 白钨矿碱分解过程的热力学和动力学研究[J].
中南矿冶学院学报, 1990, 1: 39–45.
|
 1995, Vol. 9
1995, Vol. 9
