0 前言
在现代湿法冶金中,金属(矿物)-配位体-水系,是非常重耍的反应体系之一,诸如金的氰化、氯化银的氨浸、以及各种以氯化物溶液作介质的工艺过程等,都是基于金属离子与配位体L(CN-、NH3、Cl-等)之间的络合反应建立起来的。因此,研究金属(矿物)一配位体一水系的反应平衡,从热力学的角度研究配位体在这类体系中的行为和作用,具有重要的理论与实际意义。
近年来,采用氯化湿法冶金技术,从多金属硫化铋精矿中提取铋、铅和贵金属银等得到了很大的发展,并陆续建厂投产。但目前对上述氯化湿法冶金过程的热力学研究进行得还很不够,为此,有必要应用“同时平衡原理”,通过 、ψ函数,对多金属硫化铋精矿氯化湿法冶金过程进行热力学分析,从理论上论证多金属硫化铋精矿氯化湿法冶金的可行性和合理性,为科研和生产提供一些理论依据。
、ψ函数,对多金属硫化铋精矿氯化湿法冶金过程进行热力学分析,从理论上论证多金属硫化铋精矿氯化湿法冶金的可行性和合理性,为科研和生产提供一些理论依据。
1 铅、银在氣化物溶液中的溶解度图
Pbcl2和Agcl系难溶化合物,研究它们在氯化物溶液中的溶解度,是实现多金属硫化铋精矿氯化湿法冶金的关键。在氯化物溶液中,三价铋离子、二价铅离子和一价银离子均能与氯离子反应生成一系列的络合离子,络合反应及其平衡常数可分别表示如下:
在可以忽略金属离子与羟基络合的情况下,铋离子、铅离子、银离子及氯离子的总浓度〔Bi〕T、〔Pb〕T、〔Ag〕T和〔Cl-〕T, 可分别按下式计算:
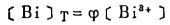
|
(1) |

|
(2) |
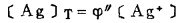
|
(3) |
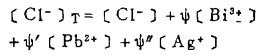
|
(4) |
式中:
上式中所有各种离子的平衡浓度均为重量摩尔浓度。当溶液与难溶PbCl3、AgCl共存时,〔Pb2+〕与〔Cl-〕和〔Ag+〕与〔Cl-〕的关系分别决定于PbCl2和AgCl的浓度溶度积K'sp和K"sp即:
将〔Pb2+〕和〔Ag+〕代入式(2)、(3)和(4)得:
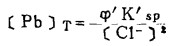
|
(5) |
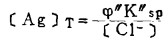
|
(6) |
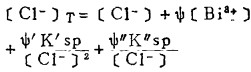
|
(7) |
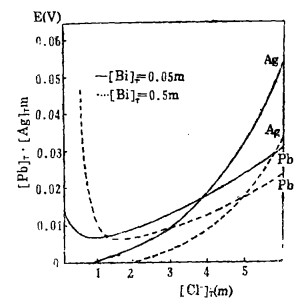
式(5)和(6)所表示的〔Pb〕T和〔Ag〕T为氯化物溶液中铅、银的溶解度。可见,铅和银的溶解度决定于氯化铅和氯化银各自的溶度积,铅离子、银离子和共存的铋离子各自与氯离子的络合反应平衡常数以及氯离子的平衡浓度。在温度和离子强度恒定的情况下,K'sP、K"sp、βi、βi'、βi"均为常数,见表 1(1.2)。而氯离子的平衡浓度〔C1-〕在上述条件下决定体系中可加调节的氯离子总浓度〔C1-〕T。因此,在指定〔Bi〕T和〔Cl-〕T时,通过联解方程(1)、(5)、(6)、(7),可分别算出与〔Cl-〕T相对应的〔Pb〕T和[Ag〕T。表 2所列数据为作者采用逼进法经电子计算机运算得到的结果,按此数据绘制得不同〔Bi〕T25℃和离子强度I = O时,铅、银在氯化物溶液中溶解度图,见图 1。需要指出的是
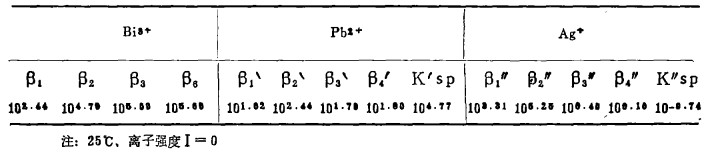
表 1(Table 1)
|
表 1 Bi、Bi’、Bi”和Ksp、K”s p、值
|
表 1 Bi、Bi’、Bi”和Ksp、K”s p、值
|
 |
| 点击放大 |
表 2(Table 2)
|
表 2 铅、银溶解度
|
|
|
 |
| 点击放大 |
图 1是在假定体系同时有固体氯化铅和氯化银的条件下绘制的, 它恰好是多金属硫化铋精矿氯化湿法冶金过程中实现秘与铅、银分离所希望发生的现象, 对指导科研和生产有很强的实际意义。
从图 1可见,在铅、银的溶解度曲线上有一个最低点一一拐点。当溶液中〔Cl-〕T < 〔Cl-〕T为拐点时,随着〔Cl-〕T增加,铅、银的溶解度急剧下降,通过拐点后,随着〔Cl-〕T增加溶解度增大,旦当〔Cl-〕T > 3 m时,溶解度增加很快。因此,在多金属硫化铋精矿氯化湿法冶金实践中,要实现铋、铅、银的同时浸出,必须保证浸出终点时的〔Cl-〕T>2.5m和〔Cl-〕T> 4 m。
从图 1还可知:溶液中〔Bi〕T愈大,铅、银的溶解度愈小。也就是说,当溶液中同时有铋、铅、银时,增加〔Bi〕T,有利于实现镑与铅、银的分离。
2 Bi2S3 -Cl- -H2O系的E -〔Cl-〕T图
采用氯化湿法浸出Bi2S3时,体系一般为酸性, 此时不会生成BiOCl和Bi2S3,所以在作E-〔Cl-〕T图时,只需讨论Bi2S3与溶液间的平衡。
当Bi2S3-溶液达到平衡时,下列反应同时平衡。
此时,溶液中总铋浓度〔Bi〕T和总氯浓度〔C1-〕T别等于:
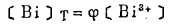
|
(8) |
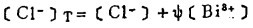
|
(9) |
式中:
体系中Bi2S3与溶液的平衡电极电位,由反应(e)确定:
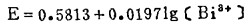
|
(10) |
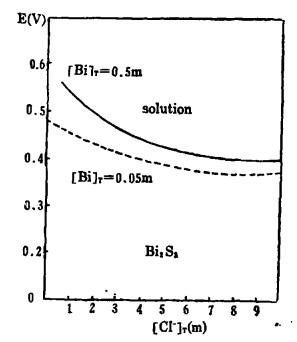
由式(8)、(9)、(10)可知,指定〔Bi〕T和〔Cl-〕T,通过联解方程(8)、(9)、(10),可算出与之相对应的E值,据此可绘得图 2, 可见,随着〔Cl-〕T的增加,Bi2S3与溶液的平衡电极电位E下降,也就是说,增大〔Cl-〕T有利于Bi2S3的浸出。在氯化湿法冶金实践中,当〔Cl-〕T>2.5m时,只要所用氧化剂的平衡电极电位大于0.5伏,就能有效地浸出Bi2S3。
3 PbS -Cl--H2O系的E-〔Cl-〕T图
采用氯化湿法浸出PbS时,体系一般为酸性,此时不会生成PbO, 所以在作E-〔C1-〕T图时,只需讨论PbS、Pbcl2和溶液各相间的平衡。
a PbS-溶液的平衡。当PbS-溶液达到平衡时,下列反应同时平衡。
此时,溶液中总铅浓度〔Pb〕T和总氯浓度〔Cl-〕T别等于:
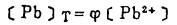
|
(11) |
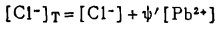
|
(12) |
式中:
体系中PbS与溶液的平衡电极电位,由反应(j)确定。
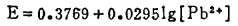
|
(13) |
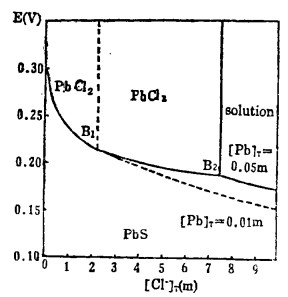
由式(11)、(12)、(13)可知,在指定的[Pb]T和[Cl-]T下,通过联解方程可算出与之相对应的E值,据此可绘出PbS-溶液平衡时的E-[Cl]T曲线,见图 3。
b PbS-PbCl2平衡。
此时,溶液中的总铅浓度[Pb]T和总氯浓度[C1-]T分别等于:
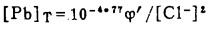
|
(14) |
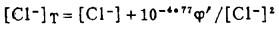
|
(15) |
式中: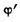 、ψ'同前,
、ψ'同前,
体系中PbS-PbCl2的平衡电极电位由反应(1)确定。
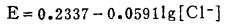
|
(16) |
由式(14)、(15)可知,当PbS-PbCl2平衡时的溶液中[Pb]T和[Cl-]T受k'sp控制均不为常数。在指定的[Cl-]T下,由式(15)算出[Cl-], 将[Cl-]代入式(16)算出与之相对应的E值,据此可绘出PbS-PbCl2衡时的E-[Cl-]T曲线,见图 3。
c PbCl2-溶液的平衡
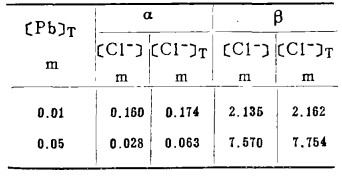
在指定的[Pb]T下,解方程(14)、(15)得[Cl-]T, 此[Cl-]T为PbCl2-溶液平衡时的总氯浓度,计算数据见表 3。据此可绘出PbCl2-溶液平衡线,见图 3。
表 3(Table 3)
|
表 3 PbCl2-溶液平衡时α和β数据
|
|
|
 |
| 点击放大 |
从图 3可知:随着[Cl-]T的增加,PbS-溶液和PbS-PbCl2的平衡:电极电位E下降,即增大[Cl-]T有利于PbS的浸出和转化成PbCl2沉淀。溶液中[Pb]T愈大,PbS -溶液的平衡电极电位愈高,转化成PbCl2沉淀的[Cl-]T也愈大(不包括[Cl-]T →0), 即PbCl2沉淀的稳定区域愈大,反之亦然。在氯化湿法冶金实践中,要想有效地将PbS浸取出来,不生成PbCl2沉淀,必须保证浸出终点的[Cl-]T> 2.5m。
4 Ag2S -Cl--H2O系的E-[Cl-]T图
采用氯化湿法浸出Ag2S时,体系一般为酸性,不会生成Ag2O,在E-[Cl-]T图上,只需讨论Ag2S、AgCl和溶液各相间的平衡。
a.Ag2S-溶液的平衡。当Ag2S-溶.液平衡时,下列反应同时平衡:
此时,溶液中总银浓度[Ag]T和总氯浓度[Cl-]T分别等于:
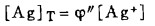
|
(17) |
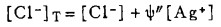
|
(18) |
式中:
体系中Ag2S与溶液的平衡电极电位为:
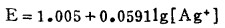
|
(19) |
由式(17)、(18)、(19)可知,指定[Ag]T和[Cl-]T,通过联解方程,可算出与之相对应的E值,据此可绘出Ag2S-溶液平衡时的E-[Cl-]T曲线。
b. Ag2S-AgCl的平衡:
此时,溶液中总银浓度[Ag]T和总氯浓度[Cl-]T分别等于:
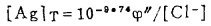
|
(20) |
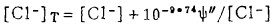
|
(21) |
体系中Ag2S-AgCl的平衡电极电位为:
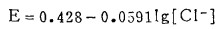
|
(22) |
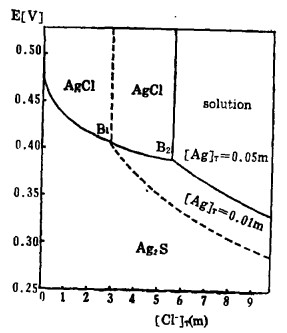
由式(20)、(21)可知,当Ag2S-AgCl平衡时,溶液中[Ag]T和[Cl-]T受k〃sp控制均不为常数。在指定的[Cl-]T下,可由式(21)算出[Cl-],将[Cl-]代入式(22)算出与[Cl-]T相对应的E值,据此可绘出Ag2s-AgCl平衡时的E -[Cl-]T曲线,见图 4。
c. AgCl-溶液的平衡。在指定的[Ag]T下,解方程(20)、(21)得[Cl-]T,此[Cl-]T为AgCl-溶液平衡时的总氯浓度,计算数据见表 4。据此可绘出AgCl-溶液平衡线,见图 4。
表 4(Table 4)
|
表 4 AgCl-溶液平衡时α和β数据
|
|
|
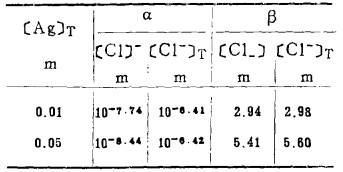 |
| 点击放大 |
从图 4可知,随着[Cl-]T的增加,Ag2S-溶液和Ag2S-AgCl的平衡电极电位E下降,即增大[Cl-]T有利于Ag2S的浸出和转化成AgCl沉淀。溶液中[Ag]T愈大,Ag2S-溶液的平衡电极电位愈高,转化成AgCl沉淀的[Cl-]T也愈大(不包括[Cl-]T→0),职AgCl沉淀的稳定区域愈大,反之亦然。在氯化湿法冶金实践中,为了避免贵金属银的分散,一次将Ag2S全部浸出使之转入溶液,不生成AgCl沉淀,则必须保证浸出终点的[Cl-]T>3m。
5 Fe3+ -Fe2+ -Cl- -H2O系的E-〔Cl-〕T图
在氯化湿法冶金中,最常用的浸出(氧化剂)为三氯化铁。它是基于在酸性溶液中Fe3+能将硫化矿中的S2-氧化成元素S0,使有价金属进入溶液,达到浸出的目的。为此,分析Fe3+ -Fe2+-Cl- -H2O系中Fe3+的氧化能力,为浸出工艺条件的确定提供理论依据。
在Fe3+ -Fe2+-Cl- -H2O系中,当Fe3+-Fe2+达到平衡时,下列反应同时平衡:
此时,溶液中三价铁离子总浓度[Fe3+]T,二价铁离子总浓度[Fe2+]T和总氯浓度[Cl-]T分别等于:
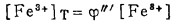
|
(23) |
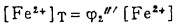
|
(24) |
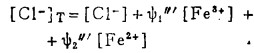
|
(25) |
式中:
体系中,Fe3+-Fe2+的平衡电极电位为:
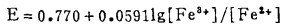
|
(26) |
将式(23)、(24)代入式(25)、(26)得:
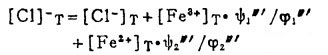
|
(27) |
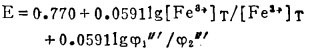
|
(28) |
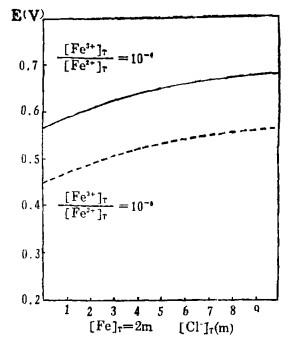
由式(27)、(28)可知,指定[Fe3+]T、[Fe2+]T和[Cl-]T, 由方程(27)算出[Cl-], 将[Cl-]代入式(28)可算出与之相对应的E, 据此可绘得图 5。可见,随着[Cl-]T的增加,Fe3+-Fe2+的平衡电极电位增大,即增大[Cl-]T可提高Fe3+的氧化能力。将图 5和图 2、3、4相比较可知,只要[Cl-]T>3m,即使[Fe3+]/[Fe2+]T = 10-8 ([Fe3+]T = 2m),Fe3+也能将Bi2S3、PbS、Ag2S氧化使之进乂溶液。即用FeCl3作氧化浸出剂是可行的。
6 小结
a.采用FeCl3作氧化剂,浸出多金属硫化铋精矿是可行的和可靠的。浸出趋势为:PbS最大,Bi2S3次之,Ag2s最小。
b.采用FeCl3浸出多金属硫化铋精矿时,要实现有价金属铋、铅、银的同时浸出使之进入溶液,不生成氯化铅和氯化银沉淀,则必须保证浸出终点的[Cl-]>3m,[Cl-]T> 5m,[Fe3+]T/[Fe2+]T> 10-6。生产实践中,可以通过添加廉价的食盐(NaCl)来保证溶液中的氯离子含量。
c.浸出得到的含有铋、铅、银的溶液,置换前,可通过降低溶液的温度和提高溶液中铋的浓度来实现铋与铅、银的最大分离。
d.由于缺乏完整的高温热力学数据,因此本文的整个热力学分析都是25℃下进行的,有一定的局限性,但所得结论基本上能较好地和生产实践相一致。所绘制的铅、银在氯化物溶液中的溶解度图和MeS-Cl--H2O系的F-[Cl-]T图,对指导科研和生产有一定的实用价值。

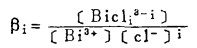
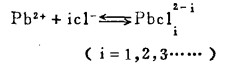
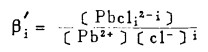
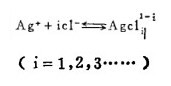
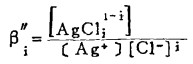
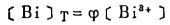

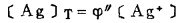
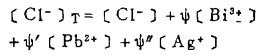
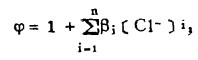
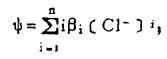
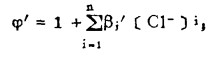
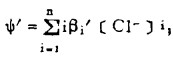
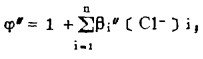
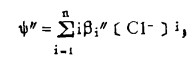
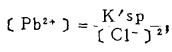
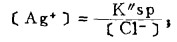
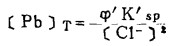
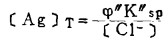
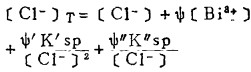


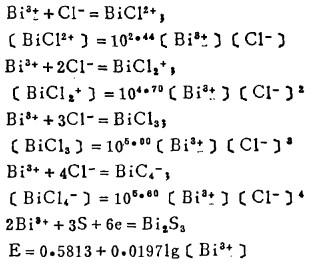
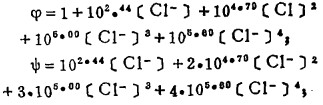
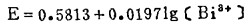
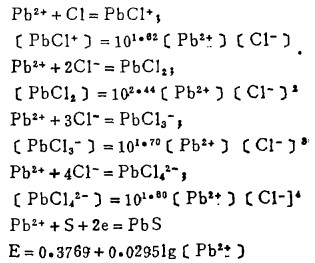
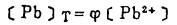
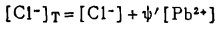
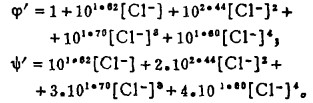
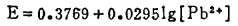
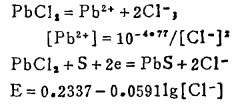
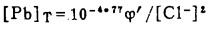
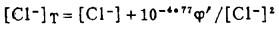
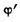
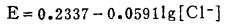

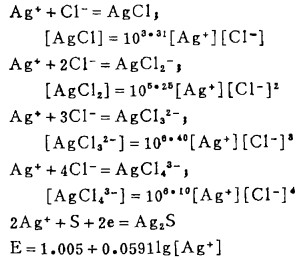
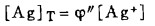
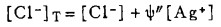
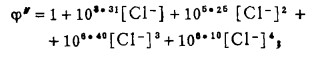
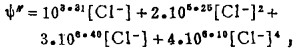
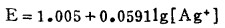
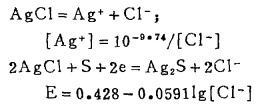
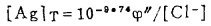
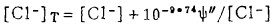
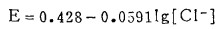

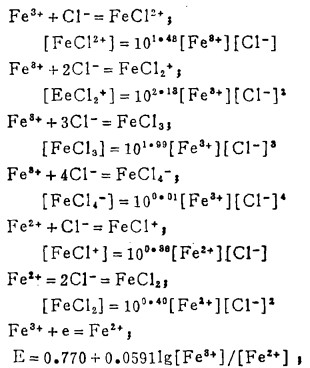
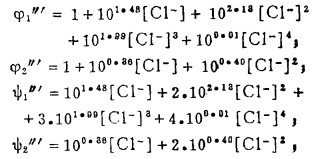
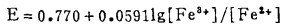
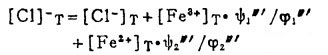
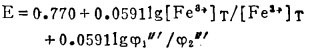
 1992, Vol. 6
1992, Vol. 6
