| 金属镧还原稀土氧化物的机理 |
九江有色金属冶炼厂
${affiVo.addressStrEn}
稀土金属的生产分熔盐电解法,氯化物、氟化物还原法以及氧化物直接还原法等。对于Sm.Eu.Tm.Yb等金属的生产,因蒸汽压比其他稀土金属高,通常采用直接还原法。即用金属镧或混合稀土金属还原它们的氧化物。回收粗金属,升华分离制取高纯金属。迄今有关该反应的机理研究未见报道。作者曾探讨直接还原法生产稀土金属的基础工作,如Sni2O3.Eu2O3.Tm2O3.Yb2O3和混合稀土金属La、Ce、Pr、Nd的反应性及其影响因素。本文使用镧作还原剂,研究它和稀土氧化物反应的性能,根据还原反应的温度依存性求出表观活化能,进而探讨这些稀土氧化物的直接还原反应机理。
2 原料与实验 2.1 原料稀土氧化物为99.9%的粉未;还原剂La是由99.9%的块切削成100目~200目的屑。实验时称取2×10-3kg二者混和物,充分混匀后,装入压模压实作为实验试料。压块为直径8×10-3m、高8×10-3m的圆柱。
2.2 实验装置图 1为置于反应管内的试料坩埚简图[8]。坩埚为外径1.5×10-2m,高2×10-2m的钽坩埚;坩埚放在氧化铝支架上,与反应管上部的提升装置相连.反应管为内径2.6×10-2m的Al2O3管,内为真空。加热用硅碳炉,测温用Pt-Ptl3%Rh热电偶。
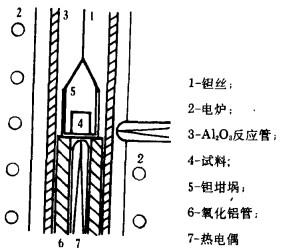 |
| 图 1 实验装置 |
2.3 实验方法
先将盛有试料的钽坩埚安装在反应管上部的提升装置上,使其可调。内部通过机械泵和扩散泵抽为真空。对Eu2O3、Yb2O3真空约抽至1.3×10-1Pa, 而对于Sm2O3、Tm2O3真空约抽到4×10-3Pa, 然后升温到规定温度。待实验温度达到后,从反应管上部放下坩埚,置于氧化铝支架上,开始实验。经一定时间后,提升坩埚,使试料在反应管中冷却。实验结束后,从反应管中取出坩埚,测出坩埚的失重,假定比值为所生成金属的实际挥发量,再通过试料换算出理论挥发量,从而求出反应率。

|
(1) |
金属镧还原Sm2O3.Eu2O3Tm2O3.Yb2O3的反应方程式为:
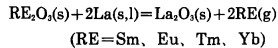
|
(2) |
作者曾根据热力学计算指出[9]用La还原这些氧化物的能力由大到小为:Eu2O3>Yb2O3>Sm2O3>Tm2O3。同时可估算还原温度,Sm2O3, Tm2O3分别在1223k~1473k和1573k~1773k的温度范围内实验,Eu2O3, Yb2O3分别在1023k~1123k和1098k~1223k的温度范围内还原。用La在上述各温度内还原这些氧化物的还原时间曲线如图 2~5所示。
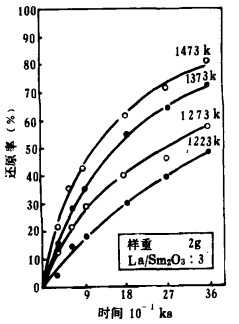 |
| 图 2 Sm2O3的还原时间曲线 |
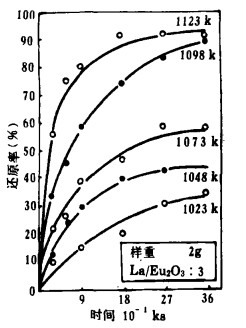 |
| 图 3 Eu2O3的还原时间曲线 |
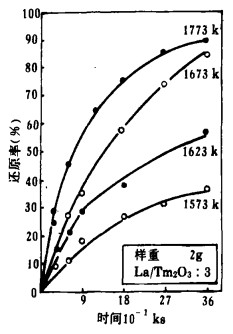 |
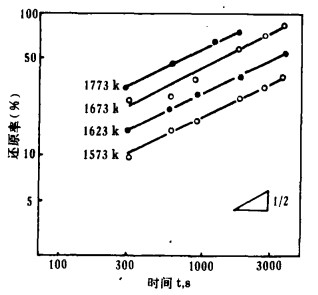
| 图 4 Tm2O3的还原时间曲线 |
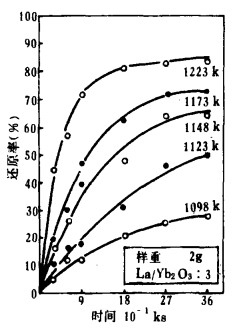 |
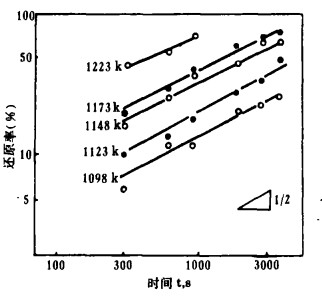
| 图 5 Yb2O3的还原时间曲线 |
根据金属镧的熔点,可认为Sm2O3, Tm2O3的还原反应为固-液反应;Eu2O3,Yb2O3的还原反应为固-固反应。
由图 2~5知,所有的反应在低温时缓慢进行,在高温时反应剧烈。但高温时反应率的增加程度不同,Eu2O3、Yb2O3比Sm2O3、Tm2O3快。
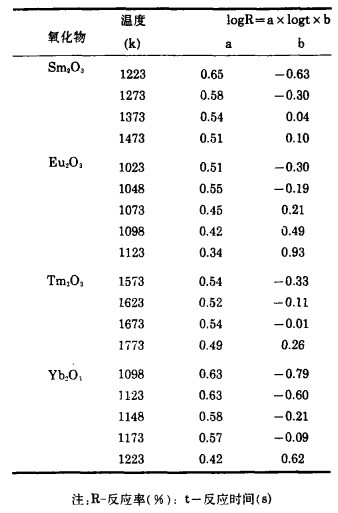
3.2 还原反应的速度方程式将图 2~5中的反应率和时间分别取对数整理,结果如图 6~9所示。在还原温度下, 二者成直线关系。由最小二乘法回归可求得各氧化物的还原速度方程试,如表 1所示。各直线的斜率为:Sm2O3为0.51~0.65, Eu2O3为0.34~0.55,Tm2O3为0.49~0.54, Yb2O3为0.42~0.63;大约都是0.5。由此可知,La还原稀土氧化物的反应和金属的高温氧化相类似,符合抛物线规则。
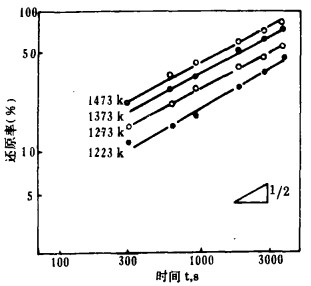 |
| 图 6 Sm2O3反应率和时间的对数关系 |
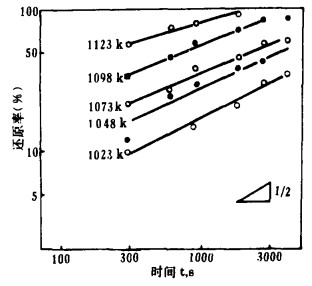 |
| 图 7 Eu2O3还原率和时间的对数曲线 |
 |
| 图 8 Tm2O3还原率和时间的对数曲线 |
 |
| 图 9 Yb2O3还原率和时间的对数曲线 |
| 表 1 反应率和时间的对数函数 |
 |
| 点击放大 |
3.3 还原反应的表观活化能
取还原反应速度方程中的常数b的对数为纵坐标,以绝对温度T的倒数1/T为横坐标作图如图 10所示。二者为直线关系,由直线的斜率求出各稀土氧化物的表观活化能(见表 2)据此可知,对固-固反应Eu2O3和Yb2O3的表观活化能大致相近,且可推测二反应的控制环节相同。而Sm2O3, Tm2O3的表观活化能较低。其原因可能是反应时镧的状态(固、液)不同所致。
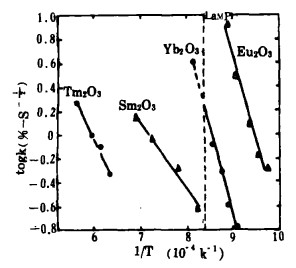 |
| 图 10 表观活化能与溫度的关系 |
| 表 2 表观活化能 |
 |
| 点击放大 |
4 讨论
根据Wagner的原电池理论,La还原稀土氧化物(Sm2O3,Eu2O3,Tm2O3,Yb2O3)时的电化学反应模型如图 11所示。反应前,在光学显微镜下观察,金属镧和稀土氧化物之间存在界面(图 11(a)), 随着反应进行,在上述界面间形成La2O3层,于是又出现金属La和La2O3界面Ⅰ,La2O3和稀土氧化物界面Ⅱ(图 11(b))。在界面处的还原反应可分为电化学反应和物质迁移。电化学反应包括阳极反应和阴极反应。
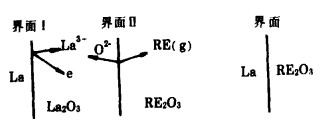 |
| 图 11 稀土氧化物还原反应的电化学模型 |
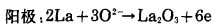
|
(3) |
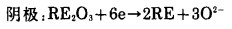
|
(4) |
生成的稀土金属从界面蒸发脱离。如图 11(b)所示,阳极反应在界面Ⅰ进行,由于没有电解质,则因氧化而生成的La3+如果遇到O2-或者La3+进人氧化物中所必须占据的位置,电化学反应难于进行。阴极反应在界面Ⅱ进行,假设生成的La2O3具有离子传导和电子传导二重性,则该界面可认为是三相界面。稀土金属在La2O3的电子传导处与稀土氧化物的接触部分生成。而La2O3的电子传导部分和离子传导部分没有确定的物质,所以实际上反应在整个界面进行,由于稀土氧化物晶格中的金属离子在界面Ⅱ处和La2O3电子传导部分供给的电子反应,所以阴极反应认为按(4)式进行。而稀土氧化物层和La2O3层边界也不太明确,因此部分反应也在固溶状态下进化。
另一方面,在物质迁移过程中,如果反应产物La2O3同时具有离子传导和电子传导二重性,那么氧离子就以La2O3为介质由稀土氧化物向金属La迁移(如(5)式),镧离子和电子由金属镧向稀土氧化物迁移(如(6)、(7)式)。
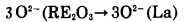
|
(5) |
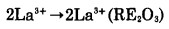
|
(6) |
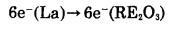
|
(7) |
在图 11(6)的反应体系中, 可以认为(3)~(7)的基元反应和物质迁移同时存在,但因稀土氧化物的还原时间曲线符合抛物线规则,且又从反应的表观活化能可判断反应为扩散控制,所以可推测电荷迁移过程不是控制环节,物质迁移过程是控制环节。
据此,可探讨与还原反应有关的迁移速度,虽La2O3中稀土阳离子和氧离子的迁移速度没有文献报道,可据Berard等报道的各稀土氧化物中阳离子和氧离子的自扩散系数来讨论。各稀土氧化物中氧离子扩散系数在1523k时为10-2~10-4m2·s-1,稀土阳离子扩散系数在1673k时为10-13~10-16m2·s,后者比前者小。如根据稀土氧化物中各离子的自扩散系数来判断离子的迁移,则镧离子和氧离子的迁移可认为是与阳极有关的物质迁移过程,且镧离子的迁移速度慢。但是,离子的迁移速度除依赖于浓差扩散外,还依赖于电化学位,因此,仅从本文的数据还不能断定镧离子是与还原反应的控制环节有关的离子。与阳极反应有关的物质迁移过程是电子的迁移,而电子的迁移速度比稀土离子、氧离子快很多,所以,整个反应的控制环节决定于镧离子或氧离子通过的La2O3层的速度。
根据上述理论及表 2的表观活化能可知,固态La还原Eu2O3,Yb2O3时的表观活化能约为:240kj/mol,反应的控制环节亦相同。而液态La还原Sm2O3,Tm2O3,时,因反应物间几何关系的变化,有效接触面积随温度升高而增大,导致反应表观活化能降低,但反应的控制环节仍相同。
5 结语本文以La为还原剂研究了直接还原Sm2O3, Eu2O3, Tm2O3, Yb2O3等稀土氧化物的反应机理,结果如下。用还原时间和反应率的对数整理还原时间曲线,得各直线的斜率约为0.5。由解析式求得还原反应的表观活化能。其中Sm2O3:96kj/mol,Eu2O3 :236kj/mol, Tm2O3:154kj/mol, Yb2O3:243kj/mol,根据此结果和Wagner的电化学模型,探讨了反应机理,研究表明,镧离子或氧离子通过产物层La2O3的迁移过程为反应的控制环节。
原载日本金属学会志VOL.54, NO1.1990.17-24
万正瑞、刘文淮校
编者按
由于某种原因,稀土冶炼工艺方面的文稿,权将压缩, 令人扼腕。为此,本刊从1991年第4期起,拟组织一些国外有关文献,陆续译出,分期刊登,倘能有所裨益,则幸甚矣。
 1991, Vol. 5
1991, Vol. 5
