| 用BП-1型阴离子交换剂吸附钼规律性研究 |
用BП-1型阴离子交换剂从PH=3~4的工艺溶液中吸附钼时, 出现了溶液中所含铁和铜杂质与钼一起转向离子交换剂的现象。随后采用PH≈0.75的酸化水洗涤饱和的树脂, 可以分离50-60%的铁和98- 100%的铜[1]。本文研究了PH=3~4和酸度更大时吸附钼的规律性, 旨在确定降低杂质吸附性的可能性。研究所用BП-l× 10/25型阴离子交换剂含有10%联乙烯苯, 是在调节剂耗量为25%时合成的。模拟溶液是以钼酸钠和浸出钼精矿焙烧灰渣获得的溶液为主, 其中含有(g/l):60~100Mo; 2~4Fe; 1~2Cu; 0.02~0.3SiO2; 10~15Na; 2~3Ca; 0.03As; 0.015P.吸附钼时用硫酸将模拟溶液酸化到规定的PH值, 与使用盐酸和硝酸溶液相比, 选用硫酸溶液形成阴离子硫酸盐络合物会使钼的吸附性更好[2]。
为了确定钼在低浓度范围中吸附的一般规律性, 利用了含0.5g/l钼(呈NaMoO4形式)的溶液。PH≥0.54时, 为保持硫酸盐离子等于0.5mol/l, 需加人必要数量的硫酸钠。用硫酸将溶液酸化到PH<0.54时, 硫酸盐离子浓度超过0.5mol/l, 当PH=0.33时增加到0.825, 而PH=-0.02时增加到1.5mol/l。为确定平衡状态, 将1g阴离子交换剂在静态和选定的PH值条件下与50ml溶液接触48小时, 此后测定溶液和树脂中钼的含量并计算钼的回收率α和参数D, 提取时的相似分配系数, 离子交换剂(容量)中(E)和溶液中(C)的钼平衡浓度的等量关系。
从图 1给出的数据可见, 分配系数和回收率随溶液酸度的增加而降低。PH=0.4~0.5时, 钼的回收率约为90%, 这样就确定了在交换容量为20~25mg/g时溶液中排出的钼含量为0.05g/l的可能性。酸度更大时, 回收率明显降低, 这大概说明, 硫酸盐离子和溶液中占优势的呈MoO22+或Mo2O52+形式的没有被吸附的钼的阴离子竞争激烈。PH=0.8~4时, 回收率提高, 可达到最大值96~99%。
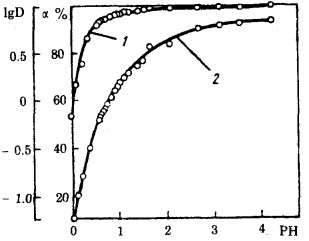 |
| 图 1 钼的回收率α(1)和分配系数D(2)与PH值的关系 |
从浸出灰渣(98g/lMo)的溶液中吸附时, 阴离子交换剂对钼的吸附容量与PH值的关系曲线示于图 2, 在PH=2~3时出现最大值。PH<2时, 吸附容量降低, 然而, 甚致在PH=0.5时, 吸附容量仍旧是相当高的。这证实了从酸性介质中吸附回收钼的可能性。
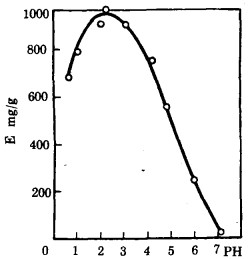 |
| 图 2 阴离子交换剂的交换容最与PH值的关系 |
PH>3时吸附容量的降低可能说明对一个固定的树脂而言离子得到的钼原子数减少, 这是由于钼的聚阴离子单位电荷的增大(如, 在H3Mo7O243-; 转向Mo7O246-)和聚阴离子水合作用能量增加的结果[3]。在酸化浸出灰渣获得的溶液时, 曾确定, 在PH=2.0~2.3范围中分离出钼铁酸盐的沉淀物, 但是在继续酸化并达到PH=1.1~1.3时, 沉淀物又重新被溶解, 并且溶液变为透明的。在介质的酸度从PH=3~4迅速增加到PH<1.1~1.3时, 没有形成中间的沉淀物。
因为在工业条件下从溶液中吸附钼时, 由于沉淀物可能淤塞排水柱, 所以不希望溶液中有沉淀物存在, 故从强酸溶液中吸附钼时, 适宜的酸度范围为PH=0.5~1.3。为了避免吸附时回收率降低或破坏酸化条件时形成的沉淀物, 适宜PH值应控制在0.8~1.1。在PH值为0.8~1.1时吸附钼实际上可以排除铁和铜向吸附剂的转移。已经确定, 洗出原液的饱和阴离子交换剂不含铜, 而铁的吸附容量不超过1~2mg/g。淋洗和洗涤后阴离子交换剂的剩余容量平均为:4~5mg/g铜和0.1mg/g铁。
在PH=0.8~1.1时, 实现选择性吸附钼的可能性取决于从溶液中吸附钼是否完全, 阴离子交换剂的吸附容量以及工艺过程的速度等因素可以通过测量吸附的等温线和动力学来确定。在阴离子交换剂试料与酸化到要求PH值的溶液接触48小时后测定了铜的吸附等温线。通过溶液和吸附剂试料体积的变化来改变溶液中钼的平衡浓度。
PH为3.6;1.0;0.8和0.6时, 从溶液中吸附钼的等温线(图 3)在开始区段中明显急剧上升, 这证明了从溶液中深度回收钼的可能性。等温线的开始区段(平衡溶液中钼的浓度达到0.1g/l)接近于线性。阴离子交换剂对钼的最大交换容量取决于溶液的PH和组成成分, 其变化范围可从700到800mg/g.
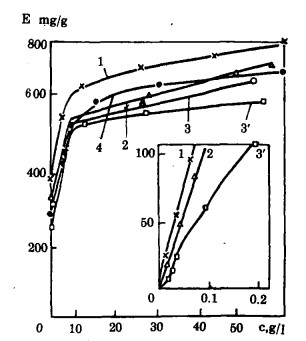 |
| 图 3 用阴离子交换剂从浸出灰渣获得的溶液中吸附钼的等温线 |
阴离子交换剂基体的固有容量对吸附等温线开始区段的形式有明显的影响, 在这种情况下, 依靠用溶液洗去离子交换剂合成时形成的低分子有机部分来调整基体的结构。用新的吸附剂吸附钼时, 从图 3可见, 曲线3'开始段的陡峭区较低。
研究钼吸附动力学的试验方法是, 在给定时间内连续搅拌, 使颗粒平均半径r0=0.8mm的1g阴离子交换剂试料与100ml溶液接触。
从阴离子交换剂的饱和度与(浸出灰渣得到的)溶液接触时间的关系曲线(图 4)可见, 钼的最大吸附量是6~8小时获得的。
 |
| 图 4 阴离子交换剂的饱和度与接触时间关系 |
为了确定离子交换的限定阶段, 分析了阴离子交换剂饱和度(相的吸附量Q(τ)与达到平衡状态后的吸附量Q∞之比)与从纯的三氧化钼为主的溶液中吸附钼所播时间的关系曲线(参见图 4)。
众所周知[4], 下述关系式符合薄膜动力学条件
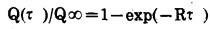
|
(1) |
并与在-lh〔1-Q(τ)/Q∞〕-τ座标系中角系数K的直线相适应; 在凝胶动力学条件下, 可用下式表达:
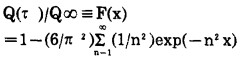
|
(2) |
自变量函数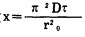
仅在x-τ座标系中获得了线性关系(图 5), 因而, 吸附是在凝胶动力学条件下进行的。
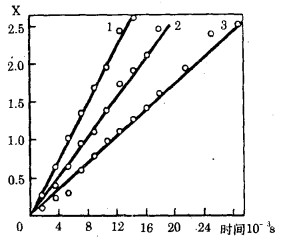 |
| 图 5 PH为3.6(1), 1.1(2), 0.8(3)时x值与从溶液中吸附钼的时间关系 |
直线x=В·τ的角系数以最小平方法求得并用于计算树脂中离子交换的互扩散系数:D=Br02/π2。可信概率为0.95时, 获得了如下的互扩散系数值, D·108, cm2/s:12.001±0.32(PH=3.6);8.54±0.51(PH=1.1)和5.7±0.38(PH=0.8)。因此, 溶液的酸度增加, 导致离子交换的速度降低。用这些扩散系数值计算的离子交换剂的饱和度对时间的关系与试验数据有良好的一致性(参见图 4)。
为此, 确定了在铁和铜杂质存在的情况下, 当PH=0.8~1.1时, 从含铝溶液中选择性吸附钼的可能性。PH=0.8~1.1时(与PH=2~4相比)钼的吸附特点是速度较低, 但交换容量和回收率值对于实际应用是可以接受的。
原载цветные Металлы7, 100-102(1989)
赵捷校
 1991, Vol. 5
1991, Vol. 5
