| 溶剂萃取法精炼稀土元素 |
高纯稀土产品, 在磁性和光学材料方面得到广泛的应用。诸如用于磁盘电极材料之镝, 铽, 用于光学透镜之镧和钆, 以及用于光学纤维之孔。本研究目的在于使这些功能性材料更加高性能化, 为达到此目的, 首要的问题是对稀土进行精炼。
溶剂萃取稀土氧化物纯度仅99.9%, 用这种纯度的稀土氧化物为原料, 产出99.9—99.999%的稀土氧化物, 为本研究的具体目标。
二 研究方法以试料为精炼对象, 将La、Gd、Tb、Dy溶于酸作为试液, 由于上述微量元素含量太低, 单独进行研究和除去都困难, 有必要添加一些周期表上接近的稀土元素, 一起制成试料液。
| 表 1 研究方法 |
 |
| 点击放大 |
1.萃取剂。烷基磷酸系列用得最多, 当然, 也可以从季胺盐、冠醚, β——二酮体中选出适宜于稀土精炼的萃取剂。试验中, 要使精制元素保持分离系数良好, 
2.添加剂。由于我们不太擅长有机合成, 所以把重点放在往萃取剂体系中加入添加剂, 以谋求分离条件的提高。水相中加入添加剂, 形成金属络合物和阴离子或中性萃取体系, 以提高萃取效果, 或者使之成为亲水螯合物以提高分离系数。
| 表 2 添加剂 |
 |
| 点击放大 |
水相中添加剂回收困难, 宁可将注意力放在有机相添加剂上。选择添加剂要考虑:提高萃取体系的溶解性, 增加稀土相互间的分离系数; 保持适当的分配比、相分离性、反萃性以及生产实际中的比重、蒸气压等因素。此外, 还要为浓度和浓度比发生变化提供条件。
三 试验结果1.利用季胺盐萃取。鉴于季胺盐烷基置换了普通铵盐之氢, 靠阴离子交换进行萃取, 故在萃取稀土时, 为在其中形成阴离子, 必须加入添加剂。加添加剂后形成的阴离子, 再加入硫氰酸离子, 分离系数迅速增加。而且浓度越高, 分配比和分离系数越大。还有TOMAC(季胺盐最有代表性的萃取剂)的浓度与稀土比较, 若能使TOMAC浓度小于稀土浓度或二者浓度比增大, 分离系数都会增大。作为供给稀土盐的阴离子, 如用氯离子代替硝酸根, 分离系数增大得特别快, 另外使用介电常数高的稀释剂, 也能使分离系数增大。
| 表 3 季胺盐萃取试验结果 |
 |
| 点击放大 |
综合上述, 得最适于稀土精制的条件。过去认为本试验的TOMAC和PC—88A最适于稀土精制。
| 表 4 萃取时对比 |
 |
| 点击放大 |
使用TOMAC分配比明显上升, 分离系数迅速增大, 如La/pr分离系数约12, 而PC—88A最大值也不到6。因此, La等稀土分离使用TOMAC很合适。
2.用冠醚进行萃取。Crown(1—2)+Ln3++3A-⇌Crown(1—2)LnA3
冠醚形成冠形将化合物中金属离子吸过来如图 2, 且一并萃取出阴离子。过去大部分试验根据在成为冠形时, 由其中原子种类改变决定萃取能力。试验使用的是市场上的冠醚, 试图通过使用这种化合物改变阴离子种类或溶剂种类, 以提高精制效率。
 |
| 图 2 冠醚萃取试验 |
常作为抗衡阴离子用的苦味酸, 萃取时稀土反萃很差, 萃取体系溶解度低、毒性大且易爆, 尤其是分离系数非常小, 故不用。我们还研究了若不用苦味酸, 而用具有同样结构、负电性高、膨松的化合物, 以达到同样的萃取效果, 从而最终取代苦味酸。研究结果, 齿素羧酸反萃性好, 萃取体系溶解度有所提高, 毒性和挥发性小, 稀土元素间的分离系数得以提高。过去一直用三氯甲烷等, 由于氯系(溶剂)萃取, 易挥发, 毒性强, 萃取后盐的溶解度只有0.00nM/1, 不宜在生产上推广应用。然而这种氯被溴置换后, 萃取体系的溶解度明显提高。
将四溴化碳溶于稀释剂中, 溶解度便急剧上升, 这种化合物能使稀土互相间的分离取得非常好的效果。硝基化合物在萃取溶解度方面, 看来还是适合的, 但因其反萃性差, 使用受到限制。
| 表 6 稀释剂的改进要求 |
 |
| 点击放大 |
冠醚有离子半径越大越易萃取的倾向, 它能从碱性低的稀土中除去碱性高的稀土, 因而是一种有前途的稀释剂。实用方面, 简单的合成法已经确定, 这方面已有报导。
众所周知, 冠的直径越大毒性越低, 这点不仅仅限于实验室。图 3为用冠醚做的萃取试验,与用TOMAC做的试验(图 1)恰恰相反, La, Ce、Pr分配比依次变小, 象La这样碱性低的元素, 要用强萃取剂萃取。
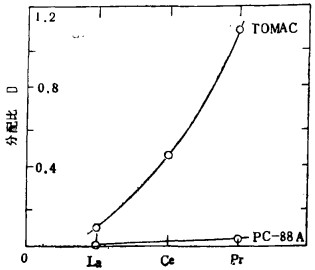 |
| 图 1 萃取对比 |
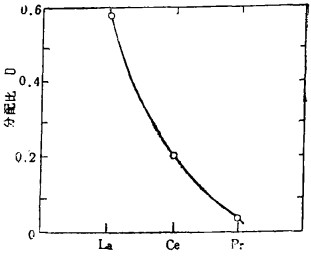 |
| 图 3 冠醚萃取时分配比 |
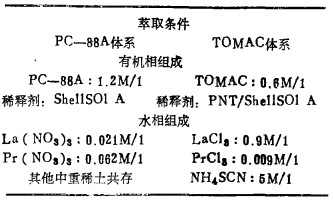
萃取条件:PH:3.30, 0/A=1/1;
有机相组成:18c6:0.02M/1, 稀释剂; CBr4500g/1/CHBr3;
水相组成:La(NO3)3:0.02M/1, Pr(NO3)3:2×10-4M/1, Ce(NO3)3:2×10-4M/1, CCI3COOLi:1M/1;
3.β—二酮体进行萃取。与普通萃取剂不同之处, 在于β—二酮体是酮, 其所以用酮型作萃取剂, 主要是金属离子和碱一起作用, 容易形成烯醇型构造, 如图 4所示之螯合物。实际使用的TTA, 如图 4中R1、R2就具有—CF3—塔形构造。用TTA萃取, 稀释剂显得尤为重要, 使用高极性溶剂和电容率高的稀释剂, 与过去的稀释剂相比, 溶解度和分离系数均有大幅度的提高。
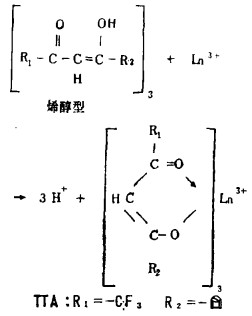 |
| 图 4 螯合物构造 |
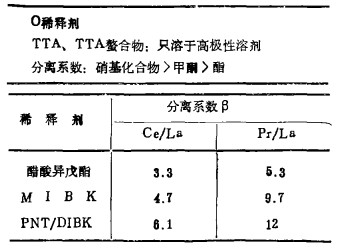
表 7为过去常用的醋酸异戊酯, Pr/La分离系数约5.3, 但用PNT的DIBK溶液后, 分离系数成倍增长, PNT虽为硝基化合物, 但因其毒性低, 工业上易于制取, 可望得到应用。
| 表 7 稀释剂与分离系数关系 |
 |
| 点击放大 |
4.酸性萃取剂。酸性萃取剂萃取试验结果如图 5。
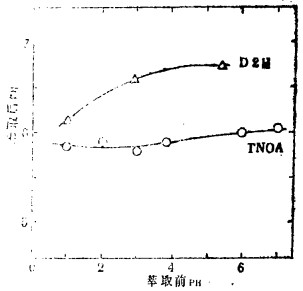 |
| 图 5 VA-10+氨络合物萃取后的PH |
有机相组成:VA—10:2.3M/1, TNOA或D2H:2.3M/1, 稀释剂:ShelisolA;
水相母液组成(全部硝酸盐g/1)
La Pr Nd Sm Eu Gd
1.1 0.56 2.5 16.0 0.09 0.41
将上述有机相和水相0/A=1/1每10分钟振动一下。
由于酸性萃取剂萃取时, 在水相中会释放出氢离子, 有必要多级萃取时控制PH, 从外面加入碱和大量的缓冲剂, 既费工费时且不能准确地控制PH, 我们拟将TNOA(胺)加入有机相, 用以控制PH的尝试。
图 5横座标表示萃取剂的PH, 不管萃取前其值如何, 但萃取后PH始终保持恒定。若不添加TNOA, 但萃取后PH值非常低, 稀土萃取率也相应很低。可见, 用多级添加"胺"来控制萃取的PH是合理的。单独使用TNOA, 得到的是一致的PH值, 若想根据萃取金属的种类, 保持稍高一点的PH, 必然会有萃取过头的问题, 即使这样, 也应先将TNOA加到弱酸性盐后再萃取, 这样可将PH值调整到某一定值, 如表 8、表 9。象Pka(-logka:Ka为酸电离常数), 这样较少的硫酸和盐形成的协TNOA, 与酸性萃取剂混合进行萃取后, 能将PH控制在3左右,使用醋酸的PH为4左右。故可依据与TNOA结合后酸的PKA值, 来选定适于各种金属萃取所需的PH值。
| 表 8 具有代表性酸的PKa(强酸无限稀释) |
 |
| 点击放大 |
| 表 9 TNOA抗衡阴离子与萃取力的关系 |
 |
| 点击放大 |
有机相/水相=1/1振动—→仅水相和新的有机相振动(2次)。
 |
| 图 6 多级萃取水相组成 |
上述PC—88A六级萃取, 是将TNOA硫酸盐作为PH控制剂使用的例子, 对于三级萃取、三级洗涤的多级萃取, 中稀土相互分离效果很好。
图 7介绍的"混合——澄清室箱式萃取装置"有机相从萃取段流向洗涤段、反萃段、再生段, 与水相流向相反, 将逆流中金属进行萃取精制。结果萃取残液中浓缩的稀土含重稀土非常少, 在反萃中浓缩的金属轻稀土含量极低。其结果见表 10—12。
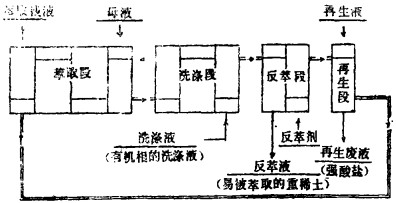 |
| 图 7 澄清室多段萃取 |
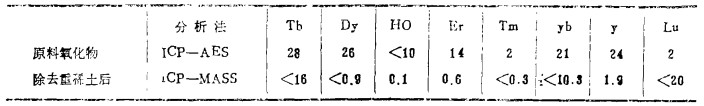
| 表 10 Gd的精制结果 |
 |
| 点击放大 |
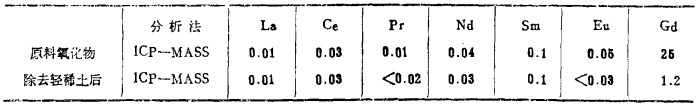
| 表 11 Tb精制结果 |
 |
| 点击放大 |
| 表 12 Tb的精制结果 |
 |
| 点击放大 |
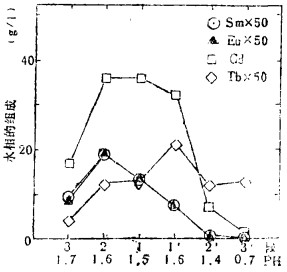
表 10是Gd的精制结果, Dy从26ppm精制到0.9ppm以下。Er从14ppm精制到0.6ppm以下。至于Tb的精制, 在除去轻稀土工序中, 如表 1所示, 氧化物含量特别高的Gd, 从25ppm, 减少至1.2ppm。y从13ppm, 降到0.1ppm。同样都有很好的精制效果。
尹晓星摘译自日本《しアメルシンボジウム·プロシーデインゲ》
邹图义 蒋健健 校
 1991, Vol. 5
1991, Vol. 5
