| 负性情绪启动对特质焦虑个体行为抑制的影响机制 |
情绪与执行功能之间的相互关系研究得到了众多学者的重视(周雅, 2013)。抑制控制是执行功能的核心成分(贾丽萍等, 2018; 袁加锦, 徐萌萌, 杨洁敏, 李红, 2017),对情绪与抑制控制关系的研究是洞悉情绪如何影响执行功能的重要窗口。有研究在反向眼跳任务中考察了情绪对个体行为抑制的影响,结果发现,被试对情绪目标的反向眼跳错误率明显更高,研究者认为,对情绪目标更高的反向眼跳错误率是由情绪刺激对个体行为抑制能力的损害造成的(Kissler & Keil, 2008)。但有研究者采用双选择Oddball任务诱发行为抑制,以方块作为标准刺激,圆环和情绪以及中性图片作为偏差刺激,结果发现,即便不要求注意负性图片,被试对负性图片的反应也比对圆环的反应更快,说明负性图片促进了其抑制控制能力(Fichtenholtz et al., 2004)。而有研究者同样采用Oddball范式,要求被试在情绪刺激或中性刺激背景下,对偶然出现的目标刺激做出反应。结果发现,对情绪背景的加工会干扰行为抑制过程(Dichter, Felder, & Smoski, 2009)。因此,研究者对情绪会促进还是阻碍行为抑制还未达成一致意见。
有关情绪与执行功能相互作用的“双重竞争模型”(Pessoa, 2012)认为,情绪强度是影响情绪与执行功能关系的重要因素,中等强度的情绪诱发更多的感知觉和注意,从而促进执行功能;高强度的情绪不但可引起更强的感知觉,而且需要占用认知资源来对这些刺激进行优先加工,从而阻碍执行功能。他们采用停止–信号范式考察情绪强度对行为抑制的影响,结果发现,低强度的情绪面孔可促进行为抑制,而高强度的刺激(与电刺激形成条件反射的声音刺激)则会阻碍行为抑制(Pessoa, Padmala, Kenzer, & Bauer, 2012)。但以上研究通过行为指标并未回答不同强度的情绪影响了行为抑制的哪一阶段。此外,停止–信号范式中行为抑制反应指标单一、间接,不利于对个体行为抑制的考察(贾丽萍等, 2018)。
焦虑是对未来事件潜在负性结果的过度担忧,会伴随生理上的过度唤醒和躯体紧张状态。研究发现不同特质焦虑水平个体的认知功能存在差异(梁丽美等, 2018)。大量研究也证明:高焦虑的个体在加工情绪信息,尤其是负性信息时存在加工偏向(Berggren & Derakshan, 2013)。Eysenck等认为,高焦虑个体面对威胁信息会产生高度警觉,并难以将注意从这类刺激中脱离(Eysenck & Derakshan, 2011)。因此,高焦虑个体对行为抑制之前出现的情绪信息所产生的注意偏向可能会占用认知资源,从而阻碍行为抑制。而之前的研究结果发现负性情绪促进了特质焦虑大学生的行为抑制(贾丽萍等, 2018)。
当前关于情绪影响抑制控制具体过程的研究还不多,有研究利用高时间分辨率的事件相关电位(ERPs)技术在Go/No–go实验范式下,考察了不同情绪效价的声音刺激与听觉反应冲突之间相互影响的时程特点,结果发现情绪刺激削弱了被试的反应抑制能力,但是这种影响仅在反应早期明显(余凤琼, 袁加锦, 罗跃嘉, 2009)。而“双重竞争模型”指出,情绪对执行功能的影响可以发生在感知阶段,也可以发生在执行控制阶段。情绪刺激影响个体行为抑制控制的时程特点还需进一步探索。
此外,加工效能理论和注意控制理论(Eysenck, Derakshan, Santos, & Calvo, 2007)认为,焦虑个体对负性刺激可产生注意偏向,从而阻碍执行功能中的抑制控制。但是之前研究却发现了负性情绪对特质焦虑大学生行为抑制的促进效应,情绪强度可能是造成研究结果与实验预期存在差异的原因之一。因此,本研究中使用ERPs技术,采用双选择Oddball实验范式,进一步区分高、低唤醒的负性情绪,探索不同强度负性情绪对特质焦虑个体行为抑制的影响时程。本研究假设高唤醒的负性情绪阻碍特质焦虑个体行为抑制的早期和中期阶段,低唤醒的负性情绪促进特质焦虑个体行为抑制的早期阶段。
2 方法 2.1 被试实验开始之前,对天津师范大学的1050名大学生进行特质焦虑问卷(戴晓阳, 2014)的施测。男生问卷得分高于56分、女生问卷得分高于57分则被筛选为特质焦虑个体(共30名),问卷得分低于30分则被筛选为非特质焦虑个体(共31名)。随机抽取32名大学生参与实验(16名特质焦虑大学生,22名女生),年龄在18~24岁之间。所有被试均为右利手,身体健康,无药物成瘾,无精神系统疾病。该研究得到天津师范大学学术伦理与道德委员会的同意。所有被试在实验前均签署知情同意书,实验后获得50元的报酬。
2.2 实验设计采用2(被试类型:特质焦虑、非特质焦虑)×3(情绪启动类型:高唤醒负性情绪启动、低唤醒负性情绪启动、中性情绪启动)×2(目标类型:标准刺激、偏差刺激)的混合实验设计,被试类型为被试间变量,情绪启动类型和目标类型为被试内变量。其中,标准刺激是方块,偏差刺激是圆环,要求被试对标准刺激按“F”键,对偏差刺激按“J”键,反应键在被试间进行平衡。
2.3 实验材料从中国情绪图片库(Chinese Affective Picture System, CAPS; 白露, 马慧, 黄宇霞, 罗跃嘉, 2005)、国际情绪图片库(International Affective Picture System,IAPS)以及网络图库中选取内容清晰、含义明确,没有文字说明的高、低唤醒度的负性及中性图片各60张,另外选取100名大学生(37男,63女,平均年龄19.3岁),对图片的愉悦度和唤醒度进行9点评分。其中,愉悦度是指被试看到图片后的愉快程度,“1”代表特别不愉快,“9”代表特别愉快。唤醒度是指被试看到图片后的兴奋程度,“1”代表特别不兴奋,“9”代表特别兴奋。
选择高唤醒度负性、低唤醒度负性和中性图片各48张作为实验材料,三类图片在愉悦度和唤醒度上均存在显著差异,如表1所示。
| 表 1 不同唤醒度水平图片和中性图片的愉悦度和唤醒度 |
方块作为标准刺激,圆环作为偏差刺激,其中方块的边长为102像素,圆环的直径为102像素。
2.4 实验程序实验在隔音电磁屏蔽房间里进行,被试与电脑屏幕之间的距离为75 cm。包括练习和正式实验两部分。练习中,要求被试熟悉对标准刺激和偏差刺激的反应键,正确率达到95%以上则开始双选择Oddball任务的练习。双选择Oddball任务中,屏幕中央首先呈现注视点“+”400~600 ms,随后出现一张图片200 ms,间隔900~1100 ms后,屏幕中央出现目标刺激1000 ms(标准刺激和偏差刺激随机出现),要求被试对目标做出判断,每个试次之间间隔500 ms。正式实验中,共有双选择Oddball任务720个试次,其中含有标准刺激的试次570个,含有偏差刺激的试次150个。程序同练习相同,三类启动刺激随机呈现。正式实验分为四个block。每个block后休息2分钟,整个实验大约持续40分钟。
2.5 数据采集采用E-Prime软件编程,使用根据国际10~20系统扩展的64导电极帽,以Neuroscan ERPs工作站记录EEG信号。头皮阻抗小于5 kΩ,采集信号时,以左侧乳突作为参考电极,离线分析时再转换为双侧乳突的平均为参考。滤波带通为0.05~40 Hz,连续采样,采样频率为1000 HZ。
2.6 数据分析以目标呈现之前的200 ms为基线,分析目标呈现之后1000 ms之内的ERPs波形。对脑电数据用Scan4.3软件进行离线分析,根据被试眼动的大小自动矫正眼动伪迹并充分排除其他伪迹,波幅超过±100 μV者(不包括眼动数据)视为伪迹被剔除,并去除了错误反应试次对应的EEG数据。
分析目标呈现之后的N1、P2、N2和P3成分,根据总平均图与参考文献确定ERPs各成分的时间窗口分别为:N1:50~150 ms;P2:100~250 ms;N2:200~400 ms;P3:300~500 ms。选择Fcz、Cz、Cpz、Fc3、Fc4、C3、C4、Cp3、Cp4共9个电极点进行统计。采用SPSS11.5 for Windows对实验中得到的行为数据以及ERPs波形的测量指标数据进行重复测量的方差分析。所有主效应和交互作用的p值都采用Greenhouse-Geisser法进行校正。
3 结果 3.1 行为结果对两组被试的错误率分析发现,两组被试的错误率均在6%以下,因此,不对错误率进行进一步的方差分析。
对反应时的分析,首先删掉错误的数据、小于100 ms或大于2000 ms的极端数据以及在三个标准差之外的数据(占总数据的4.7%),两组被试的反应时如表2所示。
| 表 2 特质焦虑与非特质焦虑被试在不同情绪启动条件下双选择Oddball任务的反应时(ms) |
采用SPSS11.5对两组被试的反应时进行重复测量的方差分析,结果发现:目标类型主效应显著,F(1, 30)=300.65,p<0.01,η
对N1、P2、N2和P3的潜伏期和波幅分别进行2(被试类型:特质焦虑、非特质焦虑)×3(情绪启动类型:高唤醒负性情绪启动、低唤醒负性情绪启动、中性情绪启动)×2(目标类型:标准刺激、偏差刺激)×9(电极点:Fcz、Cz、Cpz、Fc3、Fc4、C3、C4、Cp3、Cp4)的重复测量方差分析,结果如下。
3.2.1 N1成分潜伏期在被试类型、情绪启动类型、目标类型和电极点上均无显著主效应,ps>0.05。电极点与被试类型交互作用显著,F(8, 240)=4.04,p<0.01,η
波幅的被试类型和目标类型主效应均不显著,ps>0.05;情绪启动类型主效应显著,F(2, 60)=4.61,p<0.05,η
潜伏期的电极点主效应显著,F(8, 240)=6.57,p<0.01,η
波幅的被试类型主效应不显著,F(1, 30)=1.80,p=0.19,η
潜伏期在被试类型、情绪启动类型、目标类型和电极点上的主效应及交互作用均不显著,ps>0.05。
波幅的被试类型主效应不显著,F(1, 30)=0.27,p=0.61,η
潜伏期在被试类型、情绪启动类型和目标类型上的主效应及交互作用均不显著,ps>0.05。电极点主效应显著,F(8, 240)=3.38,p<0.05,η
波幅的被试类型主效应不显著,F(1, 30)=0.71,p=0.79,η
特质焦虑被试三种情绪启动条件下对标准刺激在Fcz、Cz、Cpz、Fc3、Fc4、C3、C4、Cp3和Cp4点上的脑电图如图1所示。
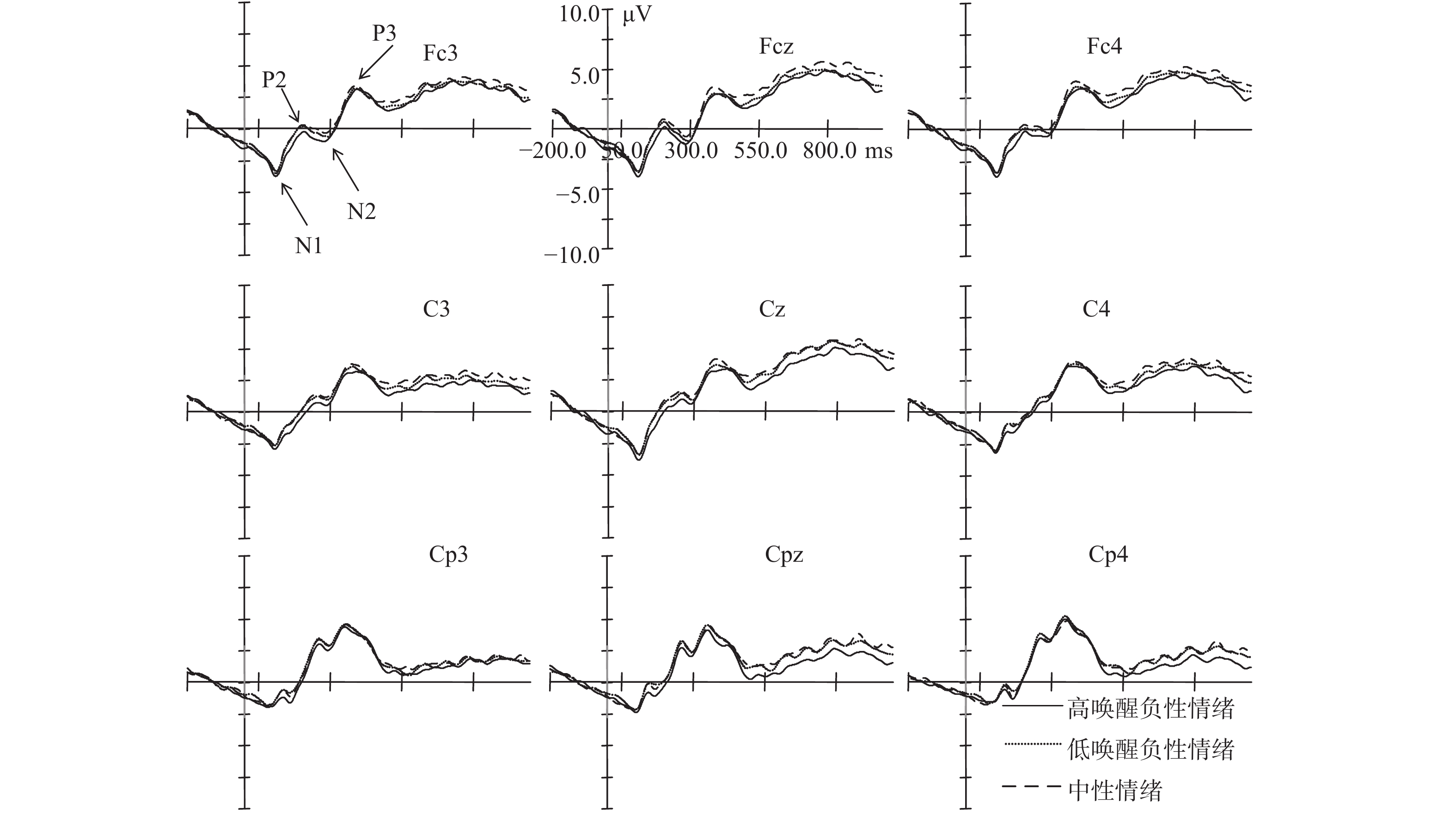 |
| 图 1 特质焦虑被试在三种情绪启动条件下对标准刺激的脑电图 |
特质焦虑被试三种情绪启动条件下对偏差刺激在Fcz、Cz、Cpz、Fc3、Fc4、C3、C4、Cp3和Cp4点上的脑电图如图2所示。
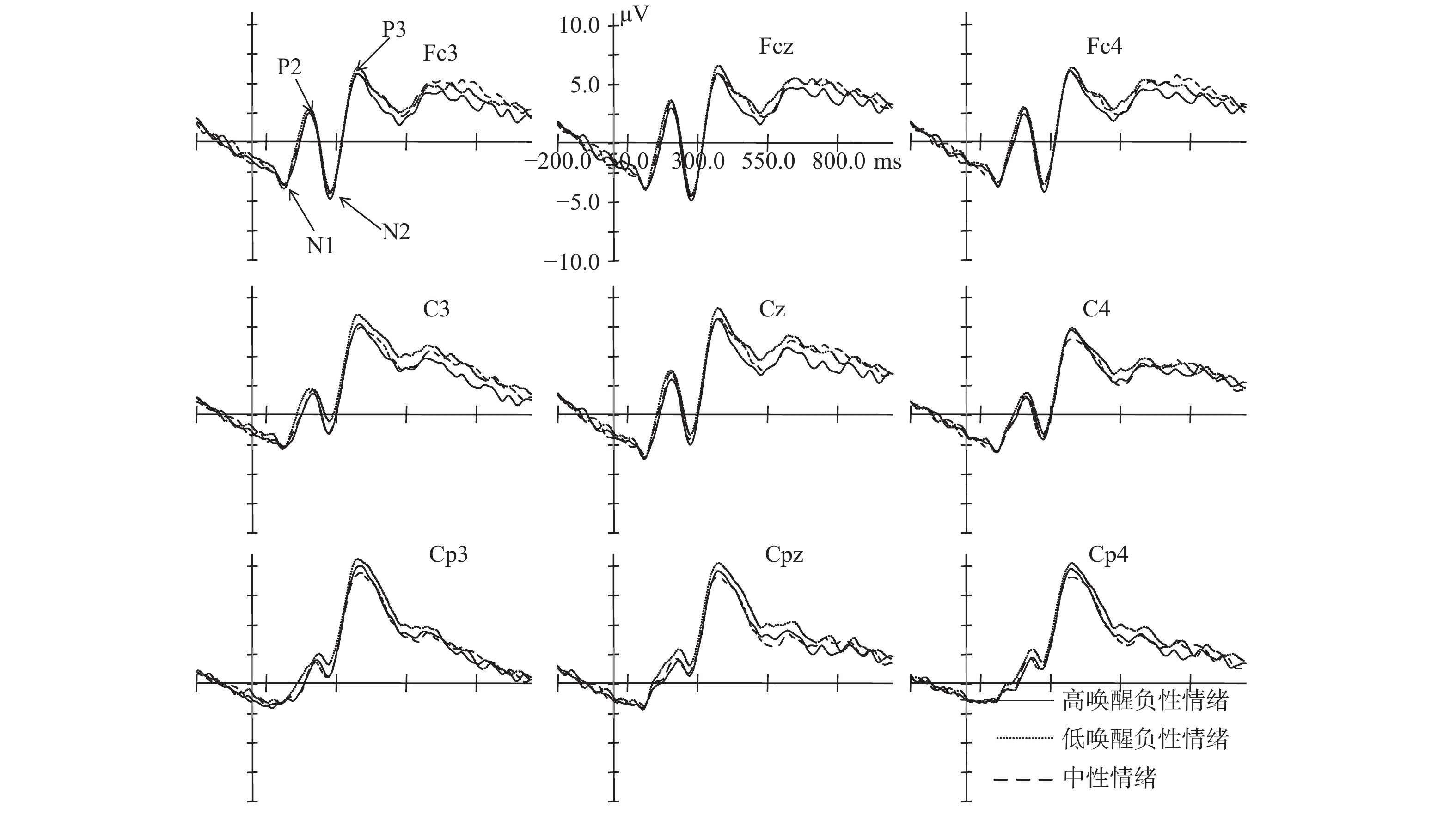 |
| 图 2 特质焦虑被试在三种情绪启动条件下对偏差刺激的脑电图 |
非特质焦虑被试三种情绪启动条件下对标准刺激在Fcz、Cz、Cpz、Fc3、Fc4、C3、C4、Cp3和Cp4点上的脑电图如图3所示。
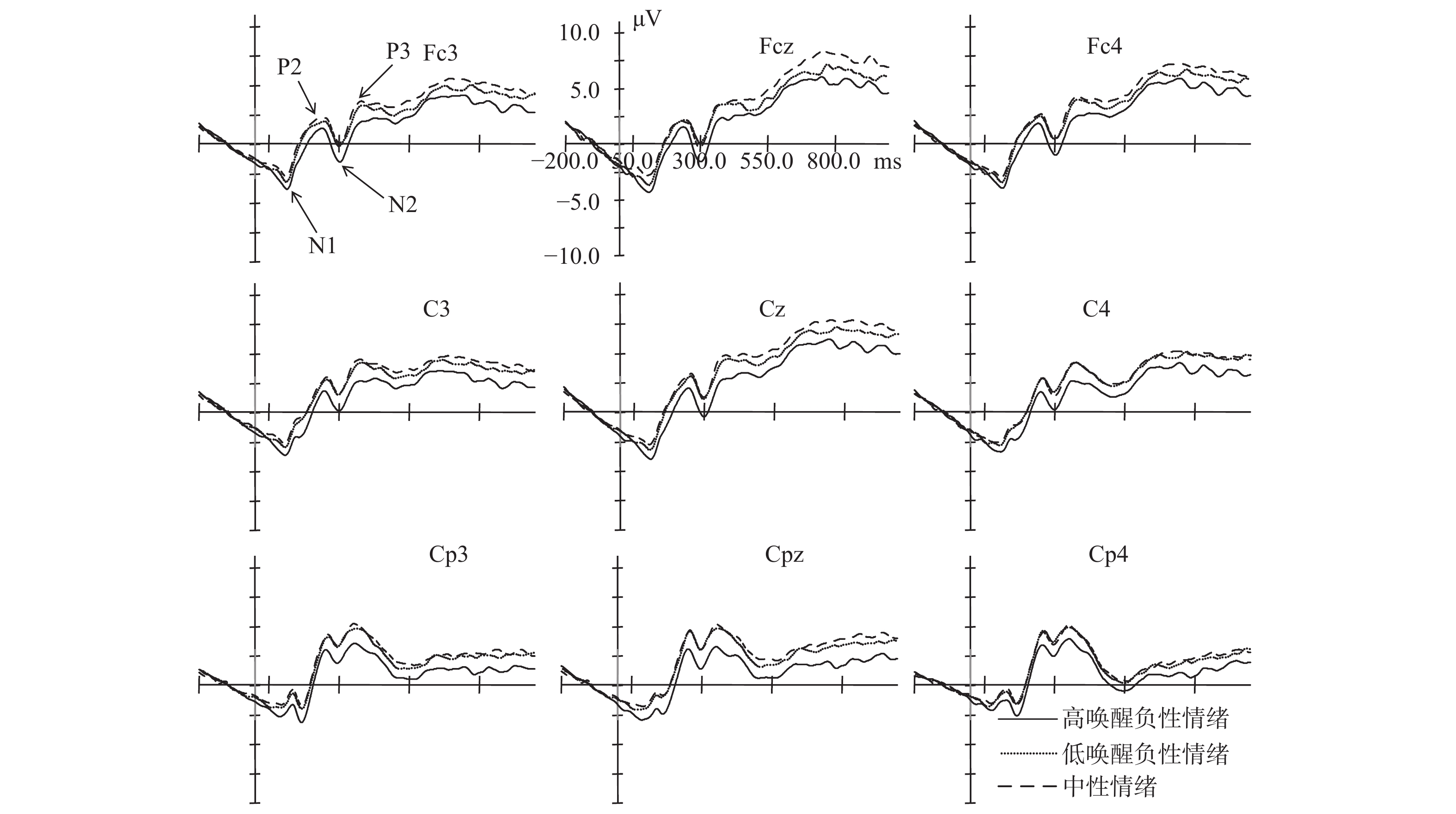 |
| 图 3 非特质焦虑被试在三种情绪启动条件下对标准刺激的脑电图 |
非特质焦虑被试三种情绪启动条件下对偏差刺激在Fcz、Cz、Cpz、Fc3、Fc4、C3、C4、Cp3和Cp4点上的脑电图如图4所示。
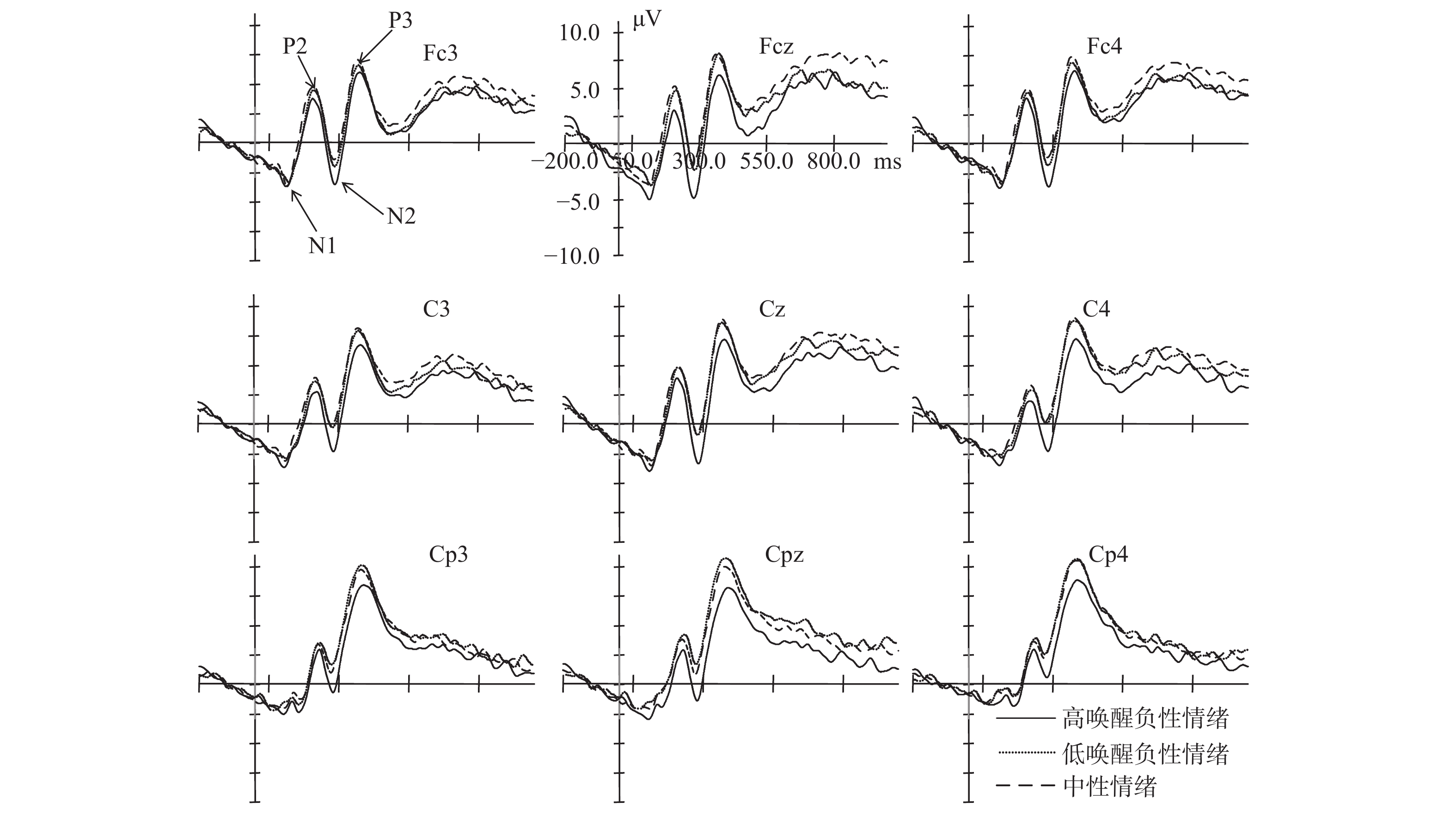 |
| 图 4 非特质焦虑被试在三种情绪启动条件下对偏差刺激的脑电图 |
4 讨论 4.1 特质焦虑和非特质焦虑大学生的行为抑制
本研究采用双选择Oddball任务诱发特质焦虑和非特质焦虑大学生的行为抑制。结果发现,所有被试对偏差刺激的反应时均高于对标准刺激的反应时,被试面对偏差刺激时需要抑制对标准刺激的优势反应,导致其对偏差刺激的反应时增加。通过ERPs相关成分的分析,可以清楚地反映出行为抑制的发生时程。偏差刺激诱发了更短的P2潜伏期和更大的P2波幅,这表明在早期加工阶段,被试可快速将更多的认知资源投入到对偏差刺激的加工中。此外,大量研究表明,N2是标志个体监控认知或行为抑制的重要成分(Folstein & van Petten, 2008; Grützmann, Riesel, Klawohn, Kathmann, & Endrass, 2014; Pires, Leitão, Guerrini, & Simões, 2014; Tillman & Wiens, 2011),中央–顶区的P3成分反映了认知抑制或是行为抑制的过程(Kok, Ramautar, de Ruiter, Band, & Ridderinkhof, 2004)。以往有关抑制控制的研究发现了抑制控制任务中N2和P3的不同效应,比如在停止–信号任务中,如果被试没有成功抑制行为,其N2波幅增大,P3波幅却降低(Dimoska, Johnstone, & Barry, 2006),然而,在Flanker任务中,有研究者发现抑制任务中的N2波幅增大,P3波幅没有变化(Heil, Osman, Wiegelmann, Rolke, & Hennighausen, 2000),也有研究发现抑制任务中并未检测到N2的出现(Kalamala, Szewczyk, Senderecka, & Wodniecka, 2018)。本研究中使用的双选择Oddball任务中,要求被试对两类出现概率不同的刺激做不同的反应,当概率低的刺激出现时,被试需要抑制对高概率刺激的反应。与Go/No–go任务和停止–信号任务不同的是,双选择Oddball任务中,在行为抑制出现时,也要做出相应的反应,这更有利于考察行为抑制的机制(袁加锦等, 2017)。本实验中,由偏差刺激诱发的N2和P3的波幅显著大于由标准刺激诱发的波幅,说明被试将更多的认知资源投入到对偏差刺激的加工中。因此,由双选择Oddball任务诱发的行为抑制效应发生在行为反应的早、中、晚三个阶段,相比标准刺激,被试可更快的识别到偏差刺激的存在,并将更多的认知资源投入到对偏差刺激的加工中,导致对偏差刺激的反应时增加。
4.2 情绪启动对特质焦虑和非特质焦虑大学生行为抑制的促进本研究采用高时间分辨率的ERPs技术考察了不同唤醒度水平的负性情绪启动对特质焦虑和非特质焦虑大学生行为抑制的影响。在行为反应时上,并没有表现出情绪相关的主效应以及交互作用,特质焦虑被试也没有表现出与非特质焦虑被试的不同。而ERPs的结果可以更加精细的考察高、低唤醒的负性情绪启动对特质焦虑和非特质焦虑大学生行为抑制有何影响以及这种影响发生的时间及机制。
反映早期加工过程的N1成分(Williams et al., 2016)的波幅在高唤醒负性情绪启动之后比低唤醒负性情绪启动和中性情绪启动之后更大,说明高唤醒负性情绪启动之后的早期阶段,被试便将更多的认知资源投入到之后的双选择Oddball任务中,这与“双重竞争模型”中指出的,情绪可以通过感知觉过程影响个体的执行控制是一致的。更有趣的是,在高唤醒的负性情绪启动之后,对偏差刺激的N1潜伏期比标准刺激更短,且这一现象仅发生在非特质焦虑被试群体中,高唤醒的负性情绪启动刺激可快速吸引被试的注意,进而帮助非特质焦虑被试更快地监测到偏差刺激的存在。注意控制理论指出,焦虑会增加个体对自下而上加工过程认知资源的投入(Eysenck & Derakshan, 2011),双选择Oddball任务中,被试不需要对启动刺激做反应,但高唤醒的负性情绪启动刺激可通过自下而上的方式吸引特质焦虑大学生投入较多的认知资源,导致在对目标刺激加工的起始阶段,高唤醒负性情绪未能对特质焦虑大学生行为抑制过程产生影响。而在继N1之后的P2潜伏期上,两组被试均表现为对偏差刺激的潜伏期更短,说明两组被试在这一阶段均已觉察到目标刺激的不同。偏差刺激比标准刺激诱发了更大的N1–P2波幅,相比标准刺激而言,在早期加工阶段被试就对偏差刺激投入了更多的认知加工资源,而且高唤醒负性情绪启动条件下的N1–P2波幅比低唤醒负性情绪和中性情绪启动条件更大,说明高唤醒负性情绪启动条件下被试对目标投入的认知资源更多。这为高唤醒负性情绪启动条件下被试有效地抑制优势反应,成功做出行为反应起了重要作用。
N2是标志个体监控认知或行为抑制的重要成分。本实验中,N2成分的波幅在高唤醒负性情绪启动条件下要显著大于低唤醒负性情绪和中性情绪启动条件,说明高唤醒的负性情绪启动之后,所有的被试都更清晰、有效地感知、检测到认知冲突的存在,这一过程需要消耗较多的认知资源,从而保障被试有效完成行为抑制任务。偏差刺激之后300至500 ms左右继N2之后有一个正性走向的P3成分,有研究者认为,这一P3成分与经典的P3成分不同,该成分出现在中央–顶区,反映了认知抑制或是行为抑制的过程(Kok et al., 2004)。在本研究中,目标刺激呈现后出现了一个明显的中央–顶区P3成分,而且该成分在偏差刺激条件下比标准刺激下波幅更大,说明行为抑制任务的完成需要更多的认知资源。特质焦虑和非特质焦虑被试在P3成分的潜伏期和波幅上出现了结果的分化,非特质焦虑被试对偏差刺激的P3潜伏期比标准刺激更短,更早抑制优势行为出现;也仅有非特质焦虑被试在高唤醒负性情绪启动后的P3波幅更小,在此阶段,非特质焦虑被试可以更轻松的完成抑制优势行为的反应。
5 结论对特质焦虑个体,高唤醒负性情绪启动促进其更好的检测行为抑制;对非特质焦虑个体,高唤醒负性情绪启动促进其对偏差刺激的早期识别、行为抑制的检测并更容易地完成行为抑制任务。
白露, 马慧, 黄宇霞, 罗跃嘉. (2005). 中国情绪图片系统的编制——在46名中国大学生中的试用. 中国心理卫生杂志, 19(11): 719-722. DOI:10.3321/j.issn:1000-6729.2005.11.001 |
戴晓阳. (2014). 常用心理评估量表手册. 北京: 人民军医出版社.
|
贾丽萍, 白学军, 邵建岗, 卢国华, 韩冰雪, 李长江. (2018). 情绪诱发对有特质焦虑大学生的行为抑制的影响. 中国心理卫生杂志, 32(12): 1029-1033. DOI:10.3969/j.issn.1000-6729.2018.12.012 |
梁丽美, 李佳根, 贾江晓, 宋海秀, 雷怡, 李红, 张文海. (2018). 不同性质的评价对特质焦虑者抑制功能影响的ERP研究. 心理与行为研究, 16(3): 335-341. DOI:10.3969/j.issn.1672-0628.2018.03.008 |
余凤琼, 袁加锦, 罗跃嘉. (2009). 情绪干扰听觉反应冲突的ERP研究. 心理学报, 41(7): 594-601. |
袁加锦, 徐萌萌, 杨洁敏, 李红. (2017). 双选择Oddball范式在行为抑制控制研究中的应用. 中国科学: 生命科学, 47(10): 1065-1073. |
周雅. (2013). 情绪唤起对执行功能的作用. 心理科学进展, 21(7): 1186-1199. |
Berggren, N., & Derakshan, N. (2013). Attentional control deficits in trait anxiety: Why you see them and why you don’t. Biological Psychology, 92(3): 440-446. DOI:10.1016/j.biopsycho.2012.03.007 |
Dichter, G. S., Felder, J. N., & Smoski, M. J. (2009). Affective context interferes with cognitive control in unipolar depression: An fMRI investigation. Journal of Affective Disorders, 114(1-3): 131-142. DOI:10.1016/j.jad.2008.06.027 |
Dimoska, A., Johnstone, S. J., & Barry, R. J. (2006). The auditory-evoked N2 and P3 components in the stop-signal task: Indices of inhibition, response-conflict or error-detection?. Brain and Cognition, 62(2): 98-112. DOI:10.1016/j.bandc.2006.03.011 |
Eysenck, M. W., & Derakshan, N. (2011). New perspectives in attentional control theory. Personality & Individual Differences, 50(7): 955-960. |
Eysenck, M. W., Derakshan, N., Santos, R., & Calvo, M. G. (2007). Anxiety and cognitive performance: Attentional control theory. Emotion, 7(2): 336-353. DOI:10.1037/1528-3542.7.2.336 |
Fichtenholtz, H. M., Dean, H. L., Dillon, D. G., Yamasaki, H., McCarthy, G., & LaBar, K. S. (2004). Emotion-attention network interactions during a visual oddball task. Cognitive Brain Research, 20(1): 67-80. DOI:10.1016/j.cogbrainres.2004.01.006 |
Folstein, J. R., & van Petten, C. (2008). Influence of cognitive control and mismatch on the N2 component of the ERP: A review. Psychophysiology, 45(1): 152-170. |
Grützmann, R., Riesel, A., Klawohn, J., Kathmann, N., & Endrass, T. (2014). Complementary modulation of N2 and CRN by conflict frequency. Psychophysiology, 51(8): 761-772. DOI:10.1111/psyp.12222 |
Heil, M., Osman, A., Wiegelmann, J., Rolke, B., & Hennighausen, E. (2000). N200 in the Eriksen-task: Inhibitory executive processes?. Journal of Psychophysiology, 14(4): 218-225. DOI:10.1027//0269-8803.14.4.218 |
Kalamala, P., Szewczyk, J., Senderecka, M., & Wodniecka, Z. (2018). Flanker task with equiprobable congruent and incongruent conditions does not elicit the conflict N2. Psychophysiology, 55(2): e12980. DOI:10.1111/psyp.12980 |
Kissler, J., & Keil, A. (2008). Look-don’t look! How emotional pictures affect pro- and anti-saccades. Experimental Brain Research, 188(2): 215-222. DOI:10.1007/s00221-008-1358-0 |
Kok, A., Ramautar, J. R., De Ruiter, M. B., Band, G. P. H., & Ridderinkhof, K. R. (2004). ERP components associated with successful and unsuccessful stopping in a stop-signal task. Psychophysiology, 41(1): 9-20. DOI:10.1046/j.1469-8986.2003.00127.x |
Pessoa, L. (2012). Beyond brain regions: Network perspective of cognition-emotion interactions. Behavioral and Brain Sciences, 35(3): 158-159. DOI:10.1017/S0140525X11001567 |
Pessoa, L., Padmala, S., Kenzer, A., & Bauer, A. (2012). Interactions between cognition and emotion during response inhibition. Emotion, 12(1): 192-197. DOI:10.1037/a0024109 |
Pires, L., Leitão, J., Guerrini, C., & Simões, M. R. (2014). Event-related brain potentials in the study of inhibition: Cognitive control, source localization and age-related modulations. Neuropsychology Review, 24(4): 461-490. DOI:10.1007/s11065-014-9275-4 |
Tillman, C. M., & Wiens, S. (2011). Behavioral and ERP indices of response conflict in Stroop and flanker tasks. Psychophysiology, 48(10): 1405-1411. DOI:10.1111/j.1469-8986.2011.01203.x |
Williams, R. S., Biel, A. L., Wegier, P., Lapp, L. K., Dyson, B. J., & Spaniol, J. (2016). Age differences in the attention network test: Evidence from behavior and event-related potentials. Brain and Cognition, 102: 65-79. DOI:10.1016/j.bandc.2015.12.007 |
 2019, Vol. 17
2019, Vol. 17


