新世纪伊始,美国药品行业专利侵权纠纷数量便呈现出快速增长趋势,恰逢其时,一种新型的专利侵权纠纷解决方式应运而生,即“药品专利反向支付协议”。它是指拥有药品专利权利的专利药企与发起药品专利挑战的仿制药企在药品专利侵权诉讼中私下协商、秘密合谋签订的,由专利药企(原告)向仿制药企(被告)给付巨额经济补偿,仿制药企向专利药企承诺延迟仿制药入市的共享垄断利润的专利和解协议[1]。由于与正常状态下(如药品专利许可或转让协议)仿制药企向专利药企支付经济费用的资金流动方向截然相反,故被称之为“反向支付”。与一般市场主体之间日常签订的普通民商事合同不同,药品专利反向支付协议事关专利药企滥用市场支配地位排除、限制竞争问题以及专利药企和仿制药企横向垄断合谋问题,因而必须给予足够重视和保持高度警惕。
纵观国内外近几年的典型案例和学术文献,可以看出,虽然国外学界早已对药品竞争领域中出现的反向支付问题进行了较为丰富的实务探讨和理论研究,但目前关于反向支付协议反垄断审查规则的选择适用问题仍旧处于“百家争鸣”阶段,至今尚未形成统一明确的反垄断审判标准,另外国外学者对于反向支付协议的定性也存在着稍许漏洞。反观国内学界,在药品专利反向支付协议问题上的研究成果寥寥可数,颇显“寒酸”,能够检索到的文献资料绝大多数是在笼统地梳理介绍与反向支付协议相关的国外反垄断法律与实务性案例,更有甚者,完全是将国外学者的某些观点照搬照抄,鲜有国内学者结合我国实际情况对反向支付问题进行深入细致的比较研究。这就导致国内学界在反向支付行为定性和反垄断审查规则取舍问题上陷入了只知其一,不知其二的尴尬境地。鉴于此,本研究拟以我国民众密切关注的医药行业热点问题为切入口,在反垄断法视阈下对药品领域反向支付现象进行系统研究。
1 药品专利反向支付协议出现的法律背景美国国会于1984年颁布的《药品价格竞争与专利期补偿法》(被称为“Hatch-Waxman法案”)是平衡美国专利药企创新利益和仿制药企竞争利益的最佳法律典范,是推动美国现代仿制药业和医疗事业蓬勃发展的重要法律保障,但同时也是导致美国药品专利反向支付协议猖獗盛行的主要法律因素。
首先,Hatch-Waxman法案中规定了一种仿制药上市审批简化程序,即仿制药企若欲申请仿制药上市,只须向美国食品药品监督管理局(Food and Drug Administration,简称“FDA”)递交一份“简化新药申请”(Abbreviated New Drug Application,简称“ANDA”),证明仿制药与专利药的活性成分、剂型规格、治疗作用以及生物等效性等要素效果相同,而无须提供复杂的临床试验数据证明仿制药的安全有效性[2]。
其次,仿制药企在提交ANDA时,须对《经治疗等同性评价批准的药物》(又称为“橙皮书”)一书中专利药企登记的药品专利分四种情况作出声明:第一段声明,橙皮书中没有登记与该仿制药相关的专利;第二段声明,橙皮书中登记的与该仿制药相关的专利已经过期;第三段声明,在橙皮书中登记的相关专利到期前不会上市销售该仿制药;第四段声明,橙皮书中登记的相关专利已经无效或该仿制药不会侵犯相关专利[3]。
再次,若仿制药企提交ANDA时作出“第四段声明”,则必须尽快在20日内通知专利药企,如专利药企在收到仿制药企通知后的45日内并没有向法院提起药品专利侵权诉讼,则FDA则会立即开始审查仿制药申请,也就是说ANDA将可能直接获批,如专利药企在45日内提起了药品专利侵权诉讼,则FDA将自动中止审查仿制药申请长达30个月,直至法院作出药品专利确属无效或仿制药没有侵权的判决,亦或等到30个月“遏制期”届满。
最后,若第一个作出“第四段声明”的仿制药企,即“首仿药企”的ANDA获得了FDA的批准,那么该仿制药企将享有180日市场独占期,在此期间内,有且只有该仿制药企可以自由研发、生产和销售获批的仿制药。由于“180日市场独占期”的起算点是首仿药企实际进入市场销售仿制药之日,也就是说,只要延迟首仿药企入市时间就能有效阻碍其他潜在仿制药企入市,这就直接促使专利药企纷纷选择在药品专利侵权诉讼中与仿制药企签订反向支付协议实现和解。
2 药品专利反向支付协议的反垄断规制难题 2.1 利益冲突难以调和 2.1.1 专利药企利益与仿制药企利益的冲突由于新药研发实属高投资、高风险工作,因而专利药企为尽快回收前期巨额成本,在获得药品专利权后制定垄断高价赚取利润无可厚非,若缺少丰厚回报的刺激,专利药企便会怠于研发新药。同时,仿制药企在药品市场中也起着不可或缺的作用,虽然相较于专利药研发,仿制药生产投入成本较少,但这并不意味着仿制药企利益就不值得保护,因为正是有了低价优质的仿制药,消费者才拥有了自主选择药品的权利,所以仿制药企利益也不容忽视。在药品专利侵权诉讼中,当专利药企利益与仿制药企利益之间产生不可调和的利益冲突时,若偏向保护专利药企利益,会加大仿制药企“专利挑战”压力,促使其接受反向支付协议;若只顾保护仿制药企利益,会迫使专利药企铤而走险,积极寻求与仿制药企签订反向支付协议的机会。
2.1.2 私人利益与公共利益的冲突根据西方经济学家提出的“经济人”理论假设,人的本性天生就是“利己主义”,虽然利己目的需要通过利他手段来实现,客观上在某个社会阶段会促进公共利益,但随着个人私欲的不断膨胀,不可避免会出现一味追求个人利益而损害公共利益的现象,反向支付协议便是药企之间达成共谋,以牺牲社会公共利益为代价,谋取私人经济利益的具体体现。由于药品事关人类身体健康,意义尤为重大,因而消费者需求表现得较为刚性,这就导致即便专利药企为维持市场独占地位而向仿制药企反向支付的巨额经济补偿最终会被转嫁给消费者,消费者也无任何能力予以抵抗。由此可见,反向支付协议表面上似乎只涉及药企之间私人利益,但实际上深受影响的却是广大社会公众。
2.1.3 创新利益与竞争利益的冲突事实上,无论在哪个行业或领域,研发创新与市场竞争之间原本就不是非此即彼、互相排斥的对立关系,二者理应是相互促进、良性互动的正相关关系,市场竞争能够激励研发创新,研发创新反过来也能够提升市场竞争质量。之所以反向支付协议反垄断审查过程中会涉及激励研发创新与维护市场竞争之间的利益平衡考量,主要存在以下两方面原因:一是药品自身与生俱来的特殊属性,不仅事关国计民生,而且研发创新成本还极高;二是药品市场中确实存在着专利药企滥用“问题专利”实施各类反竞争行为的不良现象。
2.2 竞争效果难以认定 2.2.1 主体规模对竞争效果认定的影响主体规模一般包含主体数量和主体经济实力两个要素:一方面,反向支付协议签订主体包括两类药企,即专利药企和仿制药企,并且专利药企的数量只有一个,而仿制药企的数量则有一个(首仿药企)到多个(既有首仿药企,也有其他潜在仿制药企)不等;另一方面,目前实务中反向支付协议签订主体的经济实力都极为雄厚,无论是专利药企还是仿制药企,基本上都是全球制药巨头,在相关药品市场上拥有较强的市场支配力。通常来说,反向支付协议签订主体数量越多、经济实力越强,反竞争效果就越明显。
2.2.2 背后动机对竞争效果认定的影响由于药品专利侵权诉讼不仅关系药品领域的技术问题,还涉及专利领域的法律问题,这就导致在认定仿制药企是否对专利药企享有的药品专利权构成侵权时,需耗费巨大的人财物资源,此时某些专利药企为了集中精力专注新药研发,便会倾向于选择和解方式解决现有侵权纠纷。但问题是,绝大多数反向支付协议是涉嫌构成横向垄断协议的不正当竞争行为,因此专利药企签订反向支付协议的背后动机究竟是为了在药品专利有效性较强的情况下尽快摆脱诉累,还是在药品专利有效性较弱的情况下合谋排斥竞争,这对认定反向支付协议竞争效果有重要影响。
2.2.3 入市时间对竞争效果认定的影响反向支付协议若约定仿制药企的入市时间点晚于专利到期日,这就明显限制了其他潜在仿制药企参与竞争,反竞争效果较容易认定。然而,实践中多数反向支付协议选取的仿制药入市时间点都早于专利药专利到期日,这样仅从时间节点来看,不仅没有推迟仿制药企入市时间,还使得仿制药企无须等待药品专利期满就可提前入市。但若考虑到药品专利可能是“问题专利”(无效或过期),那么仿制药企入市时间就很有可能比协议约定的更早。由于存在这种可能性,就导致反向支付协议的竞争效果认定产生争议。
2.2.4 表现形式对竞争效果认定的影响一般情况下,药企之间约定反向利益流动的表现形式都是直接的货币转移,但随着反垄断机构查处力度不断增大,反向支付的表现形式变得愈发隐蔽,大致有以下几种:其一,仿制药企授权许可专利药企使用自己享有的药品专利,专利药企向仿制药企支付专利授权许可费;其二,专利药企承诺在仿制药企排他销售期间内,不推出“授权仿制药”同仿制药企展开竞争;其三,专利药企承诺在药品专利保护期限届满后授权许可仿制药企销售其“授权仿制药”;其四,专利药企与仿制药企达成合意共同销售专利药[4]。该类附属协议借助虚假商业行为掩盖反向支付本质,无形中加大了反垄断机构认定反向支付协议竞争效果的难度。
3 美国药品专利反向支付协议的反垄断规制实践 3.1 本身违法规则Cardizem CD案本身违法规则是美国反垄断法中的重要审查规则,它是指对于经营者之间存在的垄断共谋行为,不管其实施原因、具体情形和造成影响如何,均直接将其认定为严重损害市场竞争和消费者利益的违法行为,予以禁止[5]。Cardizem CD案是首个也是唯一适用该规则的反向支付协议案件。
Cardizen CD是HMR公司生产的一款专门用于治疗心绞痛、高血压,预防心脏病、中风的创新药物,且已经申请了专利。1995年9月,Andrx公司向FDA递交了一份Cardizem CD仿制药简略申请,并作出了第四段声明。随后,HMR公司向法院提起药品专利侵权诉讼,指控Andrx公司的仿制药申请构成对自己药品专利权的侵犯,与此同时FDA中止了对该仿制药申请的审查,将其搁置30个月。1997年9月,FDA对Andrx公司仿制药申请进行了初步审查并核准,这表明只要30个月“遏制期”一到,该仿制药申请便会得到完全核准,Andrx公司也就能够生产、销售该仿制药。然而,在FDA初步核准后不久,HMR公司与Andrx公司却在诉讼中达成了和解,签订了反向支付协议,约定Andrx公司不得将Cardizem CD仿制药在药品专利侵权诉讼作出最终判决前投入市场,作为回报或补偿,HMR公司会自Andrx公司仿制药申请获批之日起至仿制药最终上市止,每年向其给付4 000万美元。这样,HMR公司就通过推迟Andrx公司180日市场独占期的使用,延迟了其他潜在仿制药企入市竞争时间。之后不久,利益受损的药品零售商和消费者开始质疑该药品专利和解协议的合法性,向美国地区法院提起了诉讼。美国地区法院经审理认为,作为专利药企的HMR公司和作为仿制药企的Andrx公司之间确属竞争关系,二者共谋达成的推迟入市约定和反向支付协议构成了《谢尔曼法》第1条中严重限制竞争的“横向市场分割协议”,应适用本身违法规则,无须分析背后的真正意图和产生的客观效果。后该案被上诉至美国联邦第六巡回法院,法院同样运用本身违法规则认可了地区法院的判决[6]。
由此可见,在Cardizem CD案中,对于利益冲突,法院更倾向于维护仿制药企利益、公共利益和竞争利益,因而反垄断机构须警惕专利药企铤而走险寻求与仿制药企合谋签订反向支付协议的情形,对于竞争效果,法院适用本身违法规则,直接认定反向支付协议具有严重的反竞争效果,对主体规模、背后动机、入市时间以及表现形式等影响竞争效果的因素并未再作具体分析。
3.2 专利范围测试规则Schering-Plough案专利范围测试规则并不是传统意义上独立出来的反垄断法审查规则,而是由美国法院于某个阶段在司法实践中探索创设的,优先从专利保护角度考虑,对反向支付协议产生的反竞争效果进行分析认定的新思路与新方法[7]。2005年的Schering-Plough案正式确立了专利范围测试规则。
Schering-Plough公司生产了一款缓释微胶囊氯化钾补充剂K-Dur 20,并对氯化钾缓释涂层配方申请了专利,于2006年9月到期。1995年末,Upsher- smith公司向FDA提出销售K-Dur 20仿制药Klor Con M20的申请,同时提交了第四段声明,并通知了Schering-Plough公司。之后不久,Schering-Plough公司向法院提起药品专利侵权诉讼,FDA也旋即暂停对Upsher- smith公司仿制药申请的审查。然而,1997年6月,两家公司在审判前夕达成了和解协议,约定将2001年9月1日作为Klor Con M20最早的上市日期,同时Upsher- smith公司将自己拥有的5款药品专利授权给Schering Plough公司使用,Schering-Plough公司须向UpsherSmith公司支付6 000万美元的初始使用费、1 000万美元的特许权使用费以及销售额10%或15%的提成费。对此,2001年3月30日,美国联邦贸易委员会(Federal Trade Commission,简称“FTC”)提起了行政诉讼,指控Schering-Plough公司和UpsherSmith公司达成的和解协议是限制贸易的非法协议,两家公司合谋垄断氯化钾补充剂市场的行为已经严重违反《联邦贸易委员会法》和《谢尔曼法》,应予以惩处。行政法官经过审理,认为两家公司达成的和解协议是合法的专利侵权诉讼解决方案,若坚持主张和解协议具有反竞争性,须证明K-Dur 20专利无效或Klor Con M20对其不构成侵权,即须评估药品专利本身强度及排他效力。由于FTC未能证明Schering-Plough公司持有的K-Dur 20专利属“问题专利”,也就无法证明Schering-Plough公司在相关氯化钾补充剂市场上存在非法垄断行为,因此予以驳回。后该案被上诉至美国联邦第十一巡回法院,该法院也是坚持认为审查反向支付协议违法性应适用专利范围测试规则(图 1)[8],由于K-Dur 20专利于2006年9月到期,Schering-Plough公司和Upsher-Smith公司签订的和解协议也就并未超出药品专利合理保护范围,因而不构成横向垄断协议[9]。
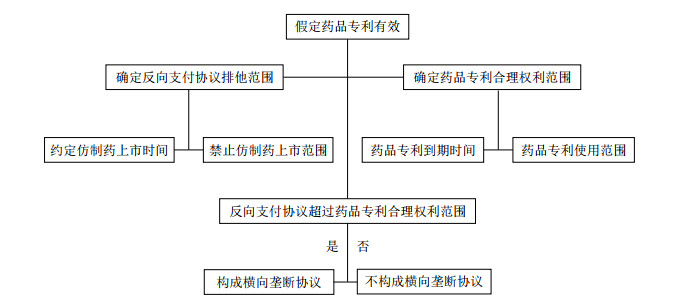 |
| 图1 专利范围测试规则适用图析 |
显而易见,在Schering-Plough案中,对于利益冲突,法院更倾向于维护专利药企利益、私人利益和创新利益,此时反垄断机构须重点关注仿制药企动向,防止仿制药企在巨大药品专利保护压力下,轻易接受专利药企提出的反向支付协议,对于竞争效果,法院主要分析了入市时间,认为只要约定的仿制药企入市时间早于药品专利到期日,则不存在违反反垄断法之说,至于主体规模、背后动机以及表现形式等因素也没有多加考虑。
3.3 快速审查规则K-Dur案快速审查规则又称为“推定违法规则”,实行举证责任倒置,即当原告提出初步证据起诉被告实施了具有反竞争效果的垄断行为时,举证责任转移至被告,被告须提出合法抗辩理由证明其行为的促进竞争效果[10]。在上述Schering-Plough案后续发展中,各种独立于FTC的私人团体(包括药品批发商、零售商及其他潜在仿制药企)开始陆续提起集体诉讼,被称为“K-Dur案”。
K-Dur案上诉法院美国联邦第三巡回法院在对本身违法规则和专利范围测试规则提出质疑的同时,转而选择一条“中间道路”快速审查规则来认定反向支付协议的违法性。第三巡回法院认为,对于一份只要是“具有基本经济学知识的人”就能轻易观察出“显著反竞争效果”的反向支付协议,便可适用简易的快速审查规则,将专利持有人向承诺推迟入市时间的专利挑战者给付的任何款项视为对贸易进行不合理限制的“初步证据”。只有当专利持有人有充分的相反证据证明给付是用于延迟入市以外的目的或给付产生的竞争效果大于反竞争效果时,该“初步证据”才可被推翻[11]。基于此,由于Schering-Plough公司和Upsher-Smith公司提出的证据尚不足以证明签订的反向支付协议不具有反竞争性,因而第三巡回法院最终拒绝了两公司的辩解,支持了私人团体的诉讼请求,撤销了地方法院适用专利范围测试规则作出的裁决[12]。
据此,在K-Dur案中,对于利益冲突,法院在保护仿制药企利益、公共利益和竞争利益的同时,也兼顾了专利药企利益、私人利益和创新利益;对于竞争效果,法院尽可能地将包括主体规模、背后动机、入市时间以及表现形式等在内的竞争效果认定因素的证明责任分摊给原被告双方,以此平衡举证负担。然而,快速审查规则适用频率却并不高,究其原因,一方面是因为该规则的适用过程会导致反向支付案件最终走向无法得到准确预测,另一方面也是因为该规则的定性问题至今在反垄断法学界都无法形成统一看法。
3.4 合理规则Actavis案合理规则是美国反垄断法中又一经典审查规则,它是指对于市场上某些垄断行为所产生的竞争效果应进行综合全面衡量,若垄断行为促进竞争效果远超反竞争效果,则合法,反之,即违法。美国法院关于Actavis案的判决确立了该规则在反向支付协议反垄断审查中的地位,具有里程碑式的意义。
Solvay公司于2000年获得了药物雄性凝胶AndroGel的专利,该药品专利将于2021年1月31日到期。随后在2003年,Actavis公司(继而还有Paddock公司和Par公司)向FDA提出了生产、销售AndroGel仿制药的申请,并作出第四段声明,主张Solvay公司的AndroGe专利实属无效专利,它们制造的仿制药不存在侵权问题。对此,Solvay公司旋即向法院提起诉讼,指控Actavis公司的仿制药申请侵犯其持有的药品专利权。虽然在30个月遏制期限届满后,FDA批准了Actavis公司的仿制药申请,并授予其180日市场独占期,但Actavis公司却没有及时将仿制药推向市场,而是与Solvay公司在药品专利侵权诉讼中达成了反向支付和解协议,约定在2015年8月31日之前,即药品专利到期前65个月内,Actavis公司不会将仿制药投入市场,同时必须协助Solvay公司向医生推销AndroGel,在此期间,Solvay公司则须每年向Actavis公司支付费用1 900万至3 000万美元。尽管两家药企极力主张支付款项是作为仿制药企提供其他服务的对价,且约定的入市时间仍在药品专利保护期限内,因而为合法的专利排他行为。但FTC经调查认为,Actavis公司提供的协助推销等服务对Solvay公司来说几乎没有任何实际价值,和解的真正意图在于确保药品专利不受质疑,以通过延迟推出低成本仿制药的手段非法延长专利药垄断,从而共享垄断利润,这明显违反《谢尔曼法》,构成横向垄断协议,应直接推定为非法。一审中,FTC的起诉被地方法院驳回,二审上诉至美国联邦第十一巡回法院,法院适用专利范围测试规则认可了反向支付协议的合法性,支持了被告的主张,维持了地方法院的判决。最后,该案被提交到美国联邦最高法院进行审理,2013年6月17日,最高法院以5:3投票作出裁决,指出反向支付协议固然具有反竞争可能性,但仍应适用合理规则进行个案审查。现该案已被发回重审,最终判决结果有待关注[13]。
综上,在Actavis案中,美国联邦最高法院青睐于适用合理规则,并认为其才是判定反向支付协议违法性的最佳规则。对于利益冲突,最高法院予以综合权衡,虽立足于社会公共利益, 但也兼顾药企私人利益,强调“一案一判”,也就不会在某一具体案件中对各方利益顾此失彼;对于竞争效果,最高法院认为应对主体规模、背后动机、入市时间以及表现形式等因素进行全面分析,同时还须具体考察反向支付协议存在的合理性、正当性等。合理规则的适用,虽能够在最大程度上实现实体正义,但诉讼成本(包括时间成本和经济成本)耗费巨大,且由于美国最高法院并没有明确指出合理规则下反向支付协议竞争效果认定的考量因素,因而普适性标准的欠缺会给审判结果造成极大的不确定性。
4 欧盟药品专利反向支付协议的反垄断规制实践 4.1 调查报告划分专利和解协议类型2008年1月,欧盟委员会(简称“欧委会”)首次启动针对药品领域专利和解协议的调查工作,并于2009年7月发布了最终调查报告。此后,欧委会几乎每年都会开展此项工作并制作详细报告,截止2019年7月,欧委会已经在其官网上陆续发布了8份调查报告,具体列出了划分专利和解协议的两个重要标准,分别是:第一,是否限制仿制药企入市销售“独立仿制药”;第二,是否存在专利药企向仿制药企进行价值转移[14]。
详而言之,针对第一个标准,协议限制仿制药企进入市场的方式包括但不限于以下几种:(1)约定“不质疑条款”(仿制药企不得对药品专利有效性加以质疑)和“不竞争条款”(仿制药企不得在药品专利到期前入市竞争),这是最直接限制仿制药企进入市场的方式;(2)约定专利药企许可仿制药企生产销售“授权仿制药”,此种情形下,由于仿制药企无法自主生产销售“独立仿制药”,也就不能自由制定商业竞争策略,这就使得专利药企通过许可条款至少部分控制了仿制药企入市;(3)约定仿制药企是专利药企药品的分销商或者仿制药企所需活性药物成分须由专利药企供应(即专利药企成为仿制药企的供货商),这也将导致仿制药企的经营活动或多或少地会受到专利药企的限制。同样地,针对第二个标准,协议约定药企之间价值转移的方式包括但也不限于以下几种:(1)直接货币转移,通常包括弥补仿制药企推迟入市的损失,补偿仿制药企进行诉讼的成本以及支付购买仿制药企自有药品的款项等费用,这是最明显的价值转移方式;(2)分销协议或附带交易,旨在给予仿制药企一定的商业利益,主要表现为允许仿制药企进入另一地域市场(分销协议)或另一药品市场(附带交易)销售;(3)许可仿制药企进入市场销售“授权仿制药”。可以发现,两个标准在内容上多有交叉重合之处,但这是由于划分角度不同导致,故而并不影响协议性质认定。
基于上述标准,再对专利和解协议进行如下分类(图 2):A类,不限制仿制药企入市;B类,限制仿制药企入市。B类又可进一步分为:B.I类,不存在价值转移;B.II类,存在价值转移[15]。一般来说,对于A类协议而言,由于仿制药企是以自己生产的仿制药,即“独立仿制药”进入市场销售,因而不会产生反竞争效果,也就不涉及欧盟反垄断法问题;对于B.I类协议而言,通常也不会遭致反垄断机构审查,因为此时专利药企持有的药品专利可能确实有效,但若药品专利是专利药企提供错误、虚假信息获得,此时就会产生较为严重的反竞争效果,需欧盟反垄断法介入规制;对于B.II类协议而言,由于专利药企通过价值转移的方式限制仿制药企进入市场销售“独立仿制药”的行为,绝大多数情况下都会产生极为强烈的反竞争效果,因而其最有可能引起反垄断机构审查,但这也并非表明该类协议都不符合欧盟反垄断法,还是需要对个案情况进行详细评估,才能得出能否给予豁免的最终结论。
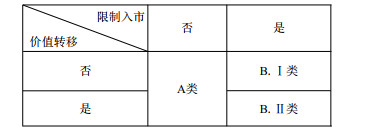 |
| 图2 专利和解协议类型图析 |
欧洲反向支付协议监管主要依赖于欧委会反垄断执法,目前在欧盟法院进行审判的反向支付案件实属少数,直至2020年1月30日,欧洲法院才首次对反向支付和解协议是否违反欧盟反垄断法给出明确指导。近年来,与药品领域竞争状况跟踪调查同时进行的,是欧委会业已针对欧洲药品市场上某些大型药企之间存在的反向支付行为展开了较为细致的反垄断审查工作。下面选取比较典型的Lundbeck案和Servier案予以具体分析。
4.2.1 以Lundbeck案为例自1977年以来,丹麦Lundbeck公司一直持有抗抑郁药西酞普兰的专利。2002年,Lundbeck公司与4家仿制药企在药品专利侵权诉讼中就西酞普兰仿制药问题达成反向支付协议。在每一份协议中,Lundbeck公司都同意向各个仿制药企直接支付费用或通过购买仿制药企库存、股票等间接支付费用,而仿制药企则须承诺将仿制药的生产、销售推迟一段时间。在协议签订时,Lundbeck公司的西酞普兰专利已经过期。2013年6月19日,欧委会对Lundbeck公司和4家仿制药企分别处以巨额罚款,这是欧盟首次针对反向支付协议开出罚单。欧委会认为,该案所涉协议明显已经构成限制竞争行为,且属“目的限制”,违反《欧盟运行条约》(Treaty on the Functioning of the European Union,简称“TFEU”)第101条关于“禁止限制性商业行为”的规定,无需再具体分析其限制竞争效果。随后,Lundbeck公司对欧委会处罚决定表示不服并提起诉讼。2016年9月8日,欧盟普通法院作出了支持欧委会认定Lundbeck等公司签订的反向支付协议违反欧盟反垄断法的判决,认为涉案药企提供的证据根本无法证明反向支付协议符合欧盟反垄断法豁免要件,因此理应遭受处罚。之后,虽然Lundbeck公司也向欧洲法院提起上诉,但被完全驳回,欧洲法院终审判决同样支持欧委会采取的严格做法[16]。
4.2.2 以Servier案为例培哚普利是Servier公司开发的一种用于治疗高血压和心力衰竭的药物,其活性药物成分专利已于1981年申请成功,并于2003年到期。另外该公司还申请了包括生物涂层、制备工艺等在内的多项“次要专利”,如2004年获批的“947号专利”,旨在设置专利壁垒、构筑专利网将竞争对手拒之门外。之后不久,10多家开发培哚普利仿制药版本、准备进入市场销售的仿制药企在欧洲专利局和某些国家法院(特别是英国和荷兰)针对“947号专利”的有效性提出了质疑。由于培哚普利的活性药物成分专利即将到期,仿制药企又在仿制药研发和入市方面取得了重大进展,因而在巨大竞争压力下,Servier公司想方设法地与5家仿制药企达成了反向支付协议。根据协议约定,仿制药企同意在“947号专利”到期前不进入市场与Servier公司展开竞争,以换取1.1亿欧元的现金和解。2008年11月,在药品领域竞争状况反垄断调查背景下,欧委会决定对Servier公司签订的反向支付协议进行深入审查。2014年7月,欧委会发现,协议显著推迟了培哚普利仿制药入市竞争时间,违反了TFEU第101条规定。此外,欧委会还发现Servier公司滥用其在培哚普利市场上的主导地位,在全球范围内收购任何可能成为竞争来源的关键性技术,却并不使用,旨在妨碍仿制药企开发培哚普利仿制药版本,违反了TFEU第102条关于“禁止滥用市场支配地位行为”的规定。最终,欧委会对涉案药企开出了共4.277亿欧元的罚单。2018年12月12日,欧盟普通法院对Servier案作出判决,这是继Lundbeck案之后就反向支付协议案件作出的第二项终审判决,虽然确认了欧委会对于协议反竞争性的认定,但同时也认为欧委会并没有适当界定培哚普利市场,对Servier公司占有市场支配地位认定有误,从而废除了欧委会根据TFEU第102条对Servier公司作所的处罚[17]。
4.3 审查规则“原则禁止,例外豁免”在欧盟反垄断法框架下,TFEU第101(1)条将经营者实施的限制竞争行为细分为两个类型:一为目的限制,即经营者之间合作以限制竞争为目的;二为效果限制,即经营者之间合作虽不以限制竞争为目的,但客观上却产生了限制竞争的效果。欧委会认为反向支付协议这一限制竞争行为应属目的限制,并且将其列入核心限制范畴。所谓核心限制,是指包括价格限制、数量限制以及市场分割等在内的多种卡特尔行为,由于这些行为本身表明的限制竞争目的已非常明显,因而可被直接推定为目的限制,也就没有必要再考虑其侵害竞争是否达到了显著程度[18]。联系到反向支付协议问题上,也就是说,协议产生的竞争效果如何不再是判定其违法与否的必要条件,反垄断机构无须再对主体规模、背后动机、入市时间以及表现形式等竞争效果影响因素作任何分析,就可直接依据协议属目的限制认定其违法。当然,欧盟反垄断法也给某些反向支付协议留有后路,即涉案药企可依据TFEU第101(3)条规定的豁免条款自证协议不违法,这一自证过程实质上是给了涉案药企对协议竞争效果进行具体分析的机会,与美国“本身违法规则”不可推翻有着本质区别。由此看出,在对反向支付协议所涉利益冲突问题的处理上,欧盟反垄断机构虽侧重于维护市场中其他潜在仿制药企利益、公共利益以及竞争利益,但也通过运用豁免制度兼顾了专利药企利益、私人利益以及创新利益。据此,“原则禁止,例外豁免”应是比较合理的审查反向支付协议违法垄断性的规则。
5 我国药品专利反向支付协议的反垄断规制思考 5.1 坚持贯彻“禁止+豁免”的反垄断审查规则通过考察我国寥寥无几的涉及反向支付协议相关论题的文献资料,可以发现,国内关注这一现象的学者之所以绝大多数都主张我国应适用“合理规则”对反向支付协议进行反垄断审查,是因为早就存在一个想当然的“前理解”,即在垄断行为违法性判断分析问题上,认为我国反垄断法一直采用的都是美国反托拉斯法中两大经典的反垄断审查规则——“本身违法规则”和“合理规则” [19]。然而,纵观我国现有的全部反垄断法条文,根本没有关于这两种反垄断审查规则的任何规定。事实上,依据我国《反垄断法》第13条、第14条以及第15条的规定所呈现出来的法律框架结构,可以很明显看出,欧盟反垄断法中长期所秉持的“禁止+豁免”规则才是我国反垄断法一直以来学习的立法蓝本。
具体来说,在“禁止+豁免”的反垄断审查规则框架下,一方面, 通过设置类似于“本身违法”的一般性条款对反向支付协议予以概括禁止,因为其本身就具有“赤裸裸”的横向垄断性质;另一方面,又通过豁免条款使个别具有显著促进创新作用的反向支付协议取得“合法性”,以防止“一般禁止”规定造成过度威慑。虽然与过度保护反向支付协议的专利范围测试规则以及谨慎审查反向支付协议的合理规则相比,“禁止+豁免”规则要显得更为严格,但对于我国如今特殊的国情现实,确实有诸多支持反垄断机构严格管制药品领域反向支付行为的理由,包括仿制药业发展隐而不彰、专利药品价格居高不下以及医保支出逐年攀升等因素,这些已经成为影响我国当下社会发展的典型突出问题。在此背景下,延迟廉价仿制药入市时间、维持高价专利药垄断地位的反向支付协议便具有了巨大的当罚性,我国诉诸更具严厉性的反垄断审查规则、更具针对性的反垄断分析框架也就无可厚非。因此,“禁止+豁免”的反垄断审查规则才是我国应当坚持的规制药品专利反向支付协议的正道。
5.2 尽快出台反向支付协议的反垄断规制指南首先,出台知识产权反垄断指南。2017年3月23日,国务院反垄断委员会发布了《关于滥用知识产权的反垄断指南(征求意见稿)》,但反向支付协议似乎无法在其中找到直接的适用依据,因而须对该指南作以下两方面完善。一方面,明确反向支付协议定性。域外国家反垄断机构趋向于将反向支付协议定性为横向垄断协议中的“市场分割协议”,可通过分析,发现其并未涉及对地域、客户以及产品等要素的划分。另外,目前我国也有部分学者认为反向支付协议应属于《反垄断法》第13条第4款规定的“限制开发新技术、新产品”,但问题是,在达成反向支付协议之前,仿制药企已经研制出了仿制药,并且专利药企也没有在协议中约定禁止仿制药企继续研制仿制药。据此,笔者认为,由于反向支付协议主要是通过延迟仿制药上市时间来限制特定时期(药品专利保护期)内药品市场上仿制药数量,这与横向垄断协议中的“数量限制协议”不谋而合,因而将反向支付协议定性为横向数量限制协议更有利于反垄断机构调查认定。另一方面,明确专利药企法律责任竞合处理原则。多数情况下专利药企对仿制药企实施的反向支付行为并不构成滥用市场支配地位,因为仿制药企之所以愿意延迟入市时间,最主要的动力来源是一般专利药企(不具有市场支配地位)与其平等协商后给付的巨额经济利益,而不是特殊专利药企(具有市场支配地位)凭借自身优势实施的“威逼利诱”行为。其中,“利诱”是惯常使用手段,少数情况下具有市场支配地位的专利药企才会以推出“授权仿制药”等极具杀伤力的手段相威胁,逼迫仿制药企与其进行“交易”,接受其提出的反向支付要求,放弃销售研发的“独立仿制药”,此时便构成了我国《反垄断法》第17条所规定的滥用市场支配地位中的“强制交易”行为,与垄断协议之间发生法律责任竞合。纵观目前世界不同法系国家处理法律责任竞合的实践做法,由于深受刑法竞合理论影响,在法律责任竞合问题上,各国大多采取的也是“从一从重”原则[20],换言之,当专利药企实施反向支付行为涉及垄断协议与滥用市场支配地位的法律责任竞合时,同样可按照刑法中的“想象竞合,择一重”原则予以处理。
其次,出台垄断协议豁免指南。2016年5月12日,国家发展和改革委员会起草公布了《垄断协议豁免一般性条件和程序的指南(征求意见稿)》,旨在为垄断协议豁免制度实施提供具体依据与详细指引,但截止目前,我国仍未颁布正式版本。针对反向支付问题,垄断协议豁免指南还须从实体和程序层面进行完善。在实体性规则设置上,鉴于某些反向支付协议也具有推动专利药企创新的积极作用,可以考虑将“促进创新”纳入到垄断协议豁免理由中,这样有利于提高经济效率,满足公众需求,与反垄断法实施的两大目标——经济目标与社会目标不谋而合。另外,2020年最新公布的《反垄断法修订草案(公开征求意见稿)》也已经在立法目的条文中增加了“鼓励创新”字样,若在垄断协议豁免指南中再次增添“促进创新”这一豁免情形,便可与立法目的相协调;在程序性规则设置上,德国采取的是“事先审查制”,即经营者之间达成垄断协议后,尚未付诸实施前,由反垄断机构根据经营者申请或依据职权主动审查垄断协议是否具备豁免条件[21]。反观我国,至今采取的仍是“直接适用制”,又称“事后审查制”,即经营者达成并实施垄断协议后,在被反垄断机构调查时,必须证明垄断协议满足豁免要求,才具备反垄断法排除适用可能性。之所以选择“直接适用制”,主要是因为当时我国反垄断法正处于起步阶段,反垄断机构力量相对有限,无法承担起过重的事前审查负担。现在,我国反垄断法实施已进入常态化时期,可以考虑在垄断协议豁免指南中改采“直接适用制为主,事先审查制为辅”的豁免模式。对于反向支付协议来说,直接适用制可以起到鼓励药品创新、支持药企发展的作用,事先审查制则可以降低药企合谋签订协议限制竞争的动机,二者有机结合、相互补充,方能增强反向支付协议反垄断法规制效果。
最后,出台医药行业反垄断指南。我国药品行业反垄断法实施尚处初级阶段,主要还是徘徊在药品市场流通领域,反垄断机构查处较多的仍是药企之间固定变更价格、分割销售市场以及联合抵制交易等垄断协议,并未深入到药品研发生产领域,而反向支付行为就发生于该领域,这属于药品行业进阶阶段反垄断法实施的问题[22]。当下,尽管反向支付现象尚未在我国药品领域扩张蔓延,但若依据我国如今推进药品市场化改革的政策松绑和药品研发创新的政策激励趋势进行预判,今后药品行业发展各个阶段,包括研发生产阶段,势必都会产生创新保护与竞争自由之间的冲突问题。因而,继汽车行业大规模反垄断调查之后,必须迅速将反垄断调查瞄头对准被诟病已久的药品行业,尽快针对药品研发生产环节启动反垄断主题研究,同时应与国家发展和改革委员会起草发布《汽车业反垄断指南》 (征求意见稿)一样,加紧制定《医药业反垄断指南》向社会公开征求意见。
6 结语药品专利反向支付协议是一种新型的滥用知识产权排除、限制竞争的垄断行为,因涉及专利法保护和反垄断法规制双重法益,且背后动机隐蔽、表现形式复杂,对药品市场竞争秩序影响巨大,已引起以美国为首的世界多国(地区)反垄断机构的关注,而现阶段我国反垄断学界对这一问题的研究却相当匮乏。在国内药品改革政策大力实施和药品专利制度逐步完善,以及药品消费需求日益增进的大环境驱动下,可以预见,未来我国药品领域必将出现鼓励创新与促进竞争之间的激烈利益冲突,反向支付协议也将随之应运而生,这亦是专利药和仿制药竞争与博弈的必然结果。从表面上看,反向支付协议似乎是专利药企行使其药品专利专属权,排除其他药企与之竞争的正当行为,并不存在违反反垄断法之说。但是深入分析后便会发现,实务中绝大多数反向支付协议涉及的药品专利其实非常脆弱,并不值得专利法给予保护。此时,专利药企与仿制药企合谋实施的反向支付行为不仅给仿制药及早入市竞争设置了壁垒,还损害了公众选择价廉质优仿制药的机会,这种涉嫌构成横向数量限制协议的垄断行为必须得由反垄断法介入规制。据此,我们有必要通过考察域外国家反向支付协议反垄断规制实践,在充分认识两大反垄断司法辖区美国、欧盟反向支付协议反垄断规制难题及反垄断审查规则的基础上,有针对性地学习借鉴反向支付协议反垄断规制经验。但我们必须清楚,照搬照抄域外国家反向支付协议反垄断规制经验并非良策,必须立足我国药品行业发展现状,制定出真正符合我国实际情况的反垄断规制策略。
| [1] |
郭德忠. 美国药品专利领域反向支付的反托拉斯问题[J]. 北京理工大学学报(社会科学版), 2015, 17(3): 156-161. |
| [2] |
程永顺, 吴莉娟. 创新与仿制的平衡与发展——评Hatch-Waxman法案对美国医药产业的贡献[J]. 科技与法律, 2018(1): 1-9. |
| [3] |
王鑫, 甄橙. 美国Hatch-Waxman法案的缺陷与完善研究[J]. 中国新药杂志, 2018, 27(6): 609-614. |
| [4] |
曹志明. 药品领域反向支付问题研究[J]. 知识产权, 2017(9): 63-66. |
| [5] |
郑鹏程. 美国反垄断法"本身违法"与"合理法则"适用范围探讨[J]. 河北法学, 2005(10): 122-126. |
| [6] |
UnitedStates Court of Appeals, Sixth Circuit.IN RE: CARDIZEM CD ANTITRUST LITIGATION[EB/OL]. (2003-06-13)[2020-06-23].https://caselaw.findlaw.com/us-6th-circuit/1046873.html.
|
| [7] |
丁锦希, 邵美玲.美国专利反向支付协议反垄断诉讼适用规则现状研究[C]//中国药学会医药知识产权研究专业委员会.2013年学术年会会议资料.北京: 中国药学会, 2013: 5.
|
| [8] |
丁锦希, 邵美令, 孟立立. 美国知识产权反垄断诉讼中专利范围测试规则的适用及启示——基于"Schering V.S. Upsher"案实证分析[J]. 知识产权, 2013(6): 91-95. |
| [9] |
United States Court of Appeals, Eleventh Circuit. SCHERING PLOUGH CORPORATION v. FEDERAL TRADE COMMISSION[EB/OL].(2005-03-08)[2020-06-23]. https://caselaw.findlaw.com/us-11th-circuit/1149207.html.
|
| [10] |
宋建宝. 专利诉讼反向支付和解协议的反垄断审查:美国的规则与实践[J]. 知识产权, 2014(2): 91-97. |
| [11] |
Okada, Seiko, F. In Re K-Dur Antitrust Litigation:Pharmaceutical Reverse Payment Settlements Go beyond the Scope of the Patent[J]. North Carolina Journal of Law & Technology, 2012, 303-340. |
| [12] |
United States Court of Appeals, Third Circuit.IN RE: K-DUR ANTITRUST LITIGATION[EB/OL]. (2012-07-16)[2020-06-23] https://caselaw.findlaw.com/us-3rd-circuit/1606197.html.
|
| [13] |
U.S. Supreme Court.FTC v. ACTAVIS, INC[EB/OL]. (2013-06-17)[2020-06-23]. https://www.law.cornell.edu/supremecourt/text/12-416.
|
| [14] |
赵歆. 欧盟医药行业专利和解协议的竞争法分析[J]. 科技与法律, 2013(4): 32-37. |
| [15] |
EUROPEAN COMMISSION.8th Report on the Monitoring of Patent Settlements[EB/OL]. (2018-03-09)[2020-06-01] https://ec.europa.eu/competition/sectors/pharmaceuticals/inquiry/patent_settlements_report8_en.pdf.
|
| [16] |
Mélanie Bruneau, Wilko van Weert.EU Court Confirms European Commission's Decision on Pay-for-Delay Agreements[EB/OL].(2016-10-20)[2020-06-23] https://www.antitrustalert.com/2016/10/articles/ecdevelopments/eu-court-confirms-european-commissionsdecision-on-pay-for-delay-agreements/.
|
| [17] |
Dechert LLP.The Servier Judgment: A Breath of Fresh Air for Pharmaceutical Companies?[EB/OL]. (2018-12-21)[2020-06-23]. https://www.jdsupra.com/legalnews/the-servier-judgment-a-breath-of-fresh-19625/.
|
| [18] |
刘廷涛. 欧盟卡特尔适用规则及豁免规定对中国之启示[J]. 东方法学, 2015(3): 134-144. |
| [19] |
孙瑜晨. 医药专利反向支付协议的反垄断规制研究——基于美国近十年学术文献的分析[J]. 情报杂志, 2018, 37(10): 112-119, 61. |
| [20] |
孙华璞. 法律责任竞合理论初探[J]. 人民司法(应用), 2017, 771(4): 32-41. |
| [21] |
罗毅. 关于垄断协议豁免制度的思考[J]. 价格理论与实践, 2014(5): 23-25. |
| [22] |
陈兵. 美国药品领域反向支付的反垄断司法经验解读与启示——以反垄断审查规则为线索[J]. 上海财经大学学报, 2018, 20(5): 123-138. |
 2020, Vol. 22
2020, Vol. 22

